2023 Volume 63 Issue 12 Pages 843-846
2023 Volume 63 Issue 12 Pages 843-846
症例は25歳男性である.発熱後の間代性痙攣で発症し,てんかん重積状態となった.発症様式はnew-onset refractory status epilepticus(NORSE)の臨床像に合致し,最終的にcryptogenic NORSE(c-NORSE)と診断した.第10病日より複数の免疫抑制療法を導入したが,転帰は不良であった.髄液IL-6は脳波上の発作頻度が増加する第6病日から第11病日の間で著明に上昇しており,IL-6はc-NORSEの病初期における発作増悪に関与する可能性が示唆された.
A 25-year-old male presented with clonic seizures three days following a fever. The patient developed status epilepticus and required mechanical ventilation and intravenous anesthesia. The patient’s epileptic seizures persisted despite administering intravenous anesthesia and multiple anti-epileptic drugs. The clinical presentation in this case, without pre-existing relevant neurological disorder and an active structural, toxic, or metabolic cause in the acute phase, was compatible with new-onset refractory status epilepticus (NORSE). After immunotherapy, including intravenous methylprednisolone, plasma exchange, and intravenous immunoglobulin therapy, the epileptic discharge on electroencephalogram (EEG) decreased gradually, and mechanical ventilation was discontinued. Neversless the final outcome was poor. The patient’s condition was finally diagnosed as cryptogenic NORSE. The IL-6 levels in the cerebrospinal fluid showed a significant increase between day 6 and 11 after onset, during which time there was a rapid escalation in seizure frequency on EEG. Considering this, IL-6 may be involved in the process of seizure exacerbation.
New-onset refractory status epilepticus(NORSE)とは発症以前にてんかんやその他の神経疾患の既往がない患者に発症し,急性期に器質的疾患,中毒性疾患,また代謝性疾患を認めず,難治性てんかん発作が持続する臨床症状を呈する1).病初期の発作増悪過程で髄液IL-6が上昇したcryptogenic NORSE(c-NORSE)を経験した.
症例:25歳,男性
主訴:痙攣,意識障害
既往歴:特記事項なし.
家族歴:家族内に類症なし.
生活歴:特記すべき薬物の曝露歴なし.飲酒は機会飲酒.
現病歴:25歳時,入院5日前から頭痛を認め,入院3日前に39°Cの発熱を認めた.入院日の9時に夜勤を終えて退勤したことを同僚が確認している.19時に屋外で倒れている状態で発見され,通行人が救急要請した.救急隊到着時に全身の間代性痙攣を認め,当院に搬送となった.
入院時現症:身長175 cm,体重79.7 kg,脈拍82/分・整,血圧119/64 mmHg,体温36.8°C,SpO2 99%(室内気),一般身体所見に異常はなかった.
神経学的所見:意識はGCS: E3V2M6であった.脳神経所見は,瞳孔は両側3 mm,対光反射は直接,間接ともに迅速だった.頭部および眼球共同偏倚はなかった.四肢の筋緊張亢進は認めず,痙攣も認めなかった.痛み刺激には左右差なく反応した.Babinski反射とChaddock反射はいずれも左で陽性だった.項部硬直およびKernig徴候はなかった.
検査所見:血液検査で血算や血糖値に異常はなく,電解質,甲状腺機能は正常で,CRPの上昇もなかった.抗核抗体,抗ds-DNA抗体,抗SS-A/Ro抗体,抗SS-B/Ro抗体,抗GAD抗体,抗MPO-ANCA,抗PR3-ANCAはいずれも正常,可溶性IL-2セレプターは陰性だった.髄液所見は,外観は無色透明,初圧160 mmH2O,細胞数22/μl(単核球のみ),糖63 mg/dl(血液:131 mg/dl),蛋白定量92 mg/dl,IgG index 0.41,髄液中の単純ヘルペスウイルス,水痘-帯状疱疹ウイルス,ヒトヘルペスウイルス6型はPCR法で陰性だった.一般細菌培養と抗酸菌培養は陰性,ムンプス,EBウイルス,サイトメガロウイルスの血清IgM抗体およびHIV抗原は陰性,さらに既知の血清および髄液抗神経抗体(抗NMDA受容体抗体,抗AMPA受容体抗体,抗GABA(A)抗体,抗GABA(B)抗体,抗mGluR1抗体,抗mGluR5抗体,抗LGL1抗体,抗CASPER2抗体,抗Glu-R抗体,抗DPPX抗体,抗Neurexin3抗体,抗Iglon5抗体)は陰性であった.頸胸腹部造影CTで悪性腫瘍は認めなかった.入院時頭部MRIで脳実質に器質的異常や信号変化はなかった.
経過:臨床経過をFig. 1に示した.入院時髄液所見は単核球の細胞数上昇と糖の低下であり,痙攣を伴う髄膜炎(原因および機序不明)と考えアシクロビル静注とセフトリアキソンを開始した.またレベチラセタム投与にも関わらず,入院から10時間後にてんかん重積状態となり,人工呼吸器管理,および持続脳波計によるモニタリングを開始した.第4病日に右顔面から始まる全身痙攣が出現し,脳波では左頭頂部を焦点とした発作波に続き(Fig. 2A),棘徐波複合へ移行する波形を認めた(Fig. 2B).各種薬剤投与に加えてステロイドパルス療法を施行したが,持続脳波計で全般性発作波が持続した.第10病日の頭部MRIのfluid-attenuated inversion-recovery(FLAIR)画像で脳表と両側海馬に信号上昇を認め,てんかん発作による脳症と髄膜脳炎と診断した(Fig. 2C, D).培養検査は陰性,各種ヘルペスウイルスはPCR法で陰性であり感染性機序は否定的と考え,自己免疫学性機序を考慮し,第10病日より単純血漿交換療法を計5回施行し,2回目のステロイドパルス療法を施行した.ケタラール2),フェノバルビタールおよびベランパネルを開始したが全般性発作波は持続し,プレドニゾロン40 mg/日,さらに免疫グロブリン療法を30 g/日で5日間施行した.第32病日より脳波上の発作波出現頻度は減少し,第34病日には消失した.髄液IL-6は第6病日に10.9 pg/mlであったが第11病日211 pg/mlと著明に上昇した.免疫抑制療法導入後の第27病日には8.9 pg/mlに改善した.第60病日に人工呼吸器管理を終了した.気管切開後のため発語は不可能であったが筆談や身振りでの意思疎通が可能となった.しかしその後も全身性の痙攣は月に1,2回の頻度で出現した.発症から1年6カ月後の頭部MRI・FLAIR画像では前頭葉優位の脳萎縮を認めた.また両側海馬に萎縮を認め海馬硬化症への移行を疑った(Fig. 2E, F).最終的に菌血症による多臓器不全で発症から2年4カ月後に死亡した.家族の同意を得て病理解剖を実施した.
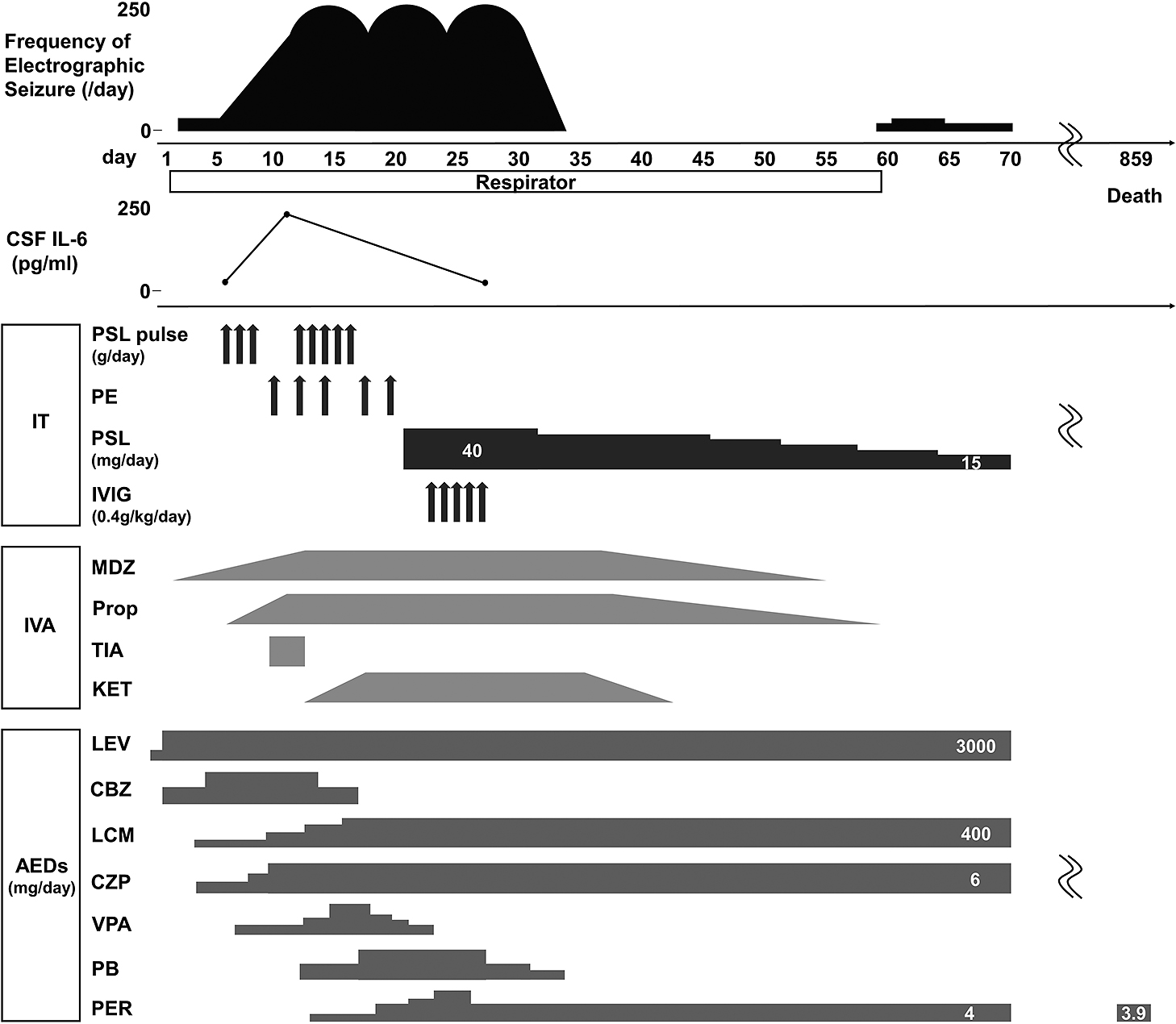
Convulsion improved after treatment of multiple AEDs and IVA, but frequency of electrographic seizure was worsed. The addition therapy with a second high-dose intravenous mPSL, PE, and IVIG improved frequency of electrographic seizure, but final outcome was unfavorable. CSF, cerebrospinal fluid; AEDs, antiepileptic drugs; CBZ, carbamazepine; CZP, clonazepam; IT, immunotherapy; IVA, intravenous anesthetic; IVIG, intravenous immunoglobulin; KET, ketamine; LCM, lacosamide; LEV, levetiracetam; MDZ, midazolam; mPSL, methylprednisolone; PB, Phenobarbital; PE, plasma exchange; PER, perampanel; Prop, propofol; TIA, thiamylal; VPA, sodium valproate.
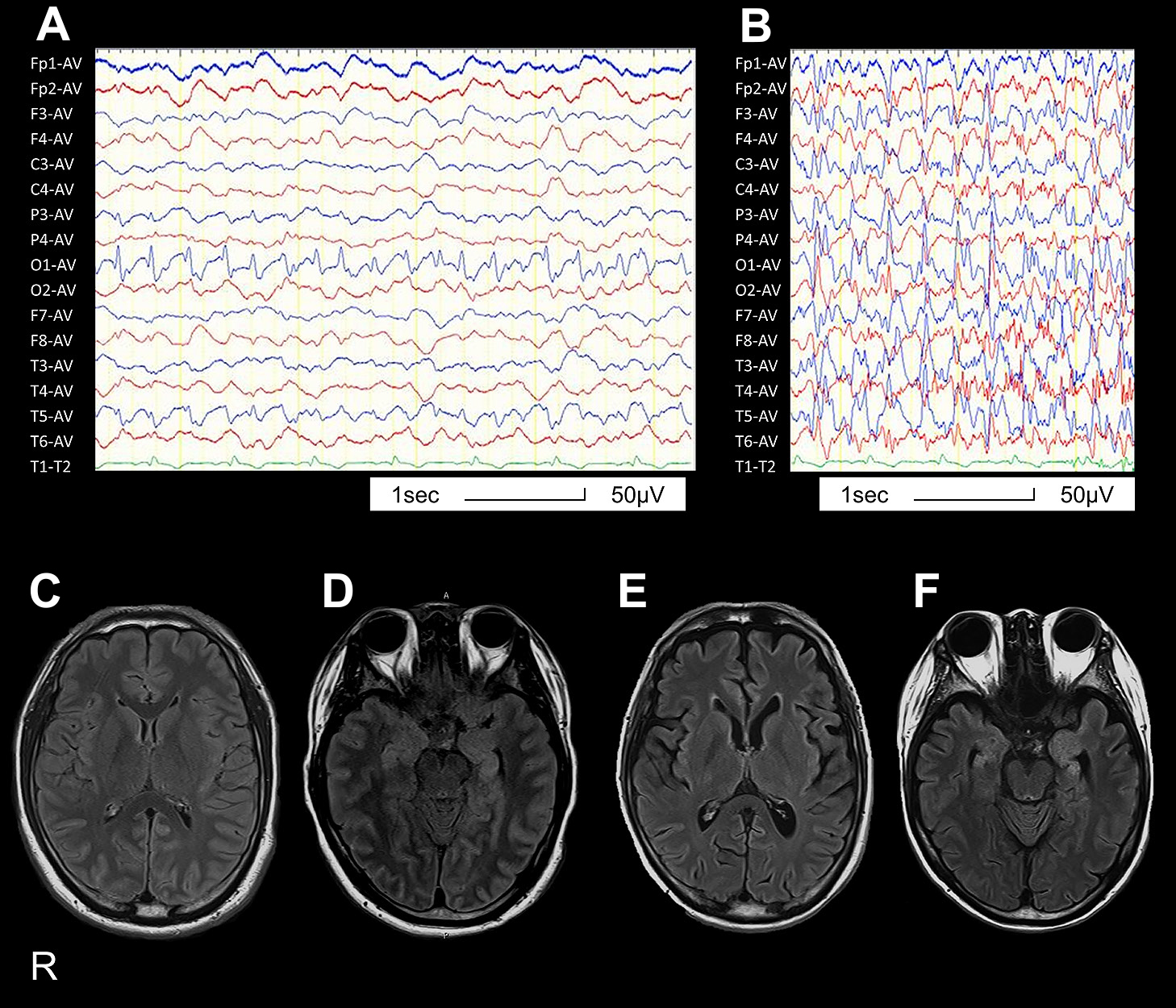
A: EEG shows spike wave in the left central region. B: EEG shows generalized spike and slow wave complex. C, D: FLAIR axial (3 T; TR 9,000 ms, TE 102 ms) shows mild hyperintense signal in brain surface, mainly the cortex. E, F: FLAIR axial (3 T; TR 9,000 ms, TE 102 ms) shows brain atrophy with frontal lobe dominance and bilateral hippocampal atrophy.
病理所見:両側海馬硬化を認めたが,痙攣重積後の変化として矛盾なかった.中枢神経系全般にトキソプラズマ虫体を含むミクログリア結節や膿瘍を認めたが,発症前に免疫不全の既往はなく,免疫抑制剤使用に伴う感染と考えた.NORSEの原因は特定できなかった.
本症例は神経疾患の既往はなく,薬物使用歴はなく,代謝障害は認めず,画像検査で器質的異常がないことからNORSEの臨床像に合致し,複数の免疫抑制療法で改善を得た.
NORSEの原因が特定できない例をc-NORSEと呼ぶ1).NORSEに該当したシステマティックレビューでは半数がc-NORSEであった.判明した最多の原因は傍腫瘍性を含む自己免疫性脳炎であった3).本症例の微生物検査は全て陰性であり,膠原病も指摘できなかった.傍腫瘍性神経症候群及び自己免疫性脳炎を考慮したが,造影CTで悪性腫瘍は示唆されず,既知の抗神経抗体も全て陰性であった.剖検まで実施したが,NORSEの原因を特定できずc-NORSEと診断した.
C-NORSEの詳細な病態は不明だが,炎症を介したてんかん発生が推察されている4).特にIL-6は炎症が介在する神経細胞障害に重要である5).NORSEの類縁疾患であるfebrile infection related epilepsy syndromeの症例では血清および脳髄液中でのIL-6高値が報告されており,同様にc-NORSEの病態へIL-6の関与が推察されている6).c-NORSEに対する治療は確立しておらず,ステロイドパルス療法などの古典的な免疫抑制療法が施行される場合があるが効果は限定的である7).一方で上記の病態仮説からIL-6受容体拮抗薬を導入し奏効した報告もある8).本症例はステロイドパルス療法,単純交換療法,免疫グロブリン療法を継続し,次第に発作頻度は改善したが,最終的な転帰は不良であった.本症例でも髄液IL-6の上昇を認めたが,特筆すべきは発作頻度が増加する第6病日から第11病日にかけて著明に上昇しており,発作増悪の過程にIL-6が関与している可能性が示唆された.本例の経過では感染性機序を否定しきれず免疫抑制療法導入開始の判断は困難であったが,第10病日よりも早期の治療介入により臨床経過の改善が期待できた可能性があると考えた.また現時点では保険適応外であるIL-6受容体拮抗薬の早期導入は,将来的な治療選択肢の一つとして考慮できるかもしれない.
謝辞:抗神経抗体の測定にご協力頂いた北里大学医学部脳神経内科の飯塚高浩先生,またバルセロナ大学神経内科学のJosep Dalmau先生に深く感謝致します.
※著者全員に本論文に関連し,開示すべきCOI状態にある企業,組織,団体はいずれも有りません.