2023 Volume 63 Issue 8 Pages 513-517
2023 Volume 63 Issue 8 Pages 513-517
症例は83歳,男性.再発性・難治性の多発性骨髄腫(multiple myeloma,以下MMと略記)に対しダラツムマブ,ボルテゾミブ,デキサメタゾンの投与(DBd療法)開始1か月後より視力低下,右上下肢の運動麻痺が出現した.血液検査ではCD4+ Tリンパ球数は132/μlと低下し,頭部MRIでは両側後頭葉,および左中心前回にFLAIR画像で高信号域を認めた.脳脊髄液JCウイルス-DNA PCR検査は85 copies/mlと陽性であり,進行性多巣性白質脳症と診断した.MMの治療薬をすべて中止し,メフロキンとミルタザピンの併用療法を開始したが効果はなかった.
An 83-year-old man presented with visual disturbance and right hemiparalysis, one month after daratumumab, bortezomib, and dexamethasone administration for multiple myeloma (MM). Blood screens revealed a CD4+ T-lymphocyte count of 132/μl. Diffusion weighted and fluid-attenuated inversion-recovery MR imaging showed high intensity signals in the both occipital lobes and left precentral area. The patient had no history of human immunodeficiency virus infection. Cerebrospinal fluid (CSF) JC virus (JCV) was positive (83 copies/ml), as indicated by PCR. The patient was diagnosed with progressive multifocal leukoencephalopathy (PML). MM treatment was discontinued, and mefloquine and mirtazapine therapy was started. However, the CSF JCV-DNA PCR count did not improve (111 copies/ml) after 30 days from starting mefloquine and mirtazapine therapy. The patient died six months after symptom onset. Conclusively, patients with decreased CD4+ T lymphocyte counts following DBd therapy for MM, the possibility of PML should be considered.
進行性多巣性白質脳症(progressive multifocal leukoencephalopathy,以下PMLと略記)は,JCウイルス(JC virus,以下JCVと略記)の再活性化による致死的な中枢神経系の脱髄性疾患である1).CD38を標的とするヒト化モノクローナル抗体であるダラツムマブを従来薬であるボルテゾミブおよびデキサメタゾンに併用するDBd療法は,再発・難治性の多発性骨髄腫(multiple myeloma,以下MMと略記)の治療法である2)3).今回我々は再発・難治性MMに対するDBd療法後にPMLを発症した1例を報告する.
症例:83歳,男性
主訴:視力低下,右上下肢の運動麻痺
既往歴:2型糖尿病.
現病歴:78歳時にIgG-λ型MM(国際病期分類:ISS-II)と診断され,レナリドミド,デキサメタゾンを用いた化学療法によって寛解を得た.2度目の再発に対してポマリドミド,デキサメタゾンを投与されたが寛解には至らなかった.83歳時には明らかな病状の悪化を認めたため,DBd療法が開始された.投与1か月後より視力低下を自覚したが,眼科の診察では視力低下の原因は特定できなかった.その後,当科へ紹介受診となった.視力低下に加えて右上下肢の運動麻痺を認めたため検査加療目的に入院となった.
入院時所見:血圧98/62 mmHg,脈拍98/分・整,体温37.8°C,身長156 cm,体重40 kg.一般身体所見に異常所見は認めなかった.
神経学的所見:意識状態はJCS 1,GCS E4V4M6,改訂長谷川式簡易知能評価スケールは15/30であった.脳神経では両眼の視力は手動弁であり,両側の眼球運動障害(上下・内転制限)を認めた.運動系では右上下肢に徒手筋力テストで1程度の筋力低下を認めた.腱反射は右上下肢で亢進していたが,Babinski徴候とChaddock徴候は両側陰性で,感覚系では触覚と温痛覚は両上下肢とも正常であった.
血液検査ではWBC 3,600/μl(リンパ球数288/μl,CD4+ Tリンパ球数132/μl)とリンパ球数が低下しており,CD4+/CD8+比は0.7(54/78)であった.凝固系,電解質,肝機能,腎機能,甲状腺機能に異常はなく,CRP 5.46 mg/dl,HbA1c 7.5%,IgG 407 mg/dl,IgA <7.9 mg/dl,IgM <5.3 mg/dlであった.抗核抗体,抗SS-A抗体,MPO-ANCA,PR3-ANCA,HIV-1/2抗原,β-D-グルカン,白血球中CMVpp65抗原はいずれも陰性であった.脳脊髄液検査では初圧150 mmH2O,細胞数 <5/μl,蛋白137 mg/dl,糖91 mg/dl,IgG index 0.64であった.胸腹部造影CTで右肺野に肺炎像を認めたが,体幹部に明らかな腫瘍性病変は認めなかった.頭部MRI拡散強調画像,およびFLAIR画像では両側の後頭葉,左頭頂葉に高信号を呈する白質病変を認めたが,これらの病変の造影効果は認めなかった(Fig. 1).頭部MRI所見と臨床経過からPMLを疑い,第2病日に採取した脳脊髄液のJCV-DNA PCR検査を国立感染症研究所ウイルス第一部へ依頼したところ,85 copies/mlと陽性であった(Fig. 2).検出されたJCVは,ウイルスゲノムの非コード転写調節領域に変異を有するプロトタイプウイルスであった.そのため,本例は原疾患および治療薬により誘発されたPMLと考えられた.ダラツムマブが関与した可能性が推察されたため同療法を中止した.DBd療法の中止1ヵ月後(第30病日),リンパ球数420/μl,CD4+ Tリンパ球数172/μlと依然として低値であり,頭部MRIでは病変の拡大を認め意識障害が急速に増悪し,半昏睡状態となった.PMLの病態が増悪したと判断し,PML情報センターから非HIV-PMLの治療としてメフロキンとミルタザピンの併用療法を推奨されたため,院内薬事委員会の承認(受付番号2022-029)を経て第31病日よりメフロキン275 mg/週とミルタザピン15 mg/日の投与を開始した(Fig. 2).第60病日にも意識障害の回復は認めず,脳病変の改善も認めなかった.第61病日に脳脊髄液JCV-DNA PCRを再検したが,111 copies/mlと改善しておらず,MMの治療を再開できなかった.第69病日にメフロキンとミルタザピンの投与を終了とした上で緩和的対応のため転院となり,第159病日に転院先の病院で誤嚥性肺炎を発症し同日永眠された.

(A) Diffusion-weighted imaging and (B) fluid-attenuated inversion recovery imaging (3.0 Tesla scanner) revealing a high-intensity white matter lesion in the left frontal, and parietal lobe and bilateral temporal and occipital lobes. (C) Gadolinium-enhanced T1-weighted imaging indicating no changes in the brain lesion with a low-intensity white matter lesion in the left frontal and pariental lobes, and bilateral temporal and occipital lobes.
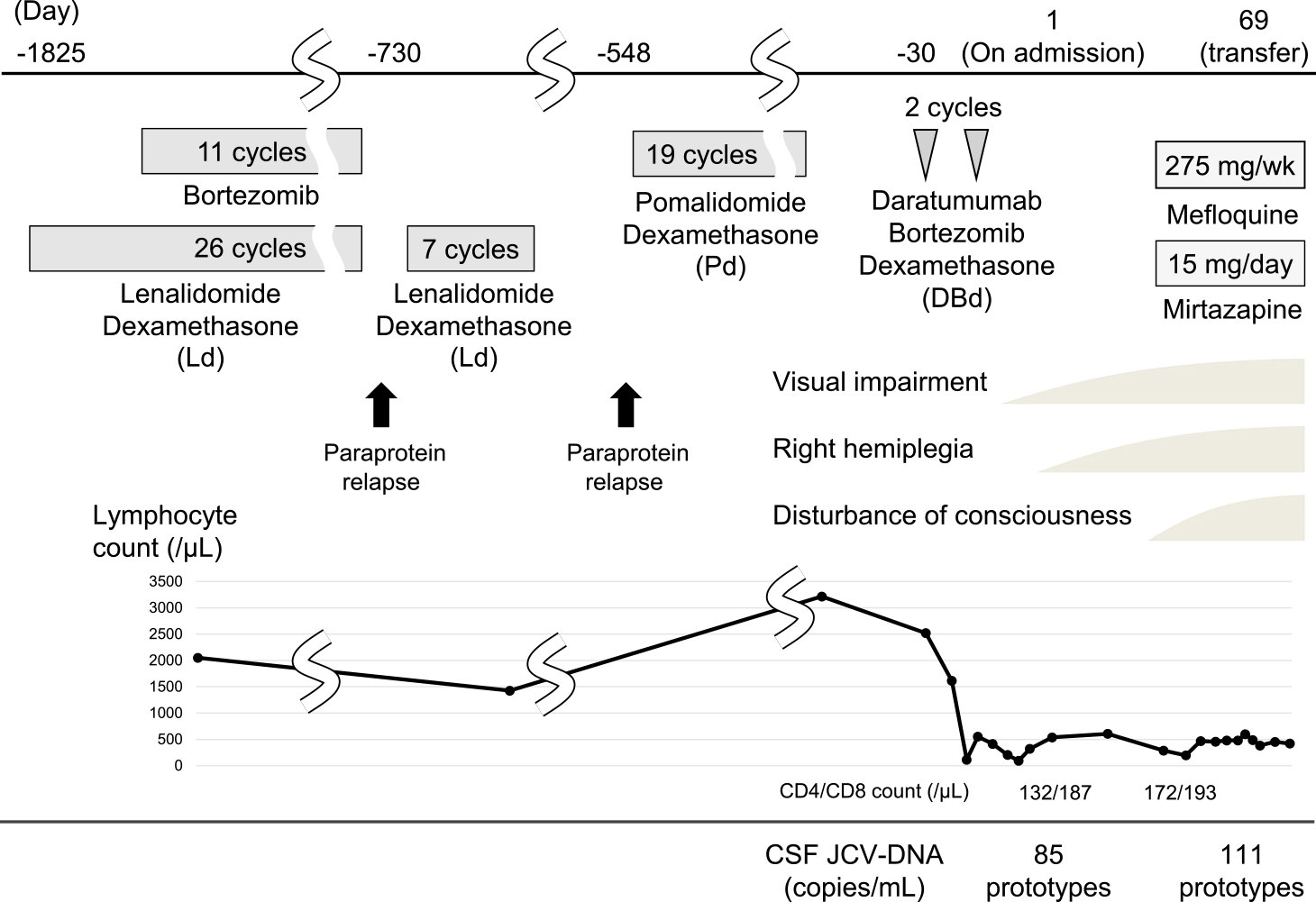
The upper part of the figure presents medication and clinical manifestations, whereas the lower part presents blood lymphocyte counts (per μl) over time.
本例はDBdの投与開始後より視力低下と右上下肢の運動麻痺が急速に進行しPMLと診断した1例である.本症例には二つの特徴がある.一つ目はダラツムマブの投与開始後早期にPMLによる神経症状を呈したこと,二つ目はメフロキンとミルタザピンの投与を開始しても脳脊髄液JCV-DNAが陰転化しなかったことである.
ダラツムマブに関連しPMLを発症した例は過去に3例報告されている(Table 1)4)~6).いずれもダラツムマブの投与開始から神経症状が出現するまで10か月(7 cycles)以上を要していた.本例はダラツムマブ投与後から1か月後(2 cycles)に神経症状が出現しており,既報告より短期間でPMLを発症したものと考えられた.要因としては,ダラツムマブ投与後の顕著なリンパ球数の減少があげられる(Fig. 2).特に本例のPML発症時のCD4+ Tリンパ球数は132/μlと低値であった.ダラツムマブ投与に関連したPMLの既報告ではPML発症時のCD4+ Tリンパ球数は190/μlと低く,本例と合致した(Table 1)6).実際,既報告例では特発性CD4+ Tリンパ球減少症がPML発症と関連しており,またCD4+ Tリンパ球数を正常化することによりPMLの臨床的改善につながったと記載されている7).このように,CD4+ Tリンパ球を含めたリンパ球の機能障害はPML発症の原因と推察される8).ダラツムマブはCD38を標的とするヒト化モノクローナル抗体であるが,CD38は骨髄腫細胞以外にも正常な形質細胞・骨髄系細胞9)~12),さらにはNK細胞,単球,B細胞,T細胞にも発現している13).そのため,本例ではダラツムマブ投与によりT細胞系のリンパ球全体が機能不全となった可能性が否定できない.実際にMMに対するDBd療法におけるリンパ球減少症の発生率は13.2%であり3),またダラツムマブの投与開始後よりリンパ球数が高度に低下し,CD8+ Tリンパ球数が減少した報告がある14).加えて,本例で併用されたプロテアソーム阻害剤であるボルテゾミブはT細胞のCD38発現を上昇させることによりダラツムマブの効能を強化し,その結果としてリンパ球数が高度に減少した可能性がある3).DBd療法を実施中のMM例ではCD4+ Tリンパ球数を評価し,CD4+ Tリンパ球数が低下した際にはPMLの発症に注意する必要性がある.そのほか本例は既報告例と比較して高齢であること,およびデキサメタゾン併用も影響した可能性が考えられる.
| Case | Monge et al4) | Steinhardt et al5) | Seko et al6) | Present case |
|---|---|---|---|---|
| Age | 63 | 59 | 69 | 83 |
| Type of MM | IgA lambda | Unknown | IgG kappa | IgG kappa |
| Duration of Daratumumab |
10 months | 1.5 year (20 cycles) |
10 months (7 cycles) |
1 month (2 cycles) |
| CD4+ T lymphocytes (/ml) |
N/A | N/A | 190 | 132 |
| Previous treatment for MM |
PBSCT Melphalan Thalidomide Lenalidomide Bortezomib Doxorubicin |
Allo-HSCT Pomalidomide Bortezomib Cyclophosphamide |
Carfilzomib | Melphalan Lenalidomide Bortezomib Pomalidomide |
| Time of PML from MM diagnosis |
7 years | 11 years | 10 months | 5 years |
| CSF JCV-DNA Pre/Post treatment for PML (copies/ml) |
98/95 | 560/Negative | 1137/Negative | 85/111 |
| JCV DNA mutation |
N/A | N/A | Prototype | Prototype |
| Treatment for PML |
Discontinuation of treatment for MM | Discontinuation of treatment for MM Transfer of JC Virus-Specific T Lymphocytes |
Discontinuation of treatment for MM | Discontinuation of treatment for MM Mirtazapine Mefloquine |
| Treatment outcome |
Alive (8 weeks) |
Alive (12 months) |
Alive (13 months) |
Dead (5 months) |
CSF, cerebrospinal fluid; HSCT, hematopoietic stem cell transplantation; JCV, JC virus; MM, multiple myeloma; N/A, not available; PBSCT, peripheral blood stem cell transplantation; PML, progressive multifocal leukoencephalopathy.
本例ではダラツムマブの投与を中止し,メフロキンとミルタザピンの併用療法を行った後も神経症状や白質病変は改善せず,脳脊髄液JCV-DNAは陰性化しなかった.ダラツムマブに関連してPMLを発症した既報告例では,いずれも本例とは異なりダラツムマブ投与の中止により神経症状が改善している(Table 1)4)~6).本例の病態が進行した原因として,ダラツムマブを含めたDBd療法の中止による免疫再構築症候群(immune reconstitution inflammatory syndrome,以下IRISと略記)が出現したか,あるいはPMLの病態が増悪したか,のいずれかの可能性が考えられた.文献的には過去のダラツムマブ関連PMLにおいてIRISを発症したという報告はなく,加えて本例ではダラツムマブ投与終了後もリンパ球数が420/μlと低下したままであった.さらに頭部MRIでは浮腫や造影効果を伴う変化など積極的にIRISを疑う所見は認めなかった.そのため,本例でDBd療法の中止後も病状が急速に増悪した原因としてはPML自体が進行したものと判断した.実際にメフロキンとミルタザピンの投与後も脳脊髄液JCV-DNA PCR値は111 copies/mlと改善していなかった.ダラツムマブなど血液腫瘍疾患の薬剤に関連して発症した非HIVの薬剤性PMLに対するメフロキンとミルタザピンの有効性には議論があり1),今後の症例の蓄積が必要である.ダラツムマブ関連を含むPML症例に対し,JCVを標的とした特異的T細胞を移植する治療法が有効であったという報告が複数あり5)15),今後本例のようなPML症例に対しても臨床応用が可能となることが期待される.
MMに対するDBd療法中にCD4+ Tリンパ球数の低下を認めた症例ではPMLの発症に注意すべきである.また原因となる薬剤を中止し,メフロキンとミルタザピンの併用療法を行っても救命しえない可能性がある.
謝辞:治療方針を御教示下さった,都立駒込病院内PML情報センター,三浦義治先生に深謝する.本研究の一部は,厚生労働科学研究費補助金難治性疾患政策研究事業「プリオン病及び遅発性ウイルス感染症に関する調査研究班」(研究代表者 高尾昌樹)ならびにJSPS科研費(21K07450,22K07392)の助成によって行われた.
本報告の要旨は,第164回日本神経学会東海・北陸地方会で発表し,会長推薦演題に選ばれた.
※著者全員に本論文に関連し,開示すべきCOI状態にある企業,組織,団体はいずれも有りません.