2024 Volume 64 Issue 4 Pages 280-285
2024 Volume 64 Issue 4 Pages 280-285
症例は75歳女性.2021年3月に左橋出血を発症した.保存的加療を行ったが,右上下肢の不全麻痺が残存した.2022年10月より右上下肢の運動失調と不随意運動を認め当科紹介となった.診察上,右上下肢の小脳性運動失調に加えて2 Hz程度の静止時振戦を認め,姿勢時,企図時に増強された.病歴と画像所見より橋出血に起因するHolmes振戦と診断した.Holmes振戦は脳幹や視床の病変に続発する稀な運動異常症で,片側性の粗大な振戦が特徴的である.123I-IMP SPECTとMRIの所見から小脳視床路と歯状核赤核オリーブ路の障害が発症に関与したことが示唆された.
A 75-year-old woman was referred to our department in October 2022 with ataxia and involuntary movements of the right upper and lower limbs. She had experienced a left pontine hemorrhage in March 2021, which was managed conservatively. However, she had residual right-sided hemiplegia. In addition, she had cerebellar ataxia and a 2 Hz resting tremor of the right upper and lower limbs, which was enhanced while maintaining posture and contemplation. Based on her history, and the findings of MRI and nuclear medicine imaging, we diagnosed the patient with Holmes tremor due to pontine hemorrhage. Holmes tremor is a rare movement disorder secondary to brainstem and thalamic lesions, characterized by a unilateral low-frequency tremor. In this case, 123I-IMP SPECT and MRI shows damage to the cerebellothalamic tract and dentaro-rubro-olivary pathway.
Holmes振戦は脳血管障害や頭部外傷などに続発する稀な運動異常症である.静止時の他,企図時や姿勢時に増強される5 Hz未満の粗大で律動的な振戦が特徴とされ1),小脳視床路,歯状核赤核オリーブ路,黒質線条体路の障害が原因とされる2).今回,左橋出血の20か月後に発症したHolmes振戦の1例を経験し,MRI検査,123I-IMP SPECT(Single photon emission computed tomography)や123I-FP-CIT SPECTを施行した.本症例における画像所見がHolmes振戦の発症機序の理解に有用と考えられたため報告する.
症例:75歳,女性
主訴:右手がうまく使えない,うまく歩けない
既往歴:左橋出血,高血圧,脂質異常症.
家族歴:なし.
現病歴:2021年3月に右片麻痺のため当院に搬送された.画像検査を行い,左橋出血と診断した(Fig. 1).血腫は中脳赤核周囲まで広がりを認めた.保存的加療を行い,右上下肢の麻痺と感覚鈍麻が残存したものの歩行器歩行が可能となるまで症状の改善を認めた.2022年10月頃より右手の使いにくさや歩きにくさを自覚するようになったため前医を受診した.診察上,右上下肢の運動失調に加えて右上肢の粗大な振戦を認めた.その後も症状の増悪を認めたため同年12月に当科に紹介,精査加療目的に入院した.
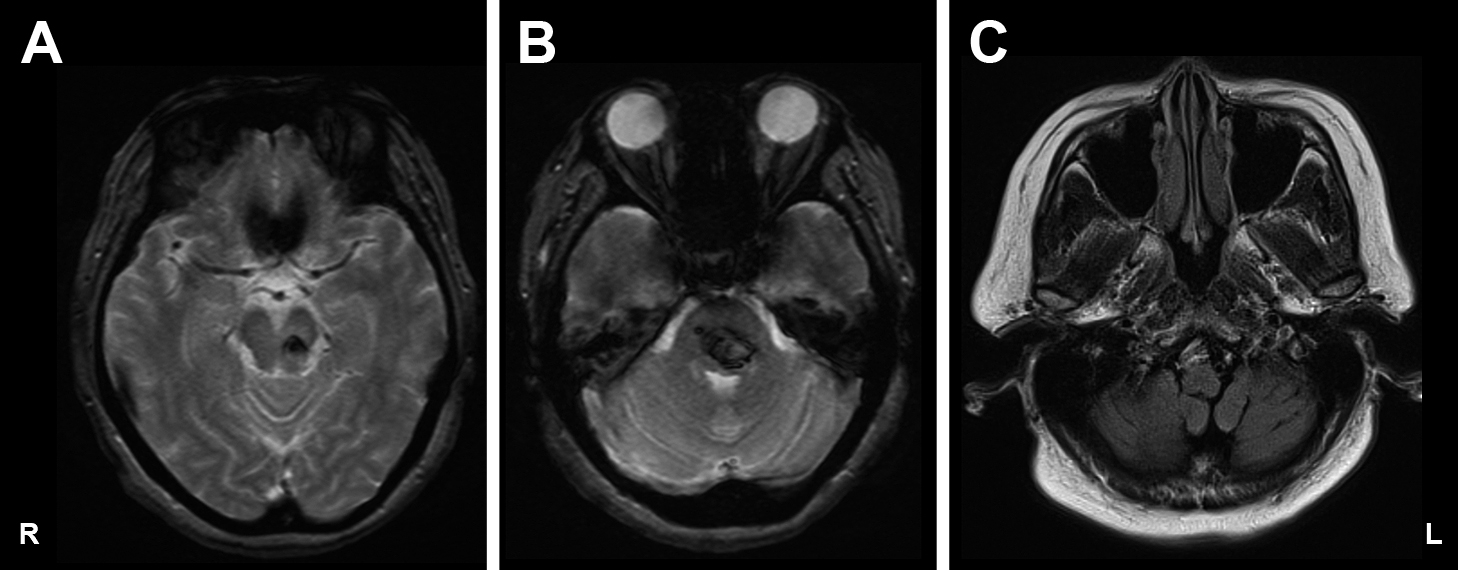
MRI showing hemorrhage in left brainstem (A, B), with no evidence of hypertrophy of the left inferior olivary nucleus (C).
入院時現症:体温 36.9°C,血圧 126/109 mmHg,脈拍数 78/分,SpO2 97%(室内気),呼吸数 22/分.一般身体所見に特記事項なし.意識清明.眼振や衝動性,滑動性眼球運動障害,眼球ミオクローヌスなどの小脳性眼球運動障害は認めない.構音障害は認めず,口蓋ミオクローヌスも認めない.その他脳神経系に特記すべき異常を認めない.右上下肢に2 Hz程度の規則的で粗大な静止時,姿勢時,企図時振戦を認める(Fig. 2).また,指鼻指試験,膝踵試験で右上下肢の小脳性運動失調を認める.歩行器歩行は可能であったが,振戦と運動失調のため発症前と比較すると不安定である.その他,脳出血の後遺症として右三角筋,上腕二頭筋,大腿屈筋群,前脛骨筋における徒手筋力検査 4程度の筋力低下,右上下肢の温痛覚鈍麻,右下肢振動覚,位置覚低下を認めるが,不随意運動出現前と比較して悪化はない.四肢深部腱反射は正常で病的反射は認めない.運動緩慢や筋強剛といったパーキンソニズムは認めない.
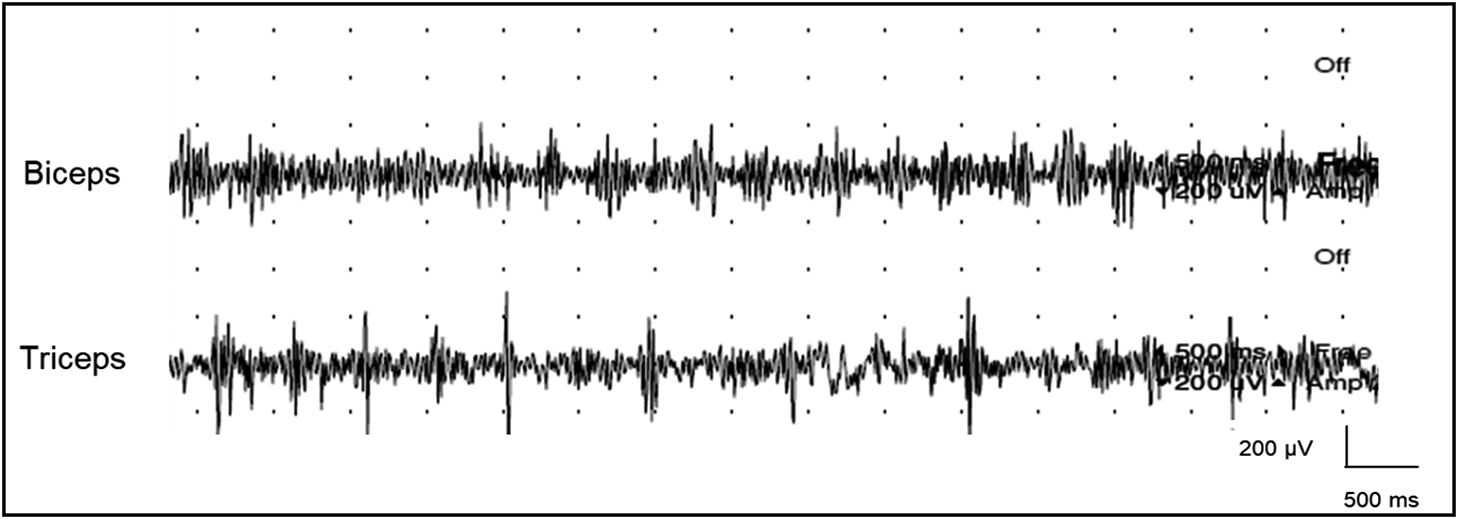
Surface EMG showing rhythmic bursts of 2 Hz.
検査所見:血液検査では血算,肝・腎機能,電解質に異常は認めなかった.抗核抗体 320倍(homogeneous/centromere),抗SS-A抗体 11.2 U/mlと陽性であり,サクソンテスト陽性からシェーグレン症候群と診断した.腺外症状は認めなかった.その他の膠原病,血管炎,傍腫瘍性神経症候群に関連する各種自己抗体は陰性であった.髄液検査では細胞数,蛋白の上昇は認めなかった.頭部MRIでは左橋被蓋に陳旧性出血を認め,左延髄下オリーブ核の肥大を認めた(Fig. 3).また,123I-IMP SPECTでは左大脳皮質,左視床,右小脳半球の血流低下を認めた(Fig. 4).123I-FP-CIT SPECTでは左被殻にごく軽微な集積低下を認めた(Fig. 5).定量的評価では,Specific Binding Ratio(SBR)は両側ともに正常であるものの,Asymmetry Index(AI)15.2%と既報による基準値と比較して軽度高値であり3),左右差が示唆された.
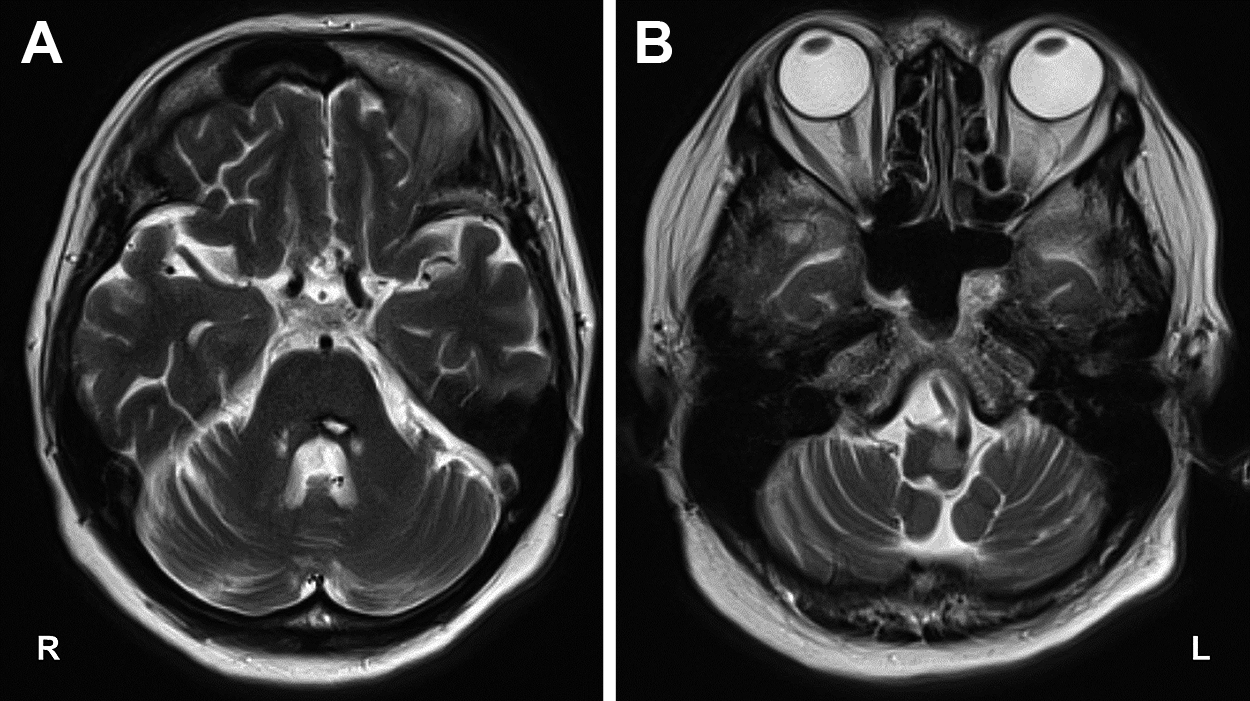
MRI showing obsolete hemorrhage in left pons (A), and hypertrophy of the left inferior olivary nucleus of the medulla oblongata (B).
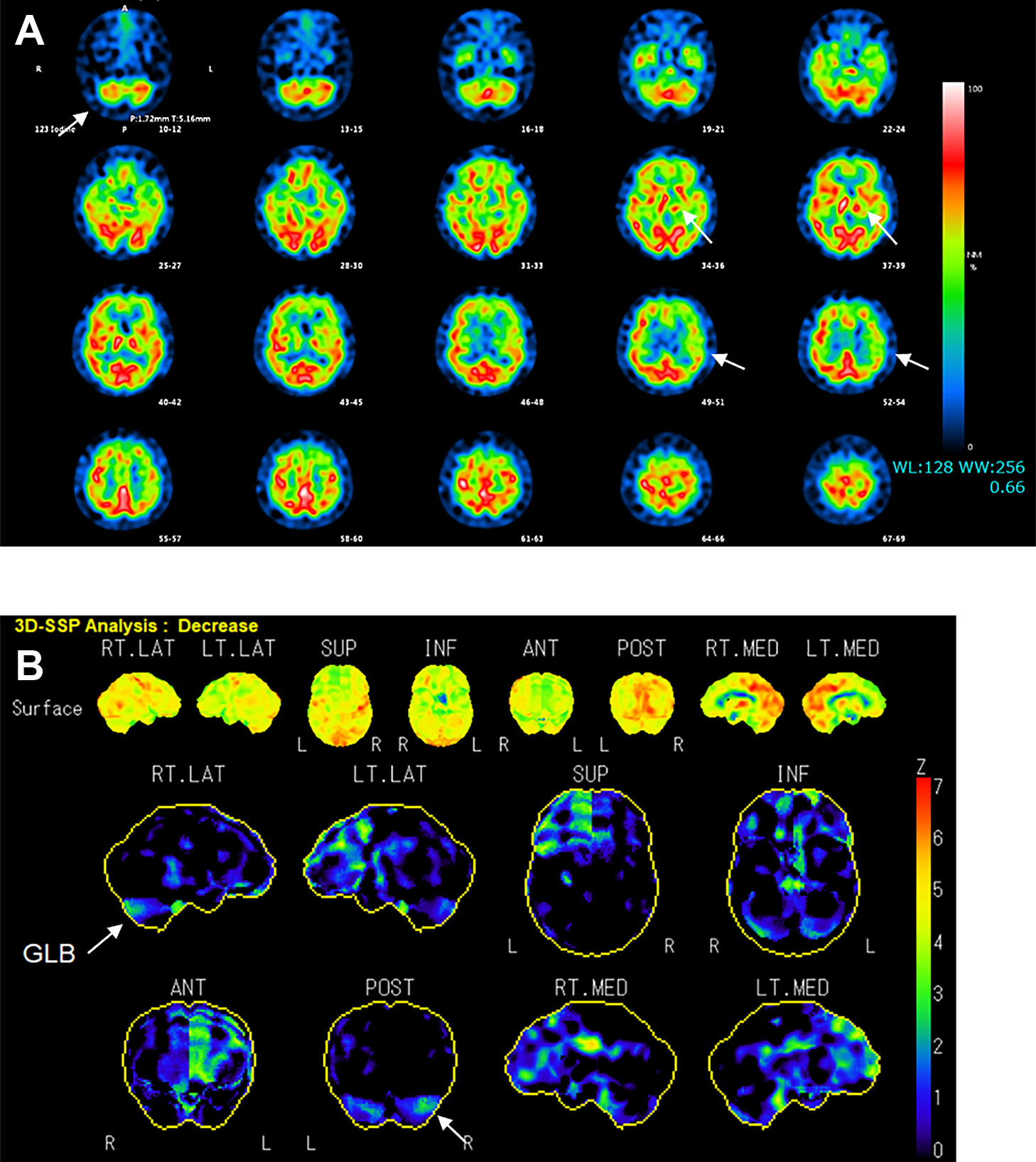
123I-IMP-SPECT and 3D-SSP image showing decreased blood flow to the right cerebellum, left thalamus, and left cerebral hemisphere (arrow).

123I-FP-CIT SPECT showing slightly decreased accumulation in the left putamen.
入院後経過:臨床経過と症状,各種検査所見より,橋出血に続発したHolmes振戦と診断した.診断後,レボドパ・ベンセラシド 100 mg/25 mgを300 mg/75 mg/日で開始したところ,わずかに振戦の振幅低下を認めた.しかし,レボドパ・ベンセラシドを750 mg/187.5 mg/日まで漸増したが振戦は完全には消失せず,歩行障害は明らかな改善を認めなかった.その後,クロナゼパム2 mg/日とレベチラセタム1,000 mg/日を追加したが明らかな改善は認めず,自宅での生活継続が困難であったため2023年2月に療養環境調整目的に近医に転院した.
Holmes振戦は安静時や企図時,姿勢時に出現する律動的で5 Hz未満の粗大な振戦と定義される1).振戦のみで発症することは少なく,片麻痺や小脳性運動失調,感覚鈍麻やジストニアなど様々な症状を併発することが多い2).また,障害を受けてから1か月から2年程度経過してから発症することも特徴の一つとされ,直接的な障害ではなく脳の可塑性による変化が発症に関与すると考えられている2).本症例の右上下肢の不随意運動はHolmes振戦の定義を満たしており,小脳性運動失調もHolmes振戦に随伴する症状と考えた.Holmes振戦は当初赤核や上小脳脚の障害に伴う振戦として報告された4).当初は赤核振戦や中脳振戦と呼ばれていたが,その後小脳や視床の病変で同様の振戦を認めることが報告されるようになった.明確な発症機序はいまだに解明されていないが,小脳視床路や歯状核赤核オリーブ路,黒質線条体路の障害が発症に関与すると考えられている2).一方で,中脳病変で発症する症例と視床病変で発症する症例では随伴症状やレボドパへの反応性が異なるとの報告もあり5),Holmes振戦の発症には複数の病態が存在する可能性が示唆されている.
本症例においては三つの特徴的な画像所見を認めた.第一に123I-IMP SPECT検査で橋病変と同側の大脳皮質と視床,対側の小脳半球において血流の低下を認めた.脳MRIで同領域に異常を認めなかったことから脳幹病変に随伴する機能低下を反映しているものと考えられた.同様の所見は広範な大脳病変,視床,小脳病変を背景として認めることが多く,皮質橋小脳路や小脳視床路の障害によって起こると考えられている6).我々が渉猟する限りHolmes振戦において同様の報告は認めなかったが,小脳視床路の障害で同様の所見を呈することを考えると,今回の症状と関連している可能性があると推察された.
第二にMRIで左延髄下オリーブ核の肥大を認めた.2021年3月には同様の所見は認めず,症状と関連していることが推察された.下オリーブ核の肥大は求心路である歯状核赤核オリーブ路の障害による経シナプス変性を反映しているとされるが,一般的に変性神経細胞はアポトーシスを伴う萎縮性変化を呈することが多く,肥大性変化を呈するのは下オリーブ核に特徴的である7).組織学的には神経細胞胞体の肥大と胞体内の空胞形成,および肥胖性アストロサイトの増生を認める7).肥大は求心路の障害から1か月程度で始まり,6~7か月でピークに達し,その後3~4年かけて萎縮性変化を呈する8).脳幹病変に続発するHolmes振戦において同様の報告は散見され9)~12),Holmes振戦と同様に歯状核赤核オリーブ路の障害で発症する口蓋振戦においても同様の報告がされている7)8)13).一方で,下オリーブ核の肥大を認める症例の全例でHolmes振戦や口蓋振戦を認めるわけではなく,歯状核赤核オリーブ路の障害や下オリーブ核の肥大がどのようにこれらの運動異常症に関与するのか明確には解明されていない.口蓋振戦に関する報告では,下オリーブ核に投射する抑制性線維の障害による過剰興奮や下オリーブ核から投射する遠心路の障害による異常運動のフィードバックの消失が要因ではないかとの考察もあり8),Holmes振戦においても同様の病態が関与している可能性はあると推察する.
第三に123I-FP-CIT SPECTで左被殻にごくわずかな集積低下を認めた.Holmes振戦において123I-FP-CIT SPECTを施行したとの報告は散見されるが,明らかな集積低下を認めた症例,本症例と同様にわずかな集積低下を認めた症例,集積低下を認めなかった症例など様々である(Table 1)14)~19).その中で,明らかな集積低下を認めたすべての症例が中脳病変を原因として発症しており,比較的多くでレボドパやドパミンアゴニストへの反応性を認めたと報告されている14)~17)19).一方で,集積低下を認めなかった症例の多くは視床病変を原因として発症しており,ほぼすべての症例でレボドパやドパミンアゴニストへの反応性が不良であった16)18).以上より,Holmes振戦の発症において必ずしも黒質線条体路の障害が関与するとは限らないこと,黒質線条体路の障害の有無がレボドパやドパミンアゴニストへの反応性の違いに関与していることが示唆された.橋病変で発症した症例において123I-FP-CIT SPECTを施行したとの報告は渉猟する限り認められなかった.一方で,すべての報告においてレボドパへの反応性が不良であったとされており11)20)~22),橋病変に起因するHolmes振戦においては黒質線条体路以外の神経回路の障害が発症により強く関与していると推察した.本症例において軽度の集積低下とレボドパ反応性を認めた要因として,脳出血発症時の病変が中脳赤核周囲まで広がっており(Fig. 1),黒質線条体路の直接的な障害が発症に寄与した可能性もあると考えた.一方で,既報と比較しても集積低下が軽微であったこと,レボドパへの反応性が限定的であったことからは小脳視床路や歯状核赤核オリーブ路の障害が発症により強く関与したと推察した.
| Study | Gender | Age | Structures involved | Cause of brain lesion |
123I-FP-CIT SPECT accumulation |
Efficacy of dopaminomimetic therapy |
|---|---|---|---|---|---|---|
| 14 | male | 29 | midbrain (SCP) | Trauma | decreased | mildly improved |
| 15 | male | 51 | midbrain (RN) | Abscess | decreased (only in putamen) |
improved |
| 16 | female | 71 | thalamus | ischemic stroke | not decreased | not improved |
| 16 | female | 84 | midbrain (SCP) pons | ischemic stroke | slightly decreased | mildly improved |
| 16 | female | 50 | thalamus | ischemic stroke | not decreased | not improved |
| 16 | male | 36 | no visible pathology | trauma | not decreased | not improved |
| 16 | female | 55 | thalamus | ischemic stroke | not decreased | not improved |
| 17 | male | 69 | midbrain (RN) | ischemic stroke | decreased | N/A |
| 18 | female | 29 | temporal and occipital lobe thalamus |
ischemic stroke | not decreased | N/A |
| 19 | female | 24 | midbrain (RN) | astrocytoma | decreased | N/A |
| our case | female | 75 | pons midbrain (RN) | hemorrhage | slightly decreased (only in putamen) |
mildly improved |
SCP: superior cerebellar peduncle, RN: red nucleus, N/A: not available.
本症例における画像所見からはHolmes振戦において複数の神経回路が関与すること,同様の振戦を呈する症例においても複数の病態があることが示唆された.Holmes振戦の治療の第一選択はレボドパ製剤をはじめとした薬物療法であるが明らかな改善が得られない場合も多い.一方で,薬物療法に抵抗性であった症例において機能外科的治療が有用であったとの報告も散見される10)23).これらの治療適応やターゲットを同定するためにもHolmes振戦の発症機序の解明が望まれ,本症例の画像所見がその一助になると考えた.
著者全員に本論文に関連し,開示すべきCOI状態にある企業,組織,団体はいずれも有りません.