要旨:核内受容体は様々な脂質を天然リガンドとする転写因子で,ヒトではレチノイン酸受容体,ビタミンD受容体,性ホルモン受容体,副腎皮質ホルモン受容体,および甲状腺ホルモン受容体など48種類が同定されている。核内受容体の転写活性は,基本的には特異リガンドとの結合によって調節されているが,実際にはリン酸化などの翻訳後修飾も影響する。我々は最近,細胞間接着から核内受容体のセリンリン酸化に至る新規のシグナル伝達経路を発見し,これが幹細胞分化および子宮体癌と乳癌の悪性形質増強に寄与することを明らかにした。本総説ではその一連の研究を紹介する。
Abstract:Nuclear receptors are transcription factors that recognize various lipids as natural ligands. In humans, 48 types of such proteins, including retinoic acid receptors (RARs), vitamin D receptors (VDR), estrogen receptors (ERs), and thyroid hormone receptors (TRs), have been identified. Although the transcriptional activity of nuclear receptors is primarily regulated by binding to specific ligands, post-translational modifications such as phosphorylation also influence it. Recently, we discovered a novel signaling pathway leading from cell-cell adhesion to serine phosphorylation of several nuclear receptors, contributing to both stem cell differentiation and the malignancy of endometrial cancer and breast cancer. This review will introduce the series of studies that led to these discoveries.
個体の発生や恒常性維持には,個々の細胞が外的環境を関知し,状況ごとに適切な対応をとることが必要である。その際には,既に細胞内に存在するタンパク質や細胞内小器官の場所や活性状態を変えるだけで十分なこともあるが,多くの場合は遺伝子の転写と翻訳によって新たにタンパク質を作り出す必要がある。こうした一連の反応は,具体的には,主に細胞膜に存在する受容体などの様々な分子に端を発するシグナル伝達が,最終的に核内に存在する転写因子の状態を変化させることによって達成される。シグナル起点となる外的要因には熱や放射線などの物理学的因子,塩濃度など化学的因子,および病原体への暴露などがある。内的因子にはホルモンやサイトカインなどの液性因子,細胞間接着,および細胞基質間接着などがある。
核内受容体はDNA結合ドメインを有する転写因子で,ヒトでは48種類が知られている(1)。レチノイン酸(RA),ビタミンD,性ホルモン,副腎皮質ホルモン,および甲状腺ホルモンなどの様々な脂質を天然リガンドとし,それらと結合することによって下流標的因子の発現を調節している。個体発生,性成熟,恒常性維持,炎症や感染防御,および組織の再生と修復など,様々な生命現象が核内受容体によって制御されている(2)。さらに核内受容体は腫瘍の発生や進展にも深く関与しており,例えばエストロゲン受容体(ER)やプロゲステロン受容体(PR)は乳癌や婦人科癌の,アンドロゲン受容体(AR)は前立腺癌の進行を促進し,一方でレチノイン酸受容体(RAR)やビタミンD受容体(VDR)は多くのがんに対して抑制的に作用する。実際に性ホルモン受容体に対する様々なアンタゴニストが抗腫瘍薬として応用されている(3, 4)。
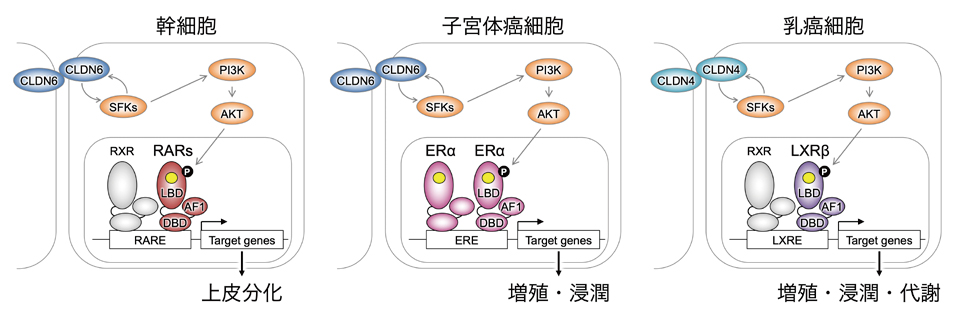
古典的理解によれば,核内受容体は天然特異リガンドとの結合によってその三次元構造が変化し,細胞内分布や共因子との結合状態を変えることで標的遺伝子の転写を正負に制御している(1)(図1左)。しかしながら実際にはそれに加えてリン酸化などの翻訳後修飾も核内受容体の活性状態に大きく影響する(5, 6)(図1右)。核内受容体の翻訳後修飾に関する研究は,核内受容体がクローニングされた直後の1990年代後半までは盛んに行われていた(7-9)ものの,化合物ライブラリを用いた新規リガンドの探索などと比べると,メカニズムの解明や創薬への応用などは相対的に立ち遅れている。我々は細胞間接着から核内受容体のセリンリン酸化に至る新規のシグナル伝達経路を発見し,これが幹細胞分化や,子宮体癌や乳癌の悪性形質増強に寄与することを明らかにした(図2)(10-13)。この総説ではその一連の研究を紹介する。

我々のグループはマウスF9幹細胞を用いて幹細胞の上皮分化について研究してきた。マウスF9幹細胞はマウスの7日胚を雄マウスの精巣に移植して得られた胎児性癌細胞株(14)で,RAなどを処理することによって始原内胚葉上皮などいくつかの限定的な上皮系細胞に分化誘導することができる(15, 16)。胚性幹細胞(embryonic stem cells;ESC)と異なり,F9細胞はフィーダー細胞や特殊な液性因子を必要とせず,通常の培養条件で安定して維持できることから,上皮細胞の分化や維持機構の研究でよく用いられおり,実際にE-カドヘリンなど多数の細胞間接着分子がF9細胞からクローニングされてきた(17)。まず上皮分化過程を厳密に評価するためには,時間的に制御された状態で目的遺伝子を発現させる必要があることから,タモキシフェン添加でCre-loxP遺伝子組換えを誘導するためのCre-ERTと,ドキシサイクリン添加で遺伝子発現を誘導するためのrtTAを恒常発現させたコンディショナルシステムを構築した(18)。この系を用いて,核内受容体の1つであるHNF4α (hepatocyte nuclear factor -4α)がF9幹細胞を上皮分化させることを見いだし(19),上皮分化における細胞間接着装置複合体(20)および微絨毛(21)の成熟過程を詳細に明らかにした。続いてF9幹細胞の上皮分化過程の早期から高発現する細胞間接着分子クローディン-6 (CLDN6)に着目した。クローディンは密着結合の形成に必須の4回膜貫通分子で,哺乳類では20種類以上からなるファミリーを形成している。そのうちCLDN6は発生器の消化管や表皮など胎児性に発現する一方で,成体の正常組織ではほとんど発現しないという際立った特徴を有している。そこでCLDN6が上皮分化における細胞間接着の成熟に貢献するのではないかという仮説を立て,F9幹細胞にCLDN6を過剰発現させた。その結果,強制発現されたCLDN6は未熟なF9幹細胞の細胞間接着領域に分布し,さらにCLDN6の導入によって上皮様の形態変化,他のCLDNなど上皮マーカーの発現亢進,および微絨毛の形成を含む明瞭な上皮分化が認められた。さらにCLDN6による上皮分化誘導はマウスESCの浮遊培養により構築した胚様体でもみられた。ところでウェルシュ菌腸型毒素のC末端ペプチド(CPE)はCLDNの細胞外ドメインと結合し,細胞膜を透過させて細胞を破壊する。一方でCPEのC末端ペプチド(C-CPE)は細胞毒性をきたすことなくCLDN同士の対合のみを阻害する。すなわちC-CPEで細胞を処理すると,CLDNの蛋白質発現量を保ったまま細胞間接着領域からCLDNを取り除くことができる。CLDN6を過剰発現したF9幹細胞やESCはC-CPE存在下では上皮分化が抑制された。これはCLDN6による隣接細胞との細胞間接着に端を発するシグナルが,何らかの転写因子に影響して下流標的遺伝子の転写と翻訳を制御することで,幹細胞の運命決定因子として働くことを示唆する(22)。
CLDN6接着シグナルの下流を同定すべく,CLDN6を過剰発現したF9幹細胞に様々な阻害剤を処理したところ,SFK (Src-family kinase)/PI3K/AKT経路の阻害剤が上皮分化を阻害した。またCLDN6の変異体を用いた免疫沈降と分化誘導実験により,CLDN6がC末端にある2つのチロシン残基依存性にSFKと結合し,互いの活性化を介して上皮分化を誘導することがわかった。
次に,CLDN6による上皮分化で誘導される遺伝子群がRAおよびレチノイン酸受容体(RAR)で誘導されるものと類似していたことから,CLDN6接着シグナルはRARに帰結すると仮説を立てた。RARにはRARα/β/γの3種類およびそれらのスプライシング・バリアントがあるが,このうちF9の上皮分化を制御するのはRARγ2であることがわかっていた(16, 23)。AKTはセリン・スレオニンキナーゼであるから,RARγ2の潜在的AKT標的セリンおよびスレオニンをバイオインフォマティクスにより予測したところ,10箇所が候補として抽出された。そこでこれらのセリン・スレオニンをアラニンに置換したRARγ2の変異体(リン酸化不応体)を作製し,RARγのノックアウト細胞(16)にCLDN6と共にレスキュー導入したところ,第379番セリン(ヒトRARγ2では第390番セリンに相当)の変異体のみ上皮分化を誘導できなかった。また常時リン酸化状態を模倣するグルタミン酸に置換した場合は,CLDN6などの上流シグナルがない状態でも上皮分化誘導された。よってCLDN6接着シグナルはSFK/PI3K/AKT経路を介してRARγ2の第379番セリンのリン酸化に帰結すると結論された(図2左)(10)。
第379番セリンはRARγ2のリガンド結合ポケットと三次元的に近接しており(図3),リン酸化による電荷の変化によってリガンド感受性に影響することが示唆された。RARγ2は当然ながらRAを天然リガンドとするが,核内受容体とそのリガンドは強固な一対一対応ではなく連続性をもった結合性を示し,様々な脂質に種々の程度で結合し活性化する。またF9幹細胞の培地に添加されるウシ胎児血清(FBS)には,RAを含む様々な脂質が生理的な種類と濃度で含まれている。これまでの実験は培地中にRAを添加せずに行ってきたが,核内受容体のリン酸化がリガンド感受性を高めるという報告(24)があることから,本実験系においては第379番セリンのリン酸化を受けたRARγ2が微量な生理的濃度のRAあるいは他の脂質リガンドに反応しているのではないかと考えた。そこでFBSを活性炭で一晩処理して脂質リガンドを完全に除去したところ,CLDN6過剰発現細胞やRARγ2の第379番セリン-グルタミン酸置換体レスキュー細胞は上皮分化を示さなくなった。また通常F9幹細胞の上皮分化誘導には200-1,000 nMのRAが必要であるが,CLDN6接着シグナルがある状態や第379番セリン-グルタミン酸置換体では1 nMのRAで上皮分化誘導が観察された。よってRARγ2の第379番セリン・リン酸化はRAに対する感受性を著しく亢進させることが示された(10)。
第379番セリンを含むAKT依存性リン酸化コンセンサス配列はRARγのみならず,ヒトで48種類ある核内受容体スーパーファミリーのうち14種類で保存されている(図3)。またマウスからゼブラフィッシュに至るまで脊椎動物のRARファミリーのみならず,無脊椎動物のホモログやアナログにも分布していた。よってこのシグナル経路はRARγによる上皮分化だけでなく,他の核内受容体の活性化を介して多様な生命現象を制御する可能性が示唆された。そこで次にヒト乳癌細胞株MCF-7細胞を用いて同経路がエストロゲン受容体(ERα)のセリン・リン酸化を惹起するかどうか検証した。マウスRARγの第379番セリンに相当するヒトERαのアミノ酸は第518番セリンである。RARγの場合と同様にアラニン置換体やグルタミン酸置換体を作製して検証したところ,MCF-7においてもCLDN6シグナルはSFKと共役してAKT依存性にERα第518番セリンをリン酸化し,ER標的遺伝子の転写を活性化することがわかった。よって少なくとも2つの動物種と核内受容体においてCLDN6-核内受容体経路が存在することが確認された(10)。

次に我々はCLDN6–核内受容体経路による細胞制御が他の生命現象においてもみられるか検証しようと試みた。The Cancer Genome Atlasデータベース(https://portal.gdc.cancer.gov)によると,mRNAレベルでのCLDN6高発現が子宮体癌の予後不良因子であることが示唆された。そこでホルマリン固定パラフィン包埋手術標本を免疫組織化学法で染色可能なCLDN6モノクローナル抗体を開発し,子宮体癌手術症例約160例について腫瘍細胞でのCLDN6発現と患者の生命予後や各種臨床病理学的因子との関連性を統計解析したところ,CLDN6高発現群の5年生存率は約30%と,低発現群の約90%と比較して明らかに低く,また多変量解析でもCLDN6高発現の相対危険度は3.5 (95%信頼区間2.42-9.43;p=0.014)と予後不良因子であることが示された(25)。
続いて培養細胞を用いて子宮体癌におけるCLDN6の分子機能を解析した。よく用いられる子宮体癌細胞株5種類についてCLDN6発現を評価したところ,高発現株は1つもなかった。これは子宮体癌手術標本におけるCLDN6高発現例が10%程度であったことと矛盾しない結果である。そこでERα発現陽性のIshikawaについて,CLDN6過剰発現株を樹立し,その悪性形質を親株と比較した。その結果,CLDN6高発現により増殖能と遊走能が亢進し,SFKのリン酸化も促進され,さらにRNAシークエンスではERαコンセンサス標的遺伝子群の発現量も上昇していた。またTALEN法を用いたゲノム編集によりERαノックアウト細胞を樹立して検討したところ,CLDN6過剰発現による悪性形質増強作用はERαノックアウト細胞ではみられなくなった。またERαノックアウト細胞において野生型のERαはレスキュー効果を示したのに対し,第518番セリンのアラニン置換体(リン酸化不応体)は示さなかった。これらの結果はERα発現陰性のHEC-1A細胞株を親株とした機能獲得実験でも再現された。以上より子宮体癌細胞株においてCLDN6シグナルはERαの第518番セリンリン酸化に帰結し,このシグナル経路が子宮体癌では悪性形質増強に作用していることが解明された(図2中央)(11)。
子宮体癌だけでなく乳癌でもERαが腫瘍の進展に関与する。そこでCLDN6-ERαシグナルが乳癌の悪性形質制御に関わるかどうか明らかにしようと試みた。子宮体癌の場合と同様に,乳癌手術検体約200例におけるCLDN6発現を免疫組織化学で評価したところ,CLDN6陽性症例は1症例のみであった。なお乳癌の25%でCLDN6が高発現するという先行研究(26)があるが,我々が検証した結果,一般に使われているウサギ抗CLDN6抗体は,CLDNファミリーの中でCLDN6と近縁なCLDN4と交差反応を示すことが確認され(25),先行研究でCLDN6高発現とされた症例はCLDN4高発現を検出している可能性が考えられた。一方でCLDN4にはSFKの活性化に必要なC末端のチロシン残基が保存されていることもふまえ,CLDN4に着目して研究を進めることにした。乳癌細胞株のうちホルモン受容体陽性のMCF-7とT47DはCLDN4陽性であり,低分化でホルモン受容体とHER2のいずれも陰性のトリプルネガティブ乳癌(TNBC)の形質を有するMDA-MB-231はCLDN4陰性であった。そこで前2者のCLDN4陽性細胞株ではCRISPR法によるCLDN4ノックアウトを,後者では遺伝子導入によるCLDN4過剰発現株をそれぞれ樹立して悪性形質を解析した。その結果CLDN4は細胞増殖,遊走,および浸潤をそれぞれ正に制御することがわかった。続いてこれらの細胞株におけるトランスクリプトームをRNAシークエンスで比較した。その結果ERα下流遺伝子群は変化に乏しく,その一方で別の核内受容体であるLXRのコンセンサス下流標的遺伝子に発現変化が認められたことから,CLDN4-LXR経路に焦点をあてることにした。LXRにはLXRαとLXRβの2つのアイソザイムがあるため,まず乳癌における発現プロファイルを検討した。その結果,手術検体と細胞株のいずれにおいても,LXRβは種々の程度で発現していた一方でLXRαの発現はほとんどみられず,乳癌ではLXRβが優位であることがわかった。そこでLXRβのノックアウト細胞株を樹立し,CLDN4の有無とLXRβの有無で悪性形質を比較したところ,CLDN4とLXRβを共に高発現している場合のみ細胞増殖や遊走能が高かった。またRARγやERαと同様のAKT標的である第432番セリンのアラニン置換体(リン酸化不応体)はノックアウト細胞の悪性形質減弱をレスキューできなかった。さらに乳癌手術材料を組織病理学的に評価したところ,CLDN4とLXRβはそれぞれ単独では予後や臨床病理学的因子と関連性がみられなかったが,TNBCではCLDN4とLXRβが共に強陽性の症例で全生存率と無再発生存率が低下していた。以上の結果から,乳癌ではCLDN4-LXRβ経路が脂質代謝,細胞増殖,浸潤などの悪性形質増強にはたらくことが示された(図2右)(13)。
以上のように,我々は細胞間接着に端を発するシグナル伝達が核内受容体の転写調節に影響し,これが上皮分化やがんの進展に関与することを明らかにした。この事実は核内受容体の翻訳後修飾に関わる分子が潜在的な診断治療標的であることを示唆するものである(図1)。現在我々は,本経路による細胞制御機構の解明を他の疾患に展開すると同時に,CRISPRスクリーニングを用いた順遺伝学的手法によって核内受容体の翻訳後修飾に関わる内因性の遺伝子産物を網羅的に同定すべく研究を進めている。
本研究は福島県立医科大学医学部基礎病理学講座冨川直樹講師(現関西医科大学),柏木惟人助教(現獨協医科大学),小林信助教,産婦人科学講座小島学准教授,乳腺外科学講座村上祐子助教(現北福島医療センター)らと共に,日本学術振興会科研費,上原記念生命科学財団,武田科学振興財団,金原一郎記念医学医療振興財団,小野医学研究財団,および高松宮妃癌研究基金からの研究助成によって実施された。