2018 Volume 67 Issue 4 Pages 575-579
2018 Volume 67 Issue 4 Pages 575-579
患者は糖尿病の家族歴を有する40歳代女性で,前医で糖尿病と診断され,治療のため当院を受診した。紹介状に添付されたラテックス凝集法(LA法)によるヘモグロビンA1c(HbA1c)値は10.0%と高値であったが,当検査科のHLC-723 G8(東ソー)(以下,G8)では5.5%と大きく乖離した。G8の測定原理はイオン交換HPLC法である。そこで東ソーにイオン交換HPLCの精密分析とアフィニティHPLC法によるHbA1c値の測定を依頼した。イオン交換HPLCの精密分析では異常ヘモグロビンを示唆する異常ピークを認め,アフィニティHPLC法でのHbA1c値は8.8%であった。福山臨床検査センターでのβ-グロビン遺伝子シーケンシングでは〔Codon 22 GAA (Glu)→AAA (Lys)〕(heterozygote)HbE-Saskatoonが検出された。今回の経験から,臨床と情報を共有し,測定法の特性を正しく理解して業務にあたる必要があると考える。
HbA1c値は1~2ヶ月前の血糖値を反映し,長期的血糖コントロールの指標として有用である。イオン交換HPLC法でのHbA1c値測定は,技術革新により測定の高速化が進み,各施設で保守・点検が比較的容易な点などから,ルーチン検査で広く普及している。測定原理は,検体を陰性荷電の充填剤中を通過させ,ヘモグロビンのβ-グロビンN末端の電位の違いで溶出時間に差をつけて分離する。得られたクロマトグラムの面積から,HbA1c値を全体に対する百分率で表示する。従って,多くの場合はパラメータやクロマトグラムを的確に読み取ることで,HbFの高値や異常ヘモグロビンの出現など偽低値の原因を発見することができる。ラテックス凝集法(LA法)は,未感作ラテックスに総ヘモグロビンを吸着させ,HbA1cに特異的な抗体を加えてできる凝集の大きさからHbA1c値を求める方法である。しかしながら,今回クロマトグラム等の確認を行っても発見が困難であった異常ヘモグロビンの症例を経験したので報告する。
患者は,40歳代,女性。平成26年2月に糖尿病の診断を受けており,両親とその兄弟に家族歴がある。人工透析は受けていない。翌年11月に糖尿病の治療目的で当院を紹介され来院した。
初診時のデータ(Table 1)を示す。早朝空腹時採血のものである。高血糖があり,明らかな腎障害,貧血はなかった。また,腹部エコーで脂肪肝を認めており,肝胆道系の酵素とCRPが上昇している。当検査科のHLC-723 G8(以下G8)で測定したHbA1c値(Figure 1)は5.5%と基準範囲内であった。パラメータやクロマトグラムにも異常はなかったが,臨床から紹介状のデータと異なっているとの指摘があった。紹介状添付資料ではHbA1c値は10.0%の高値であり,LA法で測定されていた。紹介状とは別の検査センターにLA法での測定を依頼したが,9.0%の高値であった。また,同日に当検査科で測定したグリコアルブミン(GA)は21.3%と高値,1,5-アンヒドログルシトール(1,5-AG)は4.5 μg/mLと低値を示した。
| 生化学検査 | 血液学的検査 | ||||||
|---|---|---|---|---|---|---|---|
| 測定値 | 基準範囲 | 単位 | 測定値 | 基準範囲 | 単位 | ||
| Na | 140 | 138–145 | mEq/L | WBC | 4.6 | 3.3–8.6 | 103/μL |
| K | 4.1 | 3.6–4.8 | mEq/L | RBC | 5.55 | 3.86–4.92 | 106/μL |
| Cl | 99 | 101–108 | mEq/L | Hb | 15.1 | 11.6–14.8 | g/dL |
| TP | 7.9 | 6.6–8.1 | g/dL | Hct | 43.1 | 35.1–44.4 | % |
| Alb | 4.6 | 4.1–5.1 | g/dL | MCV | 78 | 83.6–98.2 | fL |
| BUN | 7.7 | 8–20 | mg/dL | MCH | 27.2 | 27.5–33.2 | pg |
| Cre | 0.66 | 0.46–0.79 | mg/dL | MCHC | 35.0 | 31.7–36 | g/dL |
| UA | 5.4 | 2.6–5.5 | mg/dL | Plt | 183 | 158–348 | 103/μL |
| T-Bil | 1.39 | 0.4–1.5 | mg/dL | 白血球分類 | |||
| D-Bil | 0.44 | 0–0.45 | mg/dL | Neutro | 58.6 | 32–73 | % |
| T-Cho | 201 | 142–248 | mg/dL | Eosino | 15.9 | 0–6 | |
| TG | 108 | 30–117 | mg/dL | Baso | 0.4 | 0–2 | |
| HDL-C | 48 | 48–103 | mg/dL | Mono | 4.6 | 0–8 | |
| LDL-C | 152 | 65–163 | mg/dL | Lympho | 20.5 | 18–59 | |
| CRP | 3.50 | 0–0.14 | mg/dL | ||||
| Glu | 189 | 73–109 | mg/dL | ||||
| HbA1c | 5.5 | 4.6–6.2 | % | ||||
| GA | 21.3 | 11.6–16.4 | % | ||||
| 1,5-AG | 4.5 | 12–29 | μg/mL | ||||
| インスリン | 11.9 | 5–10 | μU/mL | ||||
| AST | 45 | 13–30 | IU/L | ||||
| ALT | 88 | 7–23 | IU/L | ||||
| LD | 169 | 124–222 | IU/L | ||||
| ALP | 352 | 106–322 | IU/L | ||||
| γ-GT | 64 | 9–32 | IU/L | ||||
| Amy | 49 | 44–132 | IU/L | ||||
| p-Amy | 24 | 18–53 | IU/L | ||||
血糖値,GA,1,5-AGから持続的な高血糖が疑われ,HbA1c値も高値が予想されるデータである。貧血や腎機能障害などHbA1c値が低値を示す要因も考えにくい。

HLC-723 G8によるヘモグロビン溶出パターン
左から,基準範囲(5.4%),高値(10.0%),本症例(5.5%)である。ピークは上から,HbA1a,A1b,F,LA1c,SA1c,A0である。本症例と基準範囲の検体の溶出パターンは酷似している。
東ソーでのイオン交換HPLCの精密分析(Figure 2)で,正常では見られない未知ピークを認め,アフィニティクロマトグラフィ法(Figure 3)にてHbA1c値が8.8%と高値を示した。
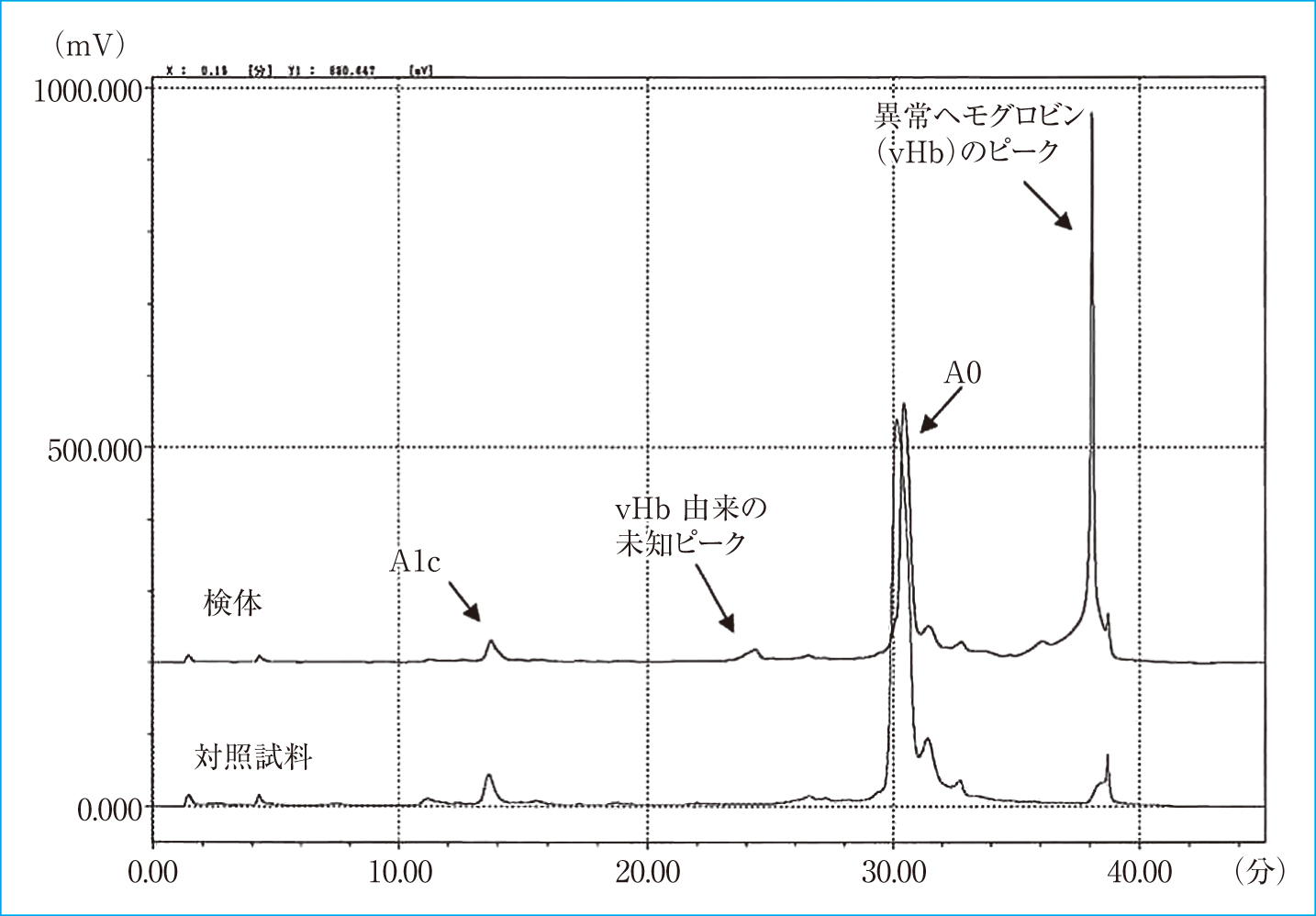
HPLC精密分析の患者試料と対象との比較
患者試料では24.37分と38.08分に対象試料にない未知ピークが溶出された。

アフィニティクロマトグラフィ結果
黒のピークは糖化ヘモグロビンで白のピークは糖化されていないヘモグロビンである。HbA1c値は8.8%。
そこで,異常ヘモグロビンのスクリーニングと遺伝子検査を福山臨床検査センターに依頼した。スクリーニング検査では,HbH inclusion body,イソプロパノールテストが陰性,グリセロール溶血時間,HbF,赤血球膜Band3検査は基準範囲内,HbA2は高値を示した(異常Hb混在の可能性から参考値)。等電点電気泳動(Figure 4)では異常バンドを認めた。

等電点電気泳動結果
患者検体ではHbA2のバンドが太く濃くなったように見える。HbA2のバンドに異常バンドが重なっている。
遺伝子検査では,GAP-PCRによるα-遺伝子領域の広範囲欠失,三重複(anti3.7)の分析は陰性であった。α1-グロビン,α2-グロビン遺伝子のシーケンシングについても異常は認めなかった。β-グロビン遺伝子のシーケンシング(Figure 5)を行ったところ,HbE-Saskatoon〔codon 22 GAA (Glu)→AAA (Lys)〕(heterozygote)が検出された。

β-グロビン遺伝子のシーケンシング結果
Codon22でGAA→AAAの置換が起きている。
来院時のデータから,高血糖,GA高値,1,5-AG低値で糖尿病のデータとして矛盾しない。エコーで認めた脂肪肝とそれに伴う肝胆道系酵素の上昇は,糖尿病に関連した栄養過多によるものと推測でき,家族歴もあることからHbA1c値は高値が予想される。CRP高値については,臨床的に感染症は否定されており,脂肪肝によるものと考えた。
LA法は,β-グロビンの糖付加された部分を認識する抗体を用いる。この抗体の認識部位は,β-グロビンのN末端から2ペプチドなので,今回の変異の影響は受けない。また,LA法と同様にHbA1c値が高値を示したアフィニティクロマトグラフィ法は,充填剤にアミノフェニルボロン酸を用いている。アミノフェニルボロン酸のホウ酸基とグルコースとの親和性によって糖化Hbがカラムを通過する時間は長くなる。そのため,先に糖化されていないHbが溶出され,次に糖化Hbが溶出される。得られたクロマトグラムの面積から,糖化Hbの全Hbに対する百分率を結果とする。分離対象がグルコースであるため,今回の変異の影響は受けない。
以上のことから,LA法,アフィニティクロマトグラフィ法は本症例の正しい糖化ヘモグロビン量を反映している。
本症例は遺伝子検査によってHbE-Saskatoonと同定できたが,ルーチンのイオン交換HPLCにおいて異常ピークは認めなかった。しかし,精密分析では異常ピークを認めた。これは,分析時間1分のルーチンモードは,段階的に溶離液の濃度を上げてHbA1cが溶出されたのち一定時間が経過すると急激に溶離液の濃度を上げ残りはすべてA0として溶出する。このため,ルーチンモードは,HbA1c溶出後の分離は不十分となる。一方,分析時間40分の精密分析は溶離液の濃度が薄く,濃度変化も緩やかであり,HbA1cを溶出した後も分離を継続するため高度な分離が可能である。本症例では,異常ヘモグロビンの溶出時間が38.08分とかなり遅く,それに由来する糖化Hbの溶出も遅い。HbEなどのルーチンモードで異常ピークを検出可能な異常Hb1)に比べ,糖化異常Hbの溶出が遅く,HbA0として溶出されたために検出できず,HbA1c値は偽低値を示したと考えられた。
日本人の異常ヘモグロビンの頻度は3,000人に1人程度2)とされている。その中でもHbE-Saskatoonの報告は2001年段階3)で,栃木2例,埼玉1例,愛知1例で,その後,福山臨床検査センターにて北海道の1例が発見され,さらに本症例が加わって,計6例である4)。今回,2つ以上の異なる測定原理でHbA1c値を測定したことで発見に至ったが,通常の外来受診や健康診断では異なる2法で同時測定するケースはまれである。また,HbE-Saskatoonは異常ヘモグロビン症として無症候性である2)。そのため,このような発見に至るケースは少ないと考えられ,実際の頻度は上がる可能性がある。
今回,我々はHPLC法でHbA1c値の偽低値の発見が困難な異常ヘモグロビンの症例を経験した。このような場合は,検査室だけでの発見は限界がある。臨床との連携を密にして情報を共有すること,イオン交換HPLC法のルーチンモードの測定では,一見,基準範囲内に見えても異常ヘモグロビン症の場合があることも念頭に置くことが必要である。
なお,本編投稿について患者の同意および,当院倫理委員会の承認を受けている。
本論文の要旨は,第25回福岡県医学検査学会で発表を行った。
本編投稿にあたり,北九州総合病院内科木原康之主任部長にご協力いただき,感謝申し上げます。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。