2020 Volume 69 Issue 1 Pages 36-43
2020 Volume 69 Issue 1 Pages 36-43
ミコフェノール酸モフェチル(mycophenolate mofetil; MMF)は臓器移植において主に用いられている免疫抑制薬で,ミコフェノール酸(mycophenolic acid; MPA)のプロドラッグである。MPAのAUC0-12が臨床効果や拒絶反応に相関することから,薬物血中濃度モニタリング(therapeutic drug monitoring; TDM)が推奨されている。血漿中MPA濃度測定には従来LC-MS/MS法やEMIT法などが用いられていたが,前者は操作が煩雑で多大な時間を要すること,後者は代謝産物との交差反応により偽高値を示す可能性があることが知られている。今回,PETINIA法による血漿中MPA測定試薬の基本性能および各種検体条件による影響について検討するとともに,高濃度領域も含めたLC-MS/MS法との相関性について評価した。PETINIA法によるMPA血中濃度測定は,感度や再現性,特異性において良好な性能を示した。血清分離剤による測定値への影響は認められず,保存安定性は試薬添付文書上の期間内で保たれていた。LC-MS/MS法との相関は良好であるが(y = 1.18x − 0.09, r = 0.980, p < 0.01),15 μg/mL以上の高濃度領域ではPETINIA法が高値を示すことが明らかとなった。以上より,PETINIA法による血漿中MPA濃度測定は低濃度領域では臨床的に有用性であるが,高濃度領域においては,解釈に注意が必要であることが示唆された。
Mycophenolate mofetil (MMF), a mycophenolic acid (MPA) prodrug, has been commonly used in immunosuppressive therapy after organ transplantation. Since the pharmacokinetics of MPA has a large interindividual variability, therapeutic drug monitoring (TDM) is needed. MPA concentration has been measured by liquid chromatography tandem mass spectrometry (LC-MS/MS) or the enzyme-multiplied immunoassay technique (EMIT). However, the LC-MS/MS method is complicated and needs many hours; on the other hand, EMIT detects both MPA and its metabolites. In this study, we examined the performance of the particle-enhanced turbidimetric inhibition immunoassay (PETINIA) for the measurement of MPA in terms of its within-run and day-to-day run reproducibilities, linearity, and detection limits, and the effects of interfering substances, serum-separating agents, storage condition, as well as wide-range relationship with LC-MS/MS. PETINIA showed a satisfactory performance in terms of sensitivity, reproducibility, and specificity. In addition, serum-separating agents did not affect the concentration measurements, and the storage stability was equivalent to the data described in the attached document of the reagent. The correlation with the LC-MS/MS method was satisfactory (y = 1.18x − 0.09, r = 0.980, p < 0.01), but plasma samples more than 15 μg/mL MPA showed higher MPA concentrations in PETINIA. In conclusion, the clinical usefulness of PETINIA for the measurement of plasma MPA concentrations was suggested in the lower range; on the other hand, the higher plasma MPA concentrations measured by PETINIA should be carefully interpreted.
ミコフェノール酸(mycophenolic acid; MPA)はプリン生合成におけるde novo系合成経路の律速酵素であるイノシンモノフォスフェート脱水素酵素を阻害する。免疫系以外の細胞の核酸合成はde novo系とsalvage系に依存しているが,リンパ系細胞の核酸合成はde novo系に依存している。したがって,MPAはリンパ球の増殖を選択的に抑制することから,主に臓器移植における免疫抑制剤として用いられている1)。
ミコフェノール酸モフェチル(mycophenolate mofetil; MMF)は経口投与後に消化管からほぼ完全に吸収され,MPAに加水分解される。その後MPAは肝臓に取り込まれ,主に薬理的に非活性であるフェノール性水酸基グルクロン酸抱合体(mycophenolic acid phenol glucuronide; MPAG)と,一部薬理活性を有するアシルグルクロン酸抱合体(mycophenolic acid acyl glucuronide; AcylMPAG)に代謝され腎臓から排泄される2)。また,肝臓で生成したMPAGは胆汁排泄され,腸管で腸内細菌の作用によりMPAに変換された後,腸管から再吸収を受けることが知られており,この腸肝循環がMPAの血中濃度曲線下面積(area under the concentration-time curve; AUC)の10~60%に寄与することが知られている2)。さらに,MPAは蛋白結合率が97~99%と高いため2),血清アルブミン値が低下する病態では,MPAの遊離形分率が増加することにより肝臓での代謝が亢進し,代謝物の生成が増大する可能性がある。このように,MPAの薬物動態は患者個々の腎機能・血清アルブミン値やシクロスポリン等の併用薬の影響を受けることが知られているため,薬物血中濃度モニタリング(therapeutic drug monitoring; TDM)が推奨されており3),またMPAのAUCとトラフ濃度は相関性が乏しいことからAUC0-12のモニタリングが推奨される3)。
MPAの血漿中濃度測定には従来のLC-MS/MS法やenzyme-multiplied immunoassay technique(EMIT法)に加え,新たに2017年9月に体外診断用医薬品としてparticle-enhanced turbidimetric inhibition immunoassay(PETINIA)法による測定試薬が承認された。LC-MS/MS法は操作が煩雑で時間がかかること,EMIT法は代謝産物であるAcylMPAGとの高い交差反応により高値傾向を示すことが問題とされてきた4)。代謝産物の産生率は人種によって異なるが,PETINIA法による日本人の高濃度MPAサンプルの測定を検討した報告はきわめて少ない。本研究では,PETINIA法による血漿中MPA測定試薬の基礎的検討に加え,新たに血清分離剤等の各種検体条件による影響について検討したので報告する。
LSIメディエンス(本社:東京)に血漿中MPA濃度の受託測定依頼のあった62検体のエチレンジアミン四酢酸(ethylene diamine tetraacetic acid; EDTA)血漿の残余を譲受して臨床検体とした。なお,本研究は神戸大学医学部附属病院倫理審査委員会の承認を得て実施した(整理番号:180074)。
また,再現性試験にはMPAコントロール(More Diagnostics, Inc.)を使用し,希釈直線性試験にはDimension MPAT標準液レベル5(シーメンスヘルスケア・ダイアグノスティクス)およびレベル0を用いた。血清分離剤と高速凝固促進剤の影響,血漿と血清サンプルの比較および検体の保存安定性試験にはDimension MPAT標準液レベル5および健常人ボランティアの血液を用いた。
2. 測定方法本研究では,PETINIA法による血漿中MPA濃度は,ディメンションEXL200(シーメンスヘルスケア・ダイアグノスティクス)を測定機器として「フレックスカートリッジ ミコフェノール酸 MPAT」(シーメンスヘルスケア・ダイアグノスティクス)を用いて各機器の取扱説明書ならびに各測定試薬の添付文書に記載された方法で測定を行った。LC-MS/MS法については,API 3200 LC-MS/MSシステム(株式会社エービー・サイエックス)を測定機器としてLSIメディエンスにて血漿中MPA濃度測定を行った。
3. 測定原理PETINIA法は競合反応を用いた免疫比濁法である。粒子に結合したMPAと検体中のMPAは,試薬中の抗体に対して競合的に反応する。その結果,免疫複合体が形成され粒子に結合したMPAがより多いほど溶液の濁度が増加する。この溶液に光を照射すると,免疫複合体粒子により光が散乱され,透過してくる光の強さは弱まる。340 nmの透過光の強さから,検体中の目的物質の濃度を算出する。また,本測定は1回の測定につき2つのキュベットを用いる2キュベット法を用いている。第1キュベットで原液検体,第2キュベットで希釈検体を同時に測定することで,一度の測定で広い測定レンジの結果が得られる。
4. 検討項目 1) 再現性試験MPAコントロール4濃度(2.3, 7.5, 11.9, 22.3 μg/mL)および2濃度のプール血漿を用いて同時再現性および日差再現性を検討した。
2) 希釈直線性試験Dimension MPAT標準液レベル5(33.7 μg/mL)とレベル0(0 μg/mL)を用いて希釈系列を調製し,各濃度(理論値:0,6.7,13.5,20.2,26.9および33.7 μg/mL)を4回ずつ測定することで直線性の確認を行った。
3) 定量限界2.0 μg/mL以下の低濃度の臨床検体13例を用いて各4回測定を行い,回帰式を作成し変動係数(coefficient of variation; CV)が10%以下となる濃度を求め,定量限界とした。
4) 干渉物質の影響の評価プール血漿9容に5段階希釈したグルクロン酸非抱合型ビリルビン(Bil-F),グルクロン酸抱合型ビリルビン(Bil-C),ヘモグロビンおよび乳び(干渉チェックAプラス:シスメックス株式会社)を1容添加し各系列における血漿中MPA濃度を測定した。
5) 血清分離剤および高速凝固促進剤による影響と血漿および血清サンプルの比較健常人ボランティア6名から採取した血液にそれぞれDimension MPAT標準液レベル5を混和し,6濃度(1.06,1.87,2.78,5.48,8.42および12.24 μg/mL)に調製したサンプルを,プレーン採取管(ポリスピッツ),高速凝固採血管(インセパックII 高速凝固促進剤,積水化学株式会社),凝固促進採血管(インセパックII 凝固促進剤,積水化学株式会社),EDTA採血管(インセパックII-D EDTA-2K,積水化学株式会社)に分配し,MPA濃度をそれぞれ測定した。
6) 検体の保存安定性試験血清分離剤と高速凝固促進剤の影響の検討に用いた6濃度のプレーン採取管サンプルを用いて,冷蔵(4℃)3日間および室温1日保存後のMPA濃度を測定し,採取直後とそれぞれの保存条件でのMPA濃度を比較した。
7) 相関性LSIメディエンスにてLC-MS/MS法による血漿中MPA濃度を測定後,凍結保存した残血漿を用いて当院にてPETINIA法による測定を行い,これらの測定値の相関性を評価した。
5. 統計解析データは,平均値 ± 標準偏差で示した。相関性についてはSpearmanの相関係数により評価した。
コントロール4濃度および2濃度のプール血漿を用いた同時再現性および日差再現性のCVはそれぞれ,1.78~3.25%,2.14~3.92%であった(Table 1)。
| Within–run variation (n = 10) | ||||||
|---|---|---|---|---|---|---|
| Control reagent | Pooled plasma | |||||
| 1 | 2 | 3 | 4 | L | H | |
| Mean (μg/mL) | 2.17 | 7.24 | 11.67 | 22.75 | 5.04 | 10.07 |
| SD (μg/mL) | 0.07 | 0.14 | 0.25 | 0.48 | 0.11 | 0.18 |
| CV (%) | 3.25 | 1.88 | 2.13 | 2.09 | 2.24 | 1.78 |
| Within–day precision (n = 10) | ||||||
|---|---|---|---|---|---|---|
| Control reagent | Pooled plasma | |||||
| 1 | 2 | 3 | 4 | L | H | |
| Mean (μg/mL) | 2.19 | 7.34 | 11.40 | 22.00 | 4.97 | 10.10 |
| SD (μg/mL) | 0.08 | 0.20 | 0.24 | 0.54 | 0.18 | 0.40 |
| CV (%) | 3.76 | 2.71 | 2.14 | 2.46 | 3.66 | 3.92 |
標準液の希釈系列のMPA濃度は,33.7 μg/mLまで原点に収束する直線性が認められた(Figure 1)。

Horizontal lines represent mean, error bars represent one standard deviation.
回帰式から求めたCV 10%となる定量限界の濃度は0.16 μg/mLであった(Figure 2)。

Limit of quantitation (LOQ) was defined as the concentration at which the mean CV was 10%.
干渉物質の血漿中MPA濃度に及ぼす影響は,遊離型ビリルビンでは19.1 mg/dL,抱合型ビリルビンでは20.7 mg/dL,ヘモグロビンでは490 mg/dL,乳びでは1,650 FTUまで認められなかった(Figure 3)。

全6濃度のサンプルについて,血清分離剤および高速凝固促進剤含有採血管におけるプレーン採取管と比較したMPA濃度比は93.2~108.0%であり,±10%の範囲内となった(Table 2)。また,EDTA採血管による血漿とプレーン採取管による血清の濃度差は95.0~112.8%であり,サンプルBのみ10%以上の濃度差がみられた。各サンプルの4種の採血管における濃度のCV値は,1.1~4.3%であった。
| Plain | High-speed coagulation | Procoagulant agent containing | EDTA-2K | Mean (μg/mL) | SD (μg/mL) | CV (%) | ||
|---|---|---|---|---|---|---|---|---|
| Sample A | MPA (μg/mL) | 1.06 | 0.99 | 1.01 | 1.02 | 1.02 | 0.03 | 2.5 |
| Ratio (%) | 100.0 | 93.4 | 95.3 | 96.2 | ||||
| Sample B | MPA (μg/mL) | 1.87 | 2.01 | 2.02 | 2.11 | 2.00 | 0.09 | 4.3 |
| Ratio (%) | 100.0 | 107.5 | 108.0 | 112.8 | ||||
| Sample C | MPA (μg/mL) | 2.78 | 2.61 | 2.59 | 2.64 | 2.66 | 0.07 | 2.8 |
| Ratio (%) | 100.0 | 93.9 | 93.2 | 95.0 | ||||
| Sample D | MPA (μg/mL) | 5.48 | 5.67 | 5.22 | 5.32 | 5.42 | 0.17 | 3.1 |
| Ratio (%) | 100.0 | 103.5 | 95.3 | 97.1 | ||||
| Sample E | MPA (μg/mL) | 8.42 | 8.39 | 8.49 | 8.24 | 8.39 | 0.09 | 1.1 |
| Ratio (%) | 100.0 | 99.6 | 100.8 | 97.9 | ||||
| Sample F | MPA (μg/mL) | 12.24 | 12.0 | 11.95 | 11.8 | 12.00 | 0.16 | 1.3 |
| Ratio (%) | 100.0 | 98.0 | 97.6 | 96.4 | ||||
3日間の冷蔵保存による保存安定性は,採取直後と比較した残存率は93.4~113.4%でサンプルBの3日目のみ10%以上の差がみられた(Table 3)。室温保存1日での残存率は93.1~105.7%であり,±10%以内であった。各サンプルのそれぞれの保存条件における濃度のCVは1.3~4.7%であった。
| 0 day | Refrigerated | Room temperature 1 day | Mean (μg/mL) | SD (μg/mL) | CV (%) | ||||
|---|---|---|---|---|---|---|---|---|---|
| 1 day | 2 days | 3 days | |||||||
| Sample A | MPA (μg/mL) | 1.06 | 1.07 | 0.99 | 1.13 | 1.12 | 1.07 | 0.05 | 4.7 |
| Ratio (%) | 100.0 | 100.9 | 93.4 | 106.6 | 105.7 | ||||
| Sample B | MPA (μg/mL) | 1.87 | 1.98 | 2.03 | 2.12 | 1.9 | 1.98 | 0.09 | 4.6 |
| Ratio (%) | 100.0 | 105.9 | 108.6 | 113.4 | 101.6 | ||||
| Sample C | MPA (μg/mL) | 2.78 | 2.89 | 2.94 | 3.01 | 2.93 | 2.91 | 0.08 | 2.6 |
| Ratio (%) | 100.0 | 104.0 | 105.8 | 108.3 | 105.4 | ||||
| Sample D | MPA (μg/mL) | 5.48 | 5.33 | 5.16 | 5.37 | 5.1 | 5.29 | 0.14 | 2.6 |
| Ratio (%) | 100.0 | 97.3 | 94.2 | 98.0 | 93.1 | ||||
| Sample E | MPA (μg/mL) | 8.42 | 8.78 | 8.46 | 8.74 | 8.58 | 8.60 | 0.14 | 1.7 |
| Ratio (%) | 100.0 | 104.3 | 100.5 | 103.8 | 101.9 | ||||
| Sample F | MPA (μg/mL) | 12.24 | 12.35 | 12.27 | 12.68 | 12.34 | 12.38 | 0.16 | 1.3 |
| Ratio (%) | 100.0 | 100.9 | 100.2 | 103.6 | 100.8 | ||||
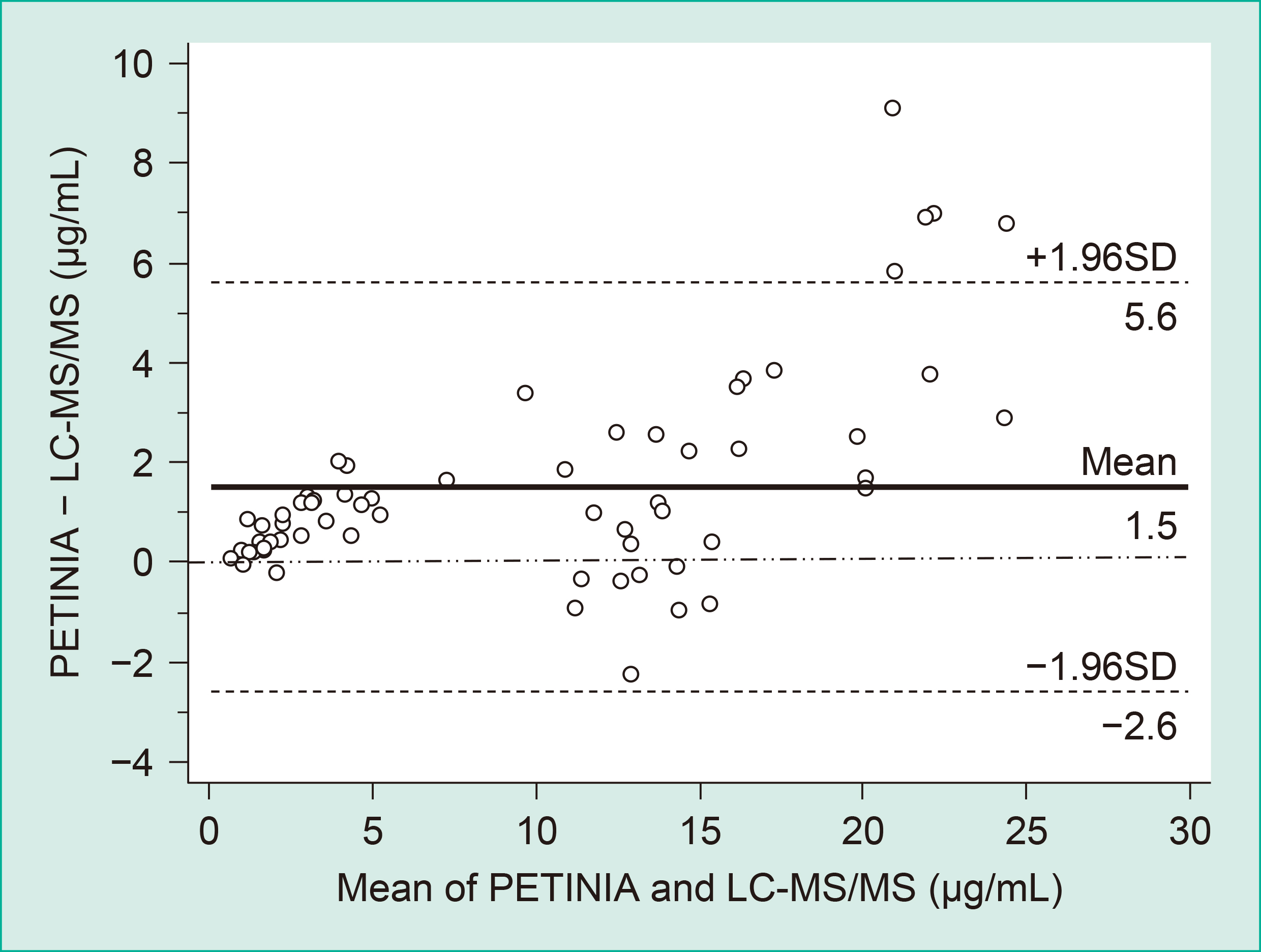
標準主軸回帰式はy = 1.18x − 0.09,相関係数はr = 0.980であり,有意な相関を示した(p < 0.01)(Figure 4)。また,Bland-Altman plotからPETINIA法による血漿中MPA測定値がLC-MS/MS法より平均1.5 μg/mL高い値を示し,低濃度領域においては2法の濃度差が濃度平均値 ±1.96SDの範囲に収まるが,20 μg/mL以上の高濃度領域においては平均値+1.96SDを超えるサンプルが存在した(Figure 5)。

MPAの血漿中濃度はMMF投与後0.6~1時間で第1のピークが現れ,次いで腸肝循環によるMPAGからMPAへの変換により第2のピークが形成される2)。MPAの血漿中トラフ濃度は腸肝循環の程度によって変動するため,トラフ値とAUC0-12との相関性は良好ではなく,AUC0-12による評価が推奨されている3)。また,腎移植領域では,MPAのAUC0-12は30 μg·h/mL以下を推移すると拒絶反応のリスクが上昇し,60 μg·h/mL以上で骨髄抑制や感染症のリスクが上昇することから,MPAのTDMは投与後AUC0-12を30~60 μg·h/mLの範囲内に納めることが望ましいとされている5),6)。従って,目標範囲のAUC0-12から取りうる血漿中MPAのピーク濃度としては,20 μg/mLまでの濃度域を精度よく測定する必要があると考える。
PETINIA法の同時再現性および日差再現性は良好であり,希釈直線性および定量限界の結果から,測定範囲0.2~30.0 μg/mLは精度の高い検出が可能であった。この測定範囲はEMIT法0.2~15.0 μg/mLを上回るものであり,高濃度検体の測定精度がEMIT法よりも高いことが期待される。
血清分離剤に関する検討では,採血管の種類による明らかな影響はみられなかった。血漿と血清の濃度比較および保存安定性の検討では,サンプルBのみ本試薬添付文書で示されている正確性の範囲以上の変動がみられたが,サンプルBはポリスピッツにおける濃度が1.87 μg/mLと低値であった。今回得られた日差再現性の結果のうち平均濃度2.19 μg/mLであったコントロールレベル1はCV = 3.76%,SD = 0.08で測定結果値は2.04~2.33 μg/mLと変動していることを考慮すれば,サンプルBの測定値については再現性の範囲内の変動で,許容範囲内と考えられる。そのため,血漿と血清において明らかなMPA濃度の差は認められず,また,保存安定性は試薬添付文書記載の期間保たれていたと考えられる。
LC-MS/MS法との相関性は良好であり,PETINIA法はLC-MS/MS法に比較して高値傾向であった。PETINIA法はEMIT法と同様に抗体を用いる測定方法であるため,代謝産物AcylMPAGとの交差反応によりLC-MS/MS法や高速液体クロマトグラフィー(high performance liquid chromatography; HPLC)法と比較して高値となることが示唆された。AcylMPAGは薬理活性をもつことから,MPAのみを検出するLC-MS/MS法やHPLC法に比較して,生体内での免疫抑制作用をより正確に反映しているとShipkovaら4)は結論付けている。しかし,薬理活性の程度はMPAとAcylMPAGで異なることから,高濃度領域におけるPETINIA法によるMPA測定値を評価する際は,AcylMPAG を含む濃度である可能性を考慮する必要がある。また,MPA血漿中濃度と臨床転帰の関連性を評価する際は,施設で用いている測定方法と既報または他施設の測定方法の違いを考慮して評価する必要がある。
これまでに報告されているPETINIA法とLC-MS/MS法やHPLC法との比較検討では,相関直線の回帰係数が1.10~1.27である7)~11)。しかし,これらの報告で測定された検体は,内服から採血までの時間が統一されていない。MPAに対するAcylMPAGの割合をMMFの投与後継時的にHPLC法にて解析すると,投与後2時間まではAcylMPAGは比較的低値で,投与後4~6時間にピークとなることが報告されている4)。欧米人においてトラフ値におけるMPA 濃度をPETINIA法とHPLC法で比較した報告における相関直線の回帰係数は1.10でPETINIA法が高値傾向であり11),日本人においてトラフ値,投与後0.5および2時間後の採血サンプルを用いた検討では,全サンプルの相関直線の回帰係数が1.104と近似した値でPETINIA法が高値傾向であった12)。投与後の採血時間によりAcylMPAGとMPAとの割合が変化するため,AcylMPAGと交差反応を示すPETINIA法では,LC-MS/MS法やHPLC法との回帰式の係数がMMF投与後の採血時間に依存する可能性があることが考えられる。今回用いたサンプルは,採取時間および患者背景は不明であるが,本研究において認められた中間濃度域および高濃度域での2法の測定値の乖離は,MPA投与後の採血時間が関与する可能性がある。PETINIA法は競合反応を用いた免疫比濁法であり,検体中のMPAと試薬中のMPA結合粒子が競合し,凝集率が低下するため,検体中のMPA量と凝集率は負の相関を示す。MPAの検量線は反比例型のやや曲線状のグラフとなっており,6~7 μg/mL以上では濃度変化による吸光度変化量が小さく,そのため中濃度域以上では相関直線からの乖離やばらつきがみられることも考えられるが,投与後時間を考慮した詳細な検討が必要である。
EMIT法では肝及び腎移植患者においてHPLC法よりも若干高値となる報告がある13)。肝臓移植患者では血清アルブミンが低値である場合が多く,遊離形のMPAが増加し代謝が亢進したためAcylMPAGの生成が増加,また腎臓移植患者では腎排泄量が低下しているため,MPAGが蓄積しMPAの蛋白結合と競合した結果,遊離形のMPAが増加することで代謝が亢進し,AcylMPAGの生成が増加した可能性が考えられている。PETINIA法においてもAcylMPAGとの交差反応が起こることから,EMIT法と同様に肝機能及び腎機能低下患者における血漿中MPA濃度の評価には注意が必要である。
シクロスポリンの併用時には,MPAの腸肝循環が抑制されることが知られており,シクロスポリンがMPAGの肝臓への再取り込みに関わる有機アニオントランスポーターを強力に阻害することに起因する14)。中野ら9)はシクロスポリン併用群におけるPETINIA法/HPLC法のMPA測定値比は,タクロリムス併用群と比較して有意に高値であったことを報告している。MPAGの蓄積により遊離形MPAが増加したことでAcylMPAGの生成が亢進したことが考えられるが,シクロスポリン併用によってMPAG/MPA比だけでなくAcylMPAG /MPA比も上昇することが報告されており15),シクロスポリン併用患者におけるPETINIA法によるMPA濃度の測定値の解釈にはより注意が必要である。
本研究の限界として,自施設の患者検体が対象ではないため患者背景が不明であることである。そのため,患者の肝機能,腎機能,併用薬や採血時間がMPA濃度に影響を及ぼしている可能性を正確に評価することができない。個々の患者の状態および採血時間などのPETINIA法によるMPA測定値に影響を及ぼす因子について,質量分析などによるAcylMPAGの実測を行い併せて検討していくことが今後の課題である。
PETINIA法によるMPA測定は迅速かつ簡便であり,臨床的に有用な感度・精度を有していることが示された。PETINIA法はAcylMPAGと交差反応することに起因して基準測定法と測定値に差が生じること,また,AcylMPAGの生成が腎機能・肝機能などの患者の状態,及び併用薬物などにも影響を受けることなどを考慮した上で,測定結果についての適切な解釈が必要であり,測定法の特性を十分に理解しておくことが重要である。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。