2020 Volume 69 Issue 4 Pages 615-622
2020 Volume 69 Issue 4 Pages 615-622
可溶性インターロイキン2受容体(soluble interleukin 2 receptor; sIL-2R)は悪性リンパ腫の診断補助や治療効果の判定に有用とされている。本研究では,化学発光酵素免疫測定法(chemiluminescent enzyme immunoassay; CLEIA)を測定原理とした試薬(ルミパルスプレストIL-2R,富士レビオ株式会社)とラテックス免疫比濁法を測定原理とした試薬(ナノピアIL-2R,積水メディカル株式会社)の基礎的性能評価およびCLEIAを測定原理とした従来法である外部委託検査法(デタミナーCL IL-2R,日立化成ダイアグノスティックス・システムズ株式会社)との比較を行い,院内導入における妥当性について評価した。両試薬の基礎的性能は良好であり,日常検査法として十分な性能を有していた。しかし,ナノピアIL-2Rでは非特異反応を示す検体が存在するため,ラテックス免疫比濁法を使用する場合は非特異反応の発生を考慮した上で,回避方法を施して注意深く使用することが望まれる。sIL-2R測定試薬を日常検査法として導入することにより当日の結果報告が可能となることで,即座に治療法を選択することが可能となり臨床への貢献が期待される。
The serum-soluble interleukin-2 receptor has been used as a diagnostic aid for malignant lymphoma and as an indicator of treatment follow-up. In this study, we compared the performance of reagents by chemiluminescent enzyme immunoassay (CLEIA; Lumipulse Presto IL-2R, manufactured by Fujirebio Co., Ltd.) and latex turbidimetric immunoassay (Nanopia IL-2R, manufactured by Sekisui Medical Co., Ltd.). Furthermore, we compared the correlation of CLEIA using these reagents with the outsourced assay (Determiner CL IL-2R, Hitachi Chemical Diagnostics Systems Co., Ltd.) and evaluated the suitability of these reagents in in-hospital measurement. The performance of both reagents was satisfactory and sufficient for daily measurements. However, since Nanopia IL-2R showed nonspecific reactions in some samples, it is desirable to use it considering the occurrence of nonspecific reactions. It is possible to immediately select the appropriate treatment method and expect a clinical diagnostic contribution by reporting the results on the same day.
可溶性インターロイキン2受容体(soluble interleukin 2 receptor; sIL-2R)は活性化したリンパ球の細胞膜に発現するIL-2Rのα鎖の一部が末梢血液中に遊離したものである。sIL-2Rは,非ホジキンリンパ腫および成人T細胞性白血病/リンパ腫において高値を示すことから,悪性リンパ腫の診断補助や治療効果の判定,再発の早期診断における指標として有用とされている1)~6)。また,同種造血幹細胞移植後の急性移植片対宿主病(graft versus host disease; GVHD)やサルコイドーシス,血球貪食症候群/血球貪食リンパ組織球症など,悪性リンパ腫以外の疾患においても血中sIL-2R測定の臨床的有用性が報告されている7)~9)。
血中sIL-2Rの測定には,化学発光酵素免疫測定法(chemiluminescent enzyme immunoassay; CLEIA)を測定原理とした方法が広く普及しているが,専用の測定機器が必要となるため,当院では外部委託していた。2017年に積水メディカル株式会社よりラテックス免疫比濁法を測定原理とする試薬が開発され,汎用生化学自動分析装置での測定が可能となったことで,院内に導入する施設も増えてきている。しかし,非特異反応の報告10)があることから当院ではラテックス免疫比濁法を原理とした試薬による院内での測定を見送っていた。そして今回,富士レビオ株式会社より,CLEIAを測定原理とした「ルミパルスプレストIL-2R」試薬が開発され,院内に導入するために両試薬の検討をすることにした。
本研究では,CLEIAを測定原理とした試薬(ルミパルスプレストIL-2R,富士レビオ株式会社)とラテックス免疫比濁法を測定原理とした試薬(ナノピアIL-2R,積水メディカル株式会社)の基礎的性能評価および従来法であるCLEIAを測定原理とした外部委託検査法(デタミナーCL IL-2R,日立化成ダイアグノスティックス・システムズ株式会社)との比較を行い,院内導入における妥当性について評価したので報告する。
2018年9~11月の期間に診療目的でsIL-2R測定を実施した492例の検査後残血清を用いた。
尚,本研究は当院の臨床研究倫理委員会で審査の上,承認済みである(SGHIRB#2018072)。
2. 試薬および測定機器 1) ルミパルスプレストIL-2R(富士レビオ株式会社)測定原理:CLEIA
測定機器:免疫発光測定装置ルミパルスPresto II
2) ナノピアIL-2R(積水メディカル株式会社)測定原理:ラテックス免疫比濁法
測定機器:日立自動分析装置LABOSPECT008
3) デタミナーCL IL-2R(日立化成ダイアグノスティックス・システムズ株式会社):対照試薬測定原理:CLEIA
測定機器:全自動化学発光免疫測定装置CL-JACK NX
3. 検討方法 1) 併行精度各メーカー指定の精度管理試料2濃度を使用し,10回連続測定を行い,mean,SD,CVを算出した。
2) 室内再現精度各メーカー指定の精度管理試料2濃度を使用し,1日1回10日間測定を行い,mean,SD,CVを算出した。
3) 検出限界と定量限界検出限界はブランク試料を使用し,1日10回5日間測定を行い,ブランク上限(ブランク平均 + 1.645 SD)を算出した。6種類の低濃度試料を使用し,1日2回5日間測定を行い,合成標準偏差を求め検出限界(ブランク上限 + 1.645 × 合成標準偏差)を算出した。ブランク試料としては,ルミパルスプレストIL-2Rではキャリブレータの0濃度を使用し,ナノピアIL-2Rでは生理食塩水を使用した。
定量限界は10種類の低濃度試料を使用し,1日2回5日間測定を行い,各試料のCVを求めた。近似曲線より許容誤差限界CV 10%時の濃度を求めて,その値を定量限界とした。
4) 希釈直線性高濃度検体を使用して10段階希釈系列を作製し,3重測定を実施した。理論値に対する偏差率5%以内を基準に直線性の限界を算出した。希釈液はルミパルスプレストIL-2Rではルミパルス検体希釈液,ナノピアIL-2Rでは生理食塩水を使用した。
5) 共存物質の影響干渉チェック・Aプラスおよび干渉チェック・RFプラス(シスメックス株式会社)を使用し,遊離型ビリルビン,抱合型ビリルビン,ヘモグロビン,乳び,リウマトイド因子の影響を確認した。干渉チェック・Aプラスはプール血清と添加物またはブランクを9:1の割合で混合し,干渉チェック・RFプラスはプール血清で溶解後,5段階希釈系列を作製して,3重測定した。共存物質添加前の濃度に比べ,10%以上の変動を認めた場合を影響があると判定した。
6) 従来法(デタミナーCL IL-2R)との相関性評価外部委託検査で測定した492例の患者検体を用いて,ルミパルスプレストIL-2RとナノピアIL-2Rで測定した。全検体での相関に加え,従来法でのsIL-2R測定値が1,000.0 U/mL未満(n = 388)の群においても同様に解析した。基準範囲内から基準範囲外となった検体かつ従来法との差を50%以上認めた検体を乖離検体と仮定し,乖離検体の有無を確認した。
7) 乖離検体の解析 ① 希釈試験ナノピアIL-2Rで乖離を認めた検体を生理食塩水で2倍,4倍,8倍希釈しsIL-2R濃度を算出した。
② 免疫グロブリン(IgG・IgA・IgM)濃度の測定及び免疫固定法によるM蛋白の同定乖離検体の免疫グロブリン濃度を測定し,特異抗血清を用いた免疫固定法によりM蛋白の有無を確認した。
③ 抗sIL-2Rポリクローナル抗体を用いた抑制試験ヤギ抗sIL-2Rポリクローナル抗体と検体を容量比1:9で混和して被検試料を作製し,抗体の代わりにPBSを用いて作製した対照試料に対するsIL-2R測定値低下率(抗sIL-2Rポリクローナル抗体による抑制率)を算出した。また,ルミパルスプレストIL-2R,ナノピアIL-2Rの測定値が近似した濃度の検体を対照として同様に抑制率を算出した。
併行精度はルミパルスプレストIL-2RでCV 1.4~1.7%,ナノピアIL-2RでCV 0.9~2.3%であった(Table 1)。
| Lumipulse Presto IL-2R | Nanopia IL-2R | |||
|---|---|---|---|---|
| Low | High | Low | High | |
| mean (U/mL) | 361.7 | 4,361.2 | 456.6 | 1,963.2 |
| SD (U/mL) | 5.0 | 72.0 | 10.5 | 18.6 |
| CV (%) | 1.4 | 1.7 | 2.3 | 0.9 |
室内再現精度はルミパルスプレストIL-2RでCV 1.6~1.8%,ナノピアIL-2RでCV 1.6~2.0%であった(Table 2)。
| Lumipulse Presto IL-2R | Nanopia IL-2R | |||
|---|---|---|---|---|
| Low | High | Low | High | |
| mean (U/mL) | 358.9 | 4,464.2 | 467.6 | 1,980.0 |
| SD (U/mL) | 5.8 | 80.4 | 9.5 | 31.3 |
| CV (%) | 1.6 | 1.8 | 2.0 | 1.6 |
ルミパルスプレストIL-2Rのブランク上限は0.3 U/mL,検出限界は0.7 U/mLであり,定量限界は2.2 U/mLであった。ナノピアIL-2Rのブランク上限は37.9 U/mL,検出限界は56.0 U/mLであり,定量限界は110.0 U/mLであった(Table 3, Figure 1)。
| Lumipulse Presto IL-2R (U/mL) |
Nanopia IL-2R (U/mL) |
|
|---|---|---|
| LoB | 0.3 | 37.9 |
| LoD | 0.7 | 56.0 |
| LoQ (CV 10%) | 2.2 | 110.0 |
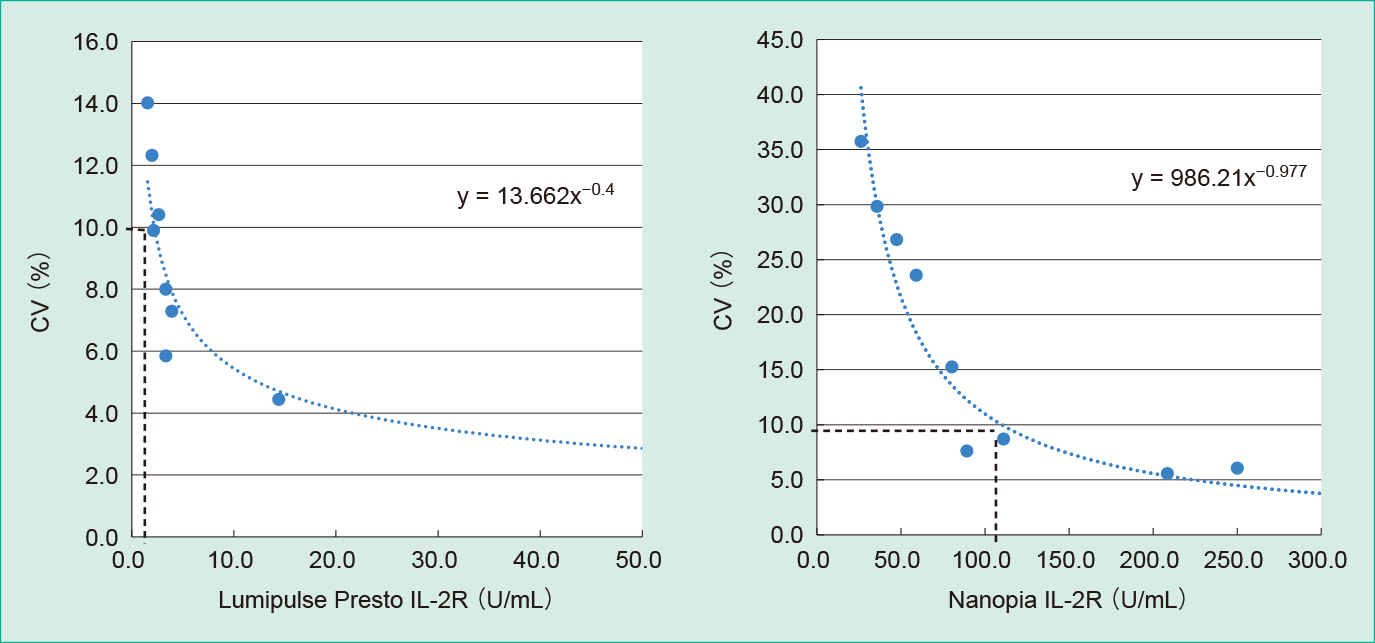
The limits of quantification of Lumipulse Presto IL-2R and Nanopia IL-2R were 2.2 U/mL and 110.0 U/mL, respectively.
ルミパルスプレストIL-2Rで146,782.8 U/mL,ナノピアIL-2Rで9,747.0 U/mLまで直線性が確認された(Figure 2)。

The upper limit of the measured value was 146,782.8 U/mL for Lumipulse Presto IL-2R and 9,747.0 U/mL for Nanopia IL-2R.
ルミパルスプレストIL-2R,ナノピアIL-2Rの両試薬において遊離型ビリルビン19.0 mg/dL,抱合型ビリルビン20.8 mg/dL,ヘモグロビン460.0 mg/dL,乳び2,290.0 FTU,リウマトイド因子500.0 IU/mLまで測定値に影響を認めなかった(Figure 3)。

There was no effect on the measured values of the free bilirubin up to 19.0 mg/dL, conjugated bilirubin 20.8 mg/dL, hemoglobin 460.0 mg/dL, chyle 2,290.0 FTU, and rheumatoid factor 500.0 IU/mL.
従来法とルミパルスプレストIL-2Rの全検体(n = 492)での相関はy = 0.931x + 83.49,r = 0.990,1,000.0 U/mL未満(n = 388)の相関は,y = 0.996x + 50.85,r = 0.967であった。ルミパルスプレストIL-2Rでは従来法と乖離する検体は認められなかった。
従来法とナノピアIL-2Rの全検体(n = 492)での相関はy = 1.024x + 8.159,r = 0.983,1,000.0 U/mL未満(n = 388)の相関は,y = 0.774x + 127.11,r = 0.905であった。ナノピアIL-2Rでは従来法と乖離する検体を4例認めた(Figure 4)。

In the case of Nanopia IL-2R, four samples showed falsely higher values than outsourced measurements.
red circles: samples of discrepancy
乖離検体を生理食塩水で2倍,4倍,8倍希釈しsIL-2R濃度を算出した(Table 4)。希釈倍率が上がると,sIL-2R濃度が低下する傾向を認め,8倍希釈の測定値と原液との差はsample 1が −63.6%,sample 2が −22.0%,sample 3が −60.4%,sample 4が −22.9%であった。
| Nanopia IL-2R (U/mL) | Lumipulse Presto IL-2R (U/mL) |
Detaminer CL IL-2R (U/mL) |
||||
|---|---|---|---|---|---|---|
| Dilution rate | ×1 | ×2 | ×4 | ×8 | ||
| sample 1 | 1,383.0 | 1,996.0 (+44.3%) | 1,264.0 (−8.6%) | 504.0 (−63.6%) | 361.4 | 406.0 |
| sample 2 | 821.0 | 802.0 (−2.3%) | 708.0 (−13.8%) | 640.0 (−22.0%) | 315.5 | 404.0 |
| sample 3 | 1,050.0 | 466.0 (−55.6%) | 412.0 (−60.8%) | 416.0 (−60.4%) | 338.4 | 388.0 |
| sample 4 | 695.0 | 572.0 (−17.7%) | 448.0 (−35.5%) | 536.0 (−22.9%) | 371.4 | 372.0 |
Sample 1では,IgA濃度が466.0 mg/dLと高値であり,sample 3,4ではIgM濃度が244.0 mg/dL,212 mg/dLと高値であった(Table 5)。Sample 1では,IgA-κ型のM蛋白が検出されたが(Figure 5),sample 2~4ではM蛋白は検出されなかった。
| IgG (mg/dL) | IgA (mg/dL) | IgM (mg/dL) | |
|---|---|---|---|
| sample 1 (M) | 1,282.0 | 466.0 | 71.0 |
| sample 2 (F) | 1,626.0 | 231.0 | 62.0 |
| sample 3 (M) | 983.0 | 244.0 | 227.0 |
| sample 4 (M) | 1,530.0 | 212.0 | 198.0 |
| reference range | 861.0~1,747.0 | 93.0~393.0 | M: 33.0~183.0 F: 50.0~269.0 |

SP: patient serum, G: anti-human IgG (γ chain) serum, A: anti-human IgA (α chain) serum, M: anti-human IgM (μ chain) serum, κ: anti-human κ chain serum, λ: anti-human λ chain serum
Abnormal band formation was observed in the A and κ regions (red arrow in the figure).
対照検体の抑制率はナノピアIL-2R,ルミパルスプレストIL-2Rともに99.0%以上であった。乖離検体の抑制率はナノピアIL-2Rで11.7~50.4%であり,ルミパルスプレストIL-2Rで99.0%以上であった(Table 6)。
| Lumipulse Presto IL-2R | Nanopia IL-2R | Detaminer CL IL-2R (U/mL) |
|||||||
|---|---|---|---|---|---|---|---|---|---|
| Measured value (U/mL) | PBS:sample 1:9 (U/mL) | Antibody:sample 1:9 (U/mL) | Inhibition rate (%) | Measured value (U/mL) | PBS:sample 1:9 (U/mL) | Antibody:sample 1:9 (U/mL) | Inhibition rate (%) | ||
| sample 1 | 361.4 | 320.2 | 0.7 | 99.8 | 1,383.0 | 1,411.0 | 1,246.0 | 11.7 | 406.0 |
| sample 2 | 315.5 | 284.9 | 0.8 | 99.7 | 821.0 | 896.0 | 569.0 | 36.5 | 404.0 |
| sample 3 | 315.5 | 285.6 | 1.0 | 99.6 | 1,050.0 | 922.0 | 555.0 | 39.8 | 388.0 |
| sample 4 | 371.4 | 321.5 | 0.7 | 99.8 | 695.0 | 772.0 | 383.0 | 50.4 | 372.0 |
| control | 611.0 | 604.8 | 1.1 | 99.8 | 619.0 | 612.0 | 2.0 | 99.7 | 631.0 |
本研究では,ルミパルスプレストIL-2RとナノピアIL-2Rの基本性能を検討し院内導入における妥当性について評価した。
併行精度および室内再現精度は両試薬ともにCV 2.3%以下と良好な成績が得られた。検出限界,定量限界の結果,ルミパルスプレストIL-2RはナノピアIL-2Rと比較して低濃度での再現性に優れていたが,sIL-2R検査では低濃度域の臨床的有用性は乏しく基準範囲付近の再現性は両試薬とも良好であるため,日常測定する上で問題はないと考えられた。また,希釈直線性試験の結果から,ナノピアIL-2Rの測定上限は9,747.0 U/mLであり,日常検査法として十分な性能を有していたが,ルミパルスプレストIL-2Rの測定上限は146,782.8 U/mLとさらに広い測定範囲を有していた。当院において,2018年1月~2018年12月の期間にsIL-2R濃度が10,000.0 U/mLを超えた検体は10/2,292例であり,最大値は21,700.0 U/mLであったことから,ナノピアIL-2Rの測定では月1回程度の希釈測定が必要となり,ルミパルスプレストIL-2Rでは希釈することなく測定が可能であることが推定された。
従来法との相関は両試薬とも良好であったが,ナノピアIL-2Rでは従来法と乖離する検体を4例認めたことから精査を行った。希釈試験の結果,sample 1,sample 3の8倍希釈の測定値は,原液の値と50%以上の差を認めており非特異反応である可能性が高く,sample 2,sample 4は20%程度の差を認め非特異反応を否定できない結果であった。また,sample 4では8倍希釈の測定値より4倍希釈の測定値の方がCLEIAの測定値と近似した値を示したが,これは8倍希釈した測定値が定量限界以下となったためであると考えられる。抗sIL-2Rポリクローナル抗体を用いた抑制試験の結果では,ルミパルスプレストIL-2Rの抑制率は何れも99.0%以上を示し,特異反応であることが確認されたが,ナノピアIL-2Rでは何れもおよそ50%を下回っており,今回ナノピアIL-2Rで乖離を認めた4検体は非特異反応である可能性が強く示唆された。Sample 1では免疫固定法においてIgA-κ型のM蛋白が検出され,sample 3,sample 4ではいずれも血清IgM濃度が高値であり,その関与についてはナノピアIL-2Rの測定において検体中のIgMの関与により偽高値を示したとする報告10)もあるが,本研究では明確な原因の特定には至らなかった。
乖離検体の精査の結果,ナノピアIL-2RではCLEIAと乖離する検体が約1%に認められた。しかし,日常検査において乖離検体の精査を全て行うことは困難であり,ナノピアIL-2Rを使用する場合は,希釈測定を操作ステップに組み込む必要があると考えられた。さらに,本研究の結果において,ナノピアIL-2Rで1,000.0 U/mL以上を超える検体に希釈測定を組み込むことである程度の非特異反応を回避できる可能性はあるが,本研究ではナノピアIL-2Rで1,000.0 U/mLを超えた検体は約2割(108/492例)あり,5検体に1回は希釈測定を行う必要があると推測される。したがって,ラテックス免疫比濁法を用いた試薬を採用する場合は,非特異反応の発生を考慮した上で,回避方法を施して注意深く使用することが望まれる。本研究において,ルミパルスプレストIL-2Rでは非特異反応は認められず,ルミパルスプレストIL-2Rの方が優れている結果となったが,抗原抗体反応であるためCLEIAを測定原理とした試薬においても非特異反応は発生する可能性があり11),各施設の環境に応じて試薬を選択すべきであると考える。
sIL-2Rの測定は外部委託検査であるため結果報告に2~4日要し,そのため当院の血液内科では1週間後に患者に来院してもらい治療方針を決定している現状にあった。しかしながら,バーキットリンパ腫などの高度アグレッシブリンパ腫では,週単位で進行していくため12),早急に治療を開始する必要性がある。さらに,悪性リンパ腫の再発に先行して急激なsIL-2Rの上昇を認めたとする報告13)もされており,再発の早期予測や治療効果の判定に関しても有用であると考える。
ルミパルスプレストIL-2R,ナノピアIL-2Rの試薬の基礎的性能については良好であり,日常検査法として十分な性能を有していた。しかし,ナノピアIL-2Rでは非特異反応を示す検体が存在するため,ラテックス免疫比濁法を使用する場合は非特異反応の発生を考慮した上で,回避方法を施して注意深く使用することが望まれる。sIL-2R測定試薬を日常検査法として導入し,当日の結果報告が可能となることで即座に治療法を選択することが可能となり,臨床への貢献が期待される。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。