Abstract
症例は63歳の女性で,食思不振と左側腹部痛に起因する体調不良により救急外来を受診した.血液検査で白血球(76,900/mm3)と著明な増多を認めた.腹部造影CTと下部消化管内視鏡検査で横行結腸癌と診断,感染症や血液疾患は否定的でありgranulocyte-colony stimulating factor(以下,G-CSFと略記)産生腫瘍を疑い血清G-CSF値を検索したところ340 pg/mlと高値であった.左結腸切除,膵体尾部合併切除,回腸瘻造設術を施行した.腫瘍細胞は抗G-CSF抗体を用いた免疫組織化学染色で陽性を示した.術後血清G-CSF値,白血球は著明に減少したので,G-CSF産生横行結腸癌と診断した.術後21日目より白血球数の再上昇がみられ,肝S7に転移を認めた.全身化学療法を継続したが術後14か月で死亡した.G-CSF産生大腸癌は極めてまれであるが予後不良であることから報告する.
Translated Abstract
A 63-year old woman was admitted to our hospital due to appetite loss and persistent left abdominal pain. Laboratory data showed severe leukocytosis with elevated white blood cells (WBCs) (76,900/mm3). Transverse colon cancer was diagnosed based on CT and colonoscopy. There were no findings suggestive of infections or blood malignancy, but granulocyte-colony stimulating factor (G-CSF) was elevated to 340 pg/ml. Thus, colon cancer with production of G-CSF was suspected. Left colectomy, pancreatic tail resection and splenectomy with covering ileostomy were performed. Pathological findings indicated that the tumor was adenocarcinoma that was immunohistochemically positive for G-CSF. The serum G-CSF level and WBC count decreased to normal ranges after the operation. The final diagnosis was G-CSF-producing colon cancer. On postoperative day 21, the WBC count increased to 17,500/mm3 and CT revealed liver metastasis. Systemic chemotherapy was administered, but the patient died 14 months after the operation. We present this case as an extremely rare example of G-CSF-producing colon cancer as a tumor with a poor prognosis.
はじめに
Granulocyte-colony stimulating factor(以下,G-CSFと略記)産生腫瘍は近年肺癌を中心に報告が増えているが大腸癌における報告は比較的まれで,一般的に予後は不良とされている1)2).今回,進行横行結腸癌の治療に際して白血球の異常高値の原因検索のため血清G-CSF値を測定したところ異常高値を検出したことから術前にG-CSF産生腫瘍を疑うことが可能で,術後は白血球の再上昇から早期に肝転移を診断できたG-CSF産生大腸癌の1例を経験したので報告する.
症例
症例:63歳,女性
主訴:腹痛
現病歴:当院受診2か月前より食思不振を自覚し,1か月前より左側腹部痛が出現したため近医を受診した.精査目的に撮影された腹部造影CTで横行結腸に腫瘍性病変を指摘され当院消化器内科へ紹介予定であったが,同科受診予定日以前に体調不良となり近医受診後11日目に当院救急外来を受診した.
既往歴:特記事項なし.
家族歴:特記事項なし.
来院時現症:身長156 cm,体重46.5 kg,体温36.9°C,脈拍100回/分,血圧137/61 mmHg.眼瞼結膜は蒼白,腹部は膨満軟,左上腹部に手拳大,可動性のある弾性硬の腫瘤を触知した.
初診時血液検査所見:著明な貧血(Hb 5.0 g/dl)と著明な白血球(76,900/mm3),好中球(74,100/mm3)の増多および炎症反応の上昇(CRP 9.59 mg/dl)を認めた.腫瘍マーカーはCEA(5.7 ng/ml)と CA19-9(156.1 U/ml)の軽度上昇を認めた.栄養状態はTP(5.50 g/dl),Alb(2.49 g/dl)と不良であった(Table 1).
Table 1
Blood test results
| WBC |
76,900/μl |
TP |
5.50 g/dl |
| (STAB |
9.0% |
Alb |
2.49 g/dl |
| (SEG |
86.0% |
BUN |
9.9 mg/dl |
| (BASO |
0% |
Cre |
0.47 mg/dl |
| (EOSIN |
1.5% |
Na |
129 mEq/l |
| (MONO |
1.0% |
K |
4.2 mEq/l |
| (LYMPH |
2.5% |
Cl |
95 mEq/l |
| Hb |
5.0 g/dl |
Ca |
8.3 mg/dl |
| Plt |
65.0/μl |
CRP |
9.59 mg/dl |
| AST |
15 U/l |
CEA |
5.7 ng/ml |
| ALT |
13 U/l |
CA19-9 |
156.1 U/ml |
| ALP |
528 U/l |
AFP |
1.7 ng/ml |
| LDH |
163 U/l |
|
|
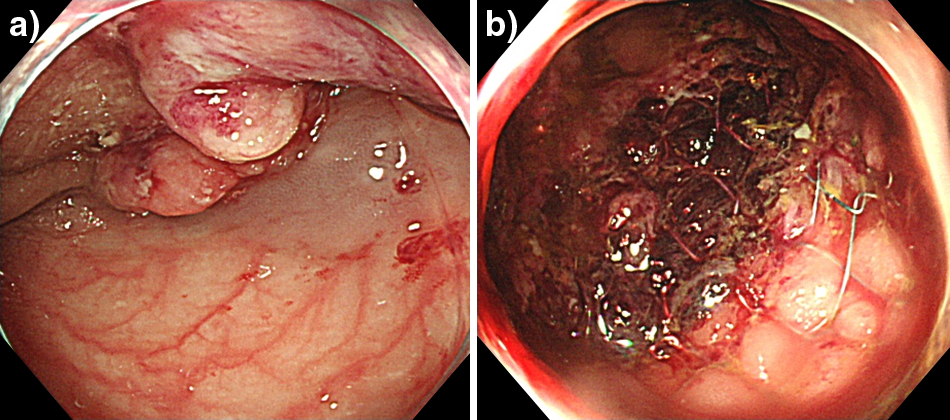
下部消化管内視鏡検査所見:横行結腸脾彎曲部に全周性2型腫瘍を認めた.内視鏡の通過は不可であり易出血性であった.この際の生検結果はgroup 1であった(Fig. 1a).
腹部造影CT所見:横行結腸脾彎曲部に造影効果を伴う腫瘤を認めた.腫瘤は9×4 cmで,周囲組織との境界は一部不明瞭で膵体尾部への浸潤が否定できなかった.口側の結腸は拡張し腫瘍による内腔閉塞が疑われたが口側腸管壁の肥厚や周囲の脂肪織濃度の上昇はなく,閉塞性大腸炎の所見や領域リンパ節の腫大も認めなかった(Fig. 2).
入院後経過:この時点で閉塞性横行結腸癌を疑い,自己拡張型金属ステント(self-expandable metallic stent;以下,SEMSと略記)を留置した(Fig. 1b).入院後38°Cの発熱を認めた.絶食,補液,抗生剤投与で治療を開始したが発熱,白血球数,好中球数は改善しなかったので細菌感染症を疑って血液培養を行ったが陰性であった.さらに,血液疾患を疑って血球分画を検索したが血液中に赤芽球や幼若顆粒球を認めず,脾腫も認めなかったことから血液疾患は否定的であった.そこでG-CSF産生腫瘍の可能性を検索するため入院4日目に血清G-CSF値を測定したところ340 pg/ml(正常39.0 pg/ml以下)と著明な高値を示した.この時点でG-CSF産生横行結腸癌が強く疑われた.SEMS留置により腸閉塞状態は解除されたがその後も食事摂取が進まず,栄養状態はTP(5.29 g/dl),Alb(2.68 g/dl)と不良であった.全身状態の改善が見込まれなかったため原発巣切除を優先しSEMS留置後11日目に手術を施行した.
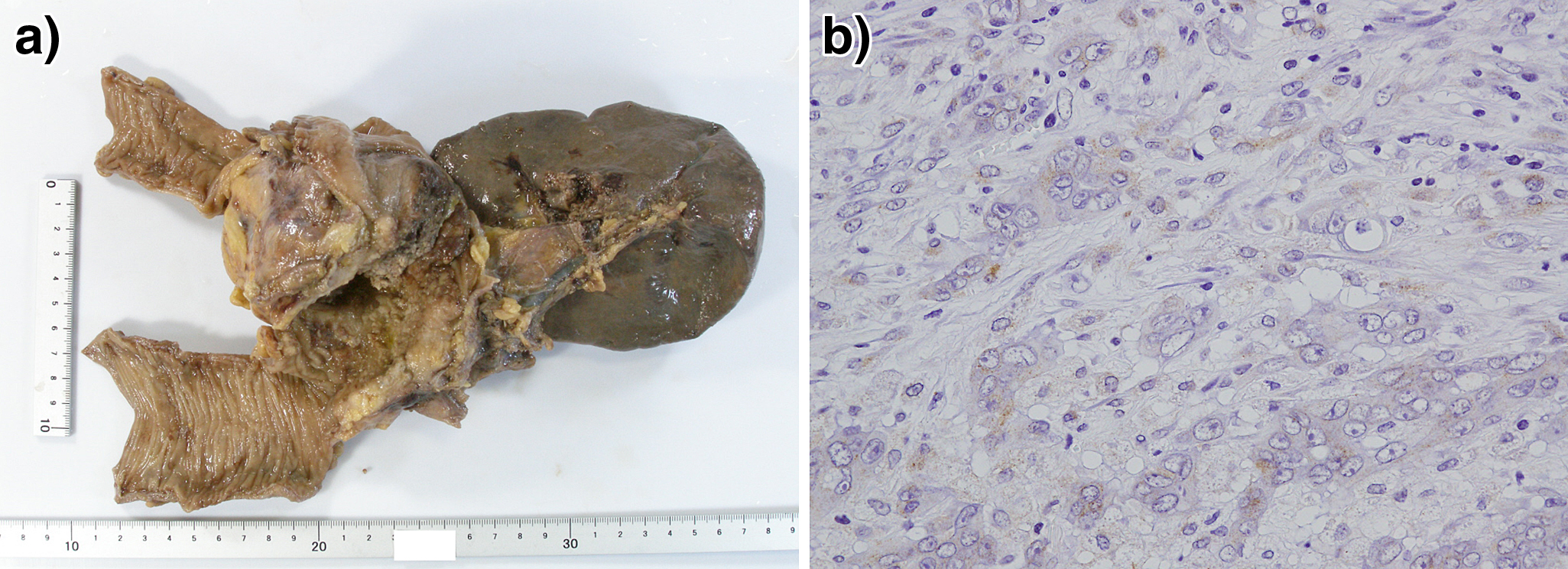
手術所見:開腹して腹腔内を検索したところ播種結節や肝転移は認めなかった.腫瘍は横行結腸脾彎曲部近くに位置しており,膵体部に浸潤が疑われたため左半結腸切除,膵体尾部合併切除(D3郭清),回腸人工肛門造設を施行した.
病理組織学的検査所見:腫瘍は90×40 mmの5型で組織像はpor主体であったが膵組織への浸潤は認めなかった.病理組織診断はpT4a(SE),N0,H0,P0,pStage IIであった.RAS変異はKRAS codon13変異型であった.また,腫瘍細胞の大部分は抗G-CSF抗体を用いた免疫組織化学染色で陽性を示した(Fig. 3).この結果からG-CSF産生横行結腸癌と病理学的に診断された.
術後経過:術後5日目の白血球数は9,400/mm3まで減少し,術後7日目の血清G-CSF値は33.8 pg/mlに減少した.これらの経過から臨床的にもG-CSF産生横行結腸癌と診断した.術後12日目頃より38.4°Cの発熱,21日目より白血球の再上昇を認めたため熱源精査目的に造影CTを施行したところ肝S7区域に23 mmの低吸収域を認めた.明らかな腫大リンパ節は認めなかった.転移と膿瘍の鑑別のために施行した腹部超音波検査にて同部位に充実性腫瘤を認めたため超音波ガイド下に充実性腫瘤の穿刺を行ったところ病理組織学的に肝転移の診断であった.術後35日目の血清G-CSF値は154 pg/mlと再上昇を認めたが全身状態が改善したため肝転移に対する治療は保留とし術後44日目に一旦退院した(Fig. 4).退院後術後49日目に撮影したPET-CTでは肝S7区域(SUV max 14.3),左傍大動脈領域(SUV max 7.4)および腰椎左方の後腹膜にも軽度の単発集積を認めた.この所見からG-CSF産生横行結腸癌術後の単発性肝転移,後腹膜局所再発が疑われ,術後60日目よりSIRB療法(S-1/CPT-11+Bevacizumab)による化学療法を外来で開始した.術後5か月の造影CTではPET-CTで集積を認めた腰椎左方に腫大リンパ節を認めた.SIRB療法を7クール終了した術後7か月の血清G-CSF値は41.7 pg/mlまで低下し,造影CTではリンパ節の増大はなく肝転移巣は縮小傾向であったためこの時点でPRと判定された.術後10か月で行ったPET-CT,造影CTでは肝転移巣はほぼ消失していたが腰椎左方の集積が増悪(SUV max 19.8)していた(Fig. 5).左水腎症も認められ後腹膜局所再発による尿管閉塞が強く疑われた.これらの所見から,後腹膜局所再発の増悪と診断された.そのためJ型尿管ステントを留置後,化学療法を2nd-line(B-mab/XELOX)に変更した.しかし,その後も急速に後腹膜の転移性腫瘍は増大したため術後13か月で化学療法は中止となり術後14か月で死亡された.
考察
悪性腫瘍の診療経過において,白血球異常高値を認めることは少なくない.このような場合,感染症や血液疾患を否定できれば,G-CSF産生腫瘍を念頭に置く必要がある.G-CSF産生腫瘍は,本邦では1977年にAsanoら3)がG-CSF産生肺癌を初めて報告して以来,主に肺癌,膀胱癌,胃癌,甲状腺癌,胆囊癌などでの報告がある1)4).診断には,①著明な白血球の増加,②血清G-CSF活性値の上昇,③腫瘍切除による白血球数の減少,④腫瘍内におけるG-CSFの証明が必要とされる3).自験例では術前に①,②を満たし術後に③,④を満たしたことからG-CSF産生大腸癌と確定診断された.
そこでまずG-CSF産生大腸癌の報告例について検討した.医学中央雑誌で1964年から2018年までの期間において「G-CSF」,「大腸癌」,「盲腸癌」,「結腸癌」,「直腸癌」,「G-CSF産生」をキーワードに検索したところG-CSF産生大腸癌の報告は10例(会議録を除く)2)5)~13)のみであった.そこで自験例を含めた11例(Table 2)の臨床的特徴について検討した.
Table 2
Reported cases of G-CSF-producing colorectal cancer in Japan
| No |
Author |
Year |
Age |
Sex |
Location |
Stage |
Treatment |
1st. WBC
(/μl) |
1st. G-CSF
(pg/dl) |
Max WBC
(/μl) |
Max G-CSF
(pg/dl) |
AT WBC
(/μl) |
AT G-CSF
(pg/dl) |
Prognosis |
| 1 |
Ogasawara5) |
2001 |
73 |
female |
C |
IIIc |
R2 |
18,400 |
430 |
101,200 |
430 |
ND |
ND |
1M dead |
| 2 |
Shida6) |
2008 |
63 |
male |
R |
IIIb |
R1 |
18,130 |
115 |
111,890 |
115 |
11,680 |
ND |
26D dead |
| 3 |
Fujiwara7) |
2009 |
81 |
male |
A |
IIIb |
R0+ACT |
17,620 |
334 |
17,620 |
334 |
normal |
ND |
24M alive |
| 4 |
Ueyama8) |
2010 |
53 |
female |
A |
IV |
CT |
13,100 |
426 |
58,900 |
426 |
ND |
ND |
ND |
| 5 |
Kawaida9) |
2012 |
81 |
female |
A |
IV |
R2+CT |
25,400 |
124 |
40,500 |
124 |
7,100 |
ND |
7M dead |
| 6 |
Sumiyoshi10) |
2012 |
44 |
male |
A |
IV |
R2+CT |
17,220 |
24 |
40,460 |
67.7 |
normal |
22 |
125D dead |
| 7 |
Masuda11) |
2014 |
60 |
male |
S |
IIIa |
R0+ACT |
21,300 |
71 |
54,280 |
71 |
normal |
normal |
28M alive |
| 8 |
Takahashi12) |
2015 |
72 |
male |
R |
IV |
R2+CT |
15,500 |
280 |
53,600 |
280 |
ND |
ND |
51D dead |
| 9 |
Hirayama13) |
2015 |
84 |
male |
R |
IV |
R2+CT |
10,900 |
61 |
10,900 |
61 |
ND |
ND |
58D dead |
| 10 |
Yogi2) |
2017 |
81 |
female |
A |
IIa |
R0 |
36,000 |
ND |
36,000 |
ND |
ND |
ND |
10M alive |
| 11 |
Our case |
|
63 |
female |
T |
IIb |
R0+ACT |
76,900 |
340 |
93,900 |
340 |
9,400 |
33.8 |
14M dead |
Max: maximum, AT: after treatment, C: cecum, A: ascending colon, T: transverse colon, S: sigmoid colon, R: rectum, ACT: adjuvant chemotherapy, CT: chemotherapy, M: month, D: day, ND: not described.
まずG-CSF産生大腸癌の頻度であるが,医学中央雑誌において同時期に同様のキーワードで肺癌,胃癌,乳癌について検索したところG-CSF産生肺癌,胃癌,乳癌はそれぞれ100例以上,42例,9例であり,肺癌が最も多かった.
次にG-CSF産生大腸癌の年齢および性差についてみると年齢の中央値は72歳(44~84歳),男性6例,女性5例と好発年齢や性差に明らかな傾向は見られなかった.腫瘍の局在は盲腸1例,上行結腸5例,横行結腸1例,S状結腸1例,直腸3例と右側結腸に多い傾向が見られた.治癒切除は4例(36.4%)と低率でその予後については生存が3例,1例(自験例)は術後14か月に死亡している.非治癒切除7例の予後は不良で,生存期間中央値は約2か月であった.これは通常の薬物療法を実施しない場合の切除不能進行再発大腸癌の生存期間中央値(約8か月)14)と比べても極めて予後不良である.予後不良な原因として発見時にすでに進行癌であることや術後の転移再発が急速であること6)が挙げられている.その理由としてG-CSF産生腫瘍では腫瘍細胞上にG-CSFレセプターが発現しているため,G-CSFがautocrine・paracrine 的に作用し,腫瘍細胞の増殖や進展を促しているためとする報告がある15)16).すなわち,G-CSF産生腫瘍は細胞の成長速度が早いことが予後不良の要因になっているとする考えである.したがって,原発巣や転移再発巣の早期発見が予後を改善するうえで重要であることが示唆される.
したがって,G-CSF産生大腸癌の早期発見や経過観察過程において血清G-CSF値を測定することや白血球数の変動に着眼する意義は大きい.まず,早期発見の可能性については,日常診察の場において感染や血液疾患の可能性のない白血球増多症に遭遇した際にはG-CSF産生腫瘍を除外するためにも一度は血清G-CSF値を測定しておくことを念頭に置くべきと考えられる.次に経過観察過程における血清G-CSF値測定の意義については治癒切除を施行できた症例では術後血清G-CSF値および白血球数が低下し6)7)11),非治癒切除となった症例ではこれらの値は上昇したとする報告からも明らかである.さらに,化学療法を施行した症例においては治療効果が認められた際は血清G-CSF値および白血球数が低下し,腫瘍が増悪した際にはこれらの値は上昇した9)10)とされるので,化学療法の効果判定にも有用であることが示唆される.自験例においても腫瘍切除術後にこれらの値は正常化し,肝転移出現に伴って再上昇し,化学療法中は肝転移巣の縮小に伴ってこれらの値がほぼ正常化した.
残念ながら自験例では早期に顕性の肝転移がみられ,それに伴う血清G-CSF値,白血球数の急速な増加がみられたが,症例によっては測定の間隔を短縮することで再発,転移巣をより早期に検出できる可能性がある.したがって,予後不良とされるG-CSF産生腫瘍の治療に際しては,血清G-CSF値,白血球数を頻回に測定することで病勢の増悪を早期に覚知できると思われた.
また,G-CSF自体には発熱やCRP上昇の作用はないとされている.一般にG-CSF産生腫瘍において発熱,CRPが上昇する機序としてはIL-6などの炎症性サイトカインが関係していると考えられている6)12).本症例ではIL-6の測定は行っていないものの,腫瘍によりIL-6などのサイトカインが産生され,これらの作用によって発熱,CRPが上昇したと考えられる.これら発熱や高CRP血症に対する治療としてはステロイドの投与が挙げられる.ステロイドはIL-6産生を抑制する効果があると考えられており,IL-6はG-CSFのプロモーターでもあるため17),ステロイド投与により炎症性サイトカインの産生が抑制され発熱,高CRP血症に対する対症療法になりうると考えられる.
腸閉塞で発見されたG-CSF産生横行結腸癌に対して腫瘍切除を行い,術後はsecond lineまでの化学療法を行ったが,術後14か月で再発のため死亡した症例を経験した.G-CSF産生大腸癌は極めてまれであるが,予後不良であるため日常の下部消化管疾患診療において感染,血液疾患の可能性がない白血球増多症に遭遇した際にはG-CSF産生大腸癌を除外する意味でも,早期発見のためにも血清G-CSF値の測定を試みるべきである.また,G-CSF産生大腸癌の経過観察にあたっては血清G-CSF値や白血球数の測定により再発,転移巣の早期発見に繋がる可能性がある.
利益相反:なし
文献
- 1) 山家 滋, 岡村 精一.悪性腫瘍とCSF.医学のあゆみ.1987;143(6):509–511.
- 2) 与儀 憲和, 片岡 雅章, 海保 隆, 柳澤 真司, 西村 真樹, 小林 壮一.G-CSF産生上行結腸癌の1例.日本臨床外科学会雑誌.2017;78(8):1844–1847.
- 3) Asano S, Urabe A, Okabe T, Sato N, Kondo Y. Demonstration of granulopoietic factor(s) in the plasma of nude mice transplanted with a human lung cancer and in the tumor tissue. Blood. 1977;49(5):845–852.
- 4) 兒玉 綾香, 天野 由美子, 坂根 聡, 田村 克実, 中川 聡, 糸賀 真理.G-CSF産生腫瘍による白血球増多症の一例.島根医学検査.2018;46(1):12–16.
- 5) 小笠原 豊, 東 晃平, 岡野 和雄, 米原 修治.Granulocyte-colony stimulating factorが高値を示した盲腸癌の1例.日本臨床外科学会雑誌.2001;62(9):2223–2227.
- 6) 信太 昭子, 高橋 毅, 飯塚 美香, 柳原 正智, 芦澤 敏, 鈴木 敬二.G-CSF産生直腸未分化癌の1例.日本臨床外科学会雑誌.2008;69(7):1737–1741.
- 7) 藤原 有史, 高塚 聡, 貝塚 亮二, 菅野 兼史, 山崎 修.G-CSF産生上行結腸癌の1例.日本臨床外科学会雑誌.2009;70(臨):544.
- 8) 植山 聖子, 有働 直子, 西川 清美, 山崎 博子.著明な白血球増多を呈したG-CSF産生上行結腸癌の一例.医学検査.2010;59(4):537.
- 9) 川井田 啓介, 門野 潤, 上田 英昭, 大迫 政彦, 石崎 直樹, 清水 健,ほか.Granulocyte-colony stimulating factor(G-CSF)産生上行結腸癌の1例.日本消化器外科学会雑誌.2012;45(5):537–543.
- 10) 住吉 宏樹, 横井 公良, 牧野 浩司, 金沢 義一, 山田 岳史, 内田 英二.手術と化学療法で一時的に症状緩和が得られたG-CSF産生大腸癌の1例.日本臨床外科学会雑誌.2012;73(7):1753–1758.
- 11) 増田 剛, 澤田 鉄二, 奥野 倫久, 城月 順子, 村橋 邦康, 西野 光一.G-CSF産生大腸癌の1例.日本臨床外科学会雑誌.2014;75(4):998–1004.
- 12) 高橋 啓, 林 昌俊, 栃井 航也, 小久保 健太郎, 丹波 真佐夫.G-CSF産生直腸癌の1例.日本臨床外科学会雑誌.2015;76(11):2769–2773.
- 13) 平山 一久, 林 忠毅, 西脇 由朗, 中村 明子, 大菊 正人, 田村 浩章,ほか.急激な経過をたどったgranulocyte-colony stimulating factor産生直腸未分化癌の1例.日本消化器外科学会雑誌.2015;48(1):68–74.
- 14) Simmonds PC. Palliative chemotherapy for advanced colorectal cancer: systematic review and meta-analysis. Colorectal Cancer Collaborative Group. BMJ. 2000;321(7260):531–535.
- 15) Baba M, Hasegawa H, Nakayabu M, Shimizu N, Suzuki S, Kamada N, et al. Establish and characteristics of a gastric cancer cell line (HuGC-OOHIRA) producing high levels of G-CSF, GM-CSF, and IL-6: the presence of autocrine growth control by G-CSF. Am J Hematol. 1995;49(3):207–215.
- 16) Tachibana M, Miyakawa A, Tazaki H, Nakamura K, Kubo A, Hata J, et al. Autocrine growth of transitional cell carcinoma of the bladder induced by granulocyte-colony stimulating factor. Cancer Res. 1995;55(15):3438–3443.
- 17) 野津田 泰嗣, 星川 康, 桜田 晃, 野田 雅史, 岡田 克典, 近藤 丘.G-CSFおよびIL-6産生肺癌の一切除例.日本呼吸器外科学会雑誌.2010;24(5):859–863.