Abstract
症例は76歳の女性で,嘔気,食欲不振および上腹部腫瘤を主訴に当院を紹介受診した.内視鏡検査でヘリコバクター・ピロリ陽性多発性胃潰瘍と診断し投薬治療を施行したが,治療後の内視鏡検査で4型進行胃癌,特殊型,その他の癌(miscellaneous carcinoma)と診断した.さらに,抗リゾチーム抗体免疫染色検査(以下,リゾチーム染色と略記)を含めた各種免疫染色検査によりWHO分類におけるパネート細胞胃癌と診断し,幽門側胃切除術を施行した.術後22か月経過したが,明らかな再発を認めていない.パネート細胞は,腸上皮化生の結果として胃に出現しうる.文献検索上,癌化の過程で胃癌組織の中にパネート細胞様のリゾチーム染色陽性顆粒を含む細胞が散見されるという報告はあるが,本症例のように同顆粒を細胞質に含んだ小型の腫瘍細胞がびまん性浸潤性に増殖するとされるパネート細胞胃癌は極めてまれであった.
Translated Abstract
A 76-year-old woman was referred to our hospital for complaints of nausea, loss of appetite, and an upper abdominal mass,. Initially, she was diagnosed with multiple gastric ulcers with Helicobacter pylori infection by upper gastrointestinal endoscopy, and medication was administered. However, reexamination by endoscopy after this treatment revealed type 4 advanced gastric cancer, special type (miscellaneous carcinoma). Additional tests, including immunostaining with anti-lysozyme antibody (lysozyme staining), revealed Paneth cell gastric cancer (World Health Organization classification) and distal gastrectomy was performed. Twenty-two months after the operation, there was no obvious recurrence. Paneth cells are found in gastric mucosa as a result of intestinal metaplasia. Several studies have reported that Paneth cell-like cells containing positive granules that stain with lysozyme are found in gastric cancer tissue during the process of carcinogenesis. However, Paneth cell gastric cancer, in which small tumor cells containing granules in the cytoplasm infiltrate diffusely, as in the present case, is extremely rare.
はじめに
パネート細胞は十二指腸・空腸・近位回腸に分布し,粘膜の腸陰窩基底部に見られ,好酸性の大きな分泌顆粒を持つことが特徴である.本来,胃粘膜には パネート細胞は存在しないが,ヘリコバクター・ピロリ菌感染などの炎症による腸上皮化生の結果として胃にもパネート細胞は発生しうる.また,癌化の過程で胃癌組織の中にパネート細胞様のリゾチーム染色陽性顆粒を含む細胞が散見されることも報告されている1).しかし,形態学的にパネート細胞とされる癌細胞がpredominantであるパネート細胞胃癌(Paneth cell carcinoma)2)はWHOの胃癌分類においても非常にまれなサブタイプとして記載されている3).
今回,我々は術前診断しえたパネート細胞胃癌を経験したため報告する.
症例
症例:76歳,女性
主訴:嘔気,食欲不振
既往歴:24歳時,虫垂切除術.高血圧症,高脂血症,逆流性食道炎にて内服加療中.
現病歴:2018年4月から持続する嘔気を伴う食欲不振のため,同年5月にかかりつけ医を受診した.上腹部に腫瘤を触知したため,精査加療目的に当院を紹介受診した.
理学所見:腹部は平坦で,上腹部正中に軽度の圧痛を伴う手拳大腫瘤を触知した.反跳痛や筋性防御はなかった.
血液生化学所見:外来初診時に炎症所見や貧血なく,アルブミン低下や電解質異常も認めなかった.また,CEA,CA19-9,IL-2Rに上昇はなかった.血清抗ヘリコバクター・ピロリ抗体が陽性であった.
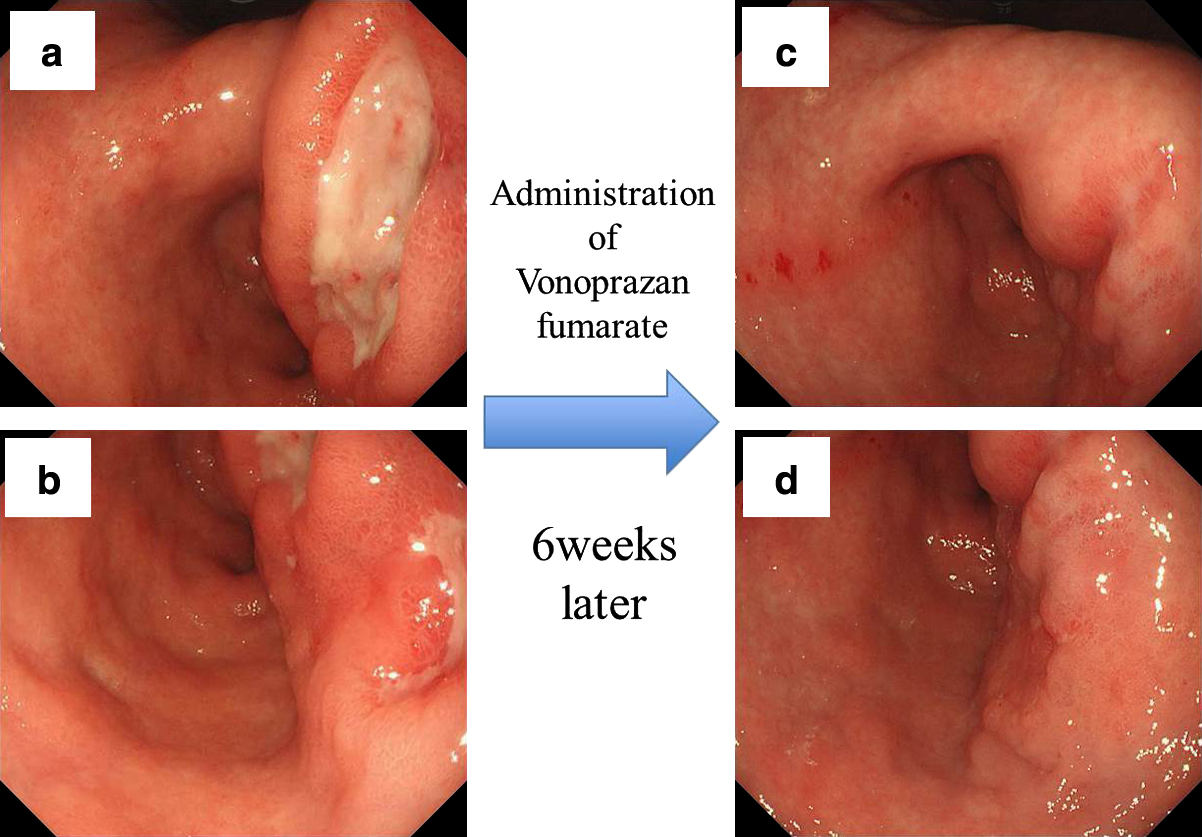
上部消化管内視鏡検査所見:胃体下部後壁中心に大きな潰瘍性病変を認め(Fig. 1a, b),生検結果はGroup 1であった.良性潰瘍と考え,ヘリコバクター・ピロリ除菌療法施行のうえ,ボノプラザン投与を6週間行った.その後の再検で潰瘍底は上皮化していたが,胃体下部から前庭部の後壁中心に4型胃癌の所見を呈していた(Fig. 1c, d).再度の生検では細胞質が好酸性に染色される腫瘍細胞が多数見られ,本邦取扱い規約特殊型の中のその他の癌と診断した4).さらに,リゾチーム染色が陽性であったことから,WHO分類におけるパネート細胞胃癌と診断した(Fig. 2).
腹部CT所見:胃体部から前庭部の壁肥厚を認めたが,膵臓との境界は明瞭であった(Fig. 3).明らかなリンパ節腫大や遠隔転移は認めなかった.
上部消化管バリウム透視所見:胃角部の開大,前庭部から幽門輪の壁の不整を認めた(Fig. 4a).腫瘍口側小彎には壁の硬化所見を認めた(Fig. 4b).
以上より,術前診断は,パネート細胞胃癌,LM,Post Less,4型,cT3,cN0,M0,cStage IIBとし,幽門側胃切除術,D2郭清,Roux-en Y再建を施行した.
手術所見:腹水貯留や腹膜転移は認めなかった.腹水洗浄細胞診は陰性であった.所属リンパ節にも明らかな腫大は認めなかった.D2郭清を伴う幽門側胃切除術を行ったが,術前画像で胃小彎に壁の硬化所見があったため,口側断端については食道胃接合部直下で胃を切離し,術中迅速病理検査で陰性を確認した.十二指腸側は肉眼的には幽門輪に浸潤はないと思われたので,幽門輪より2横指肛門側で切離し,術中迅速病理検査には提出しなかった.
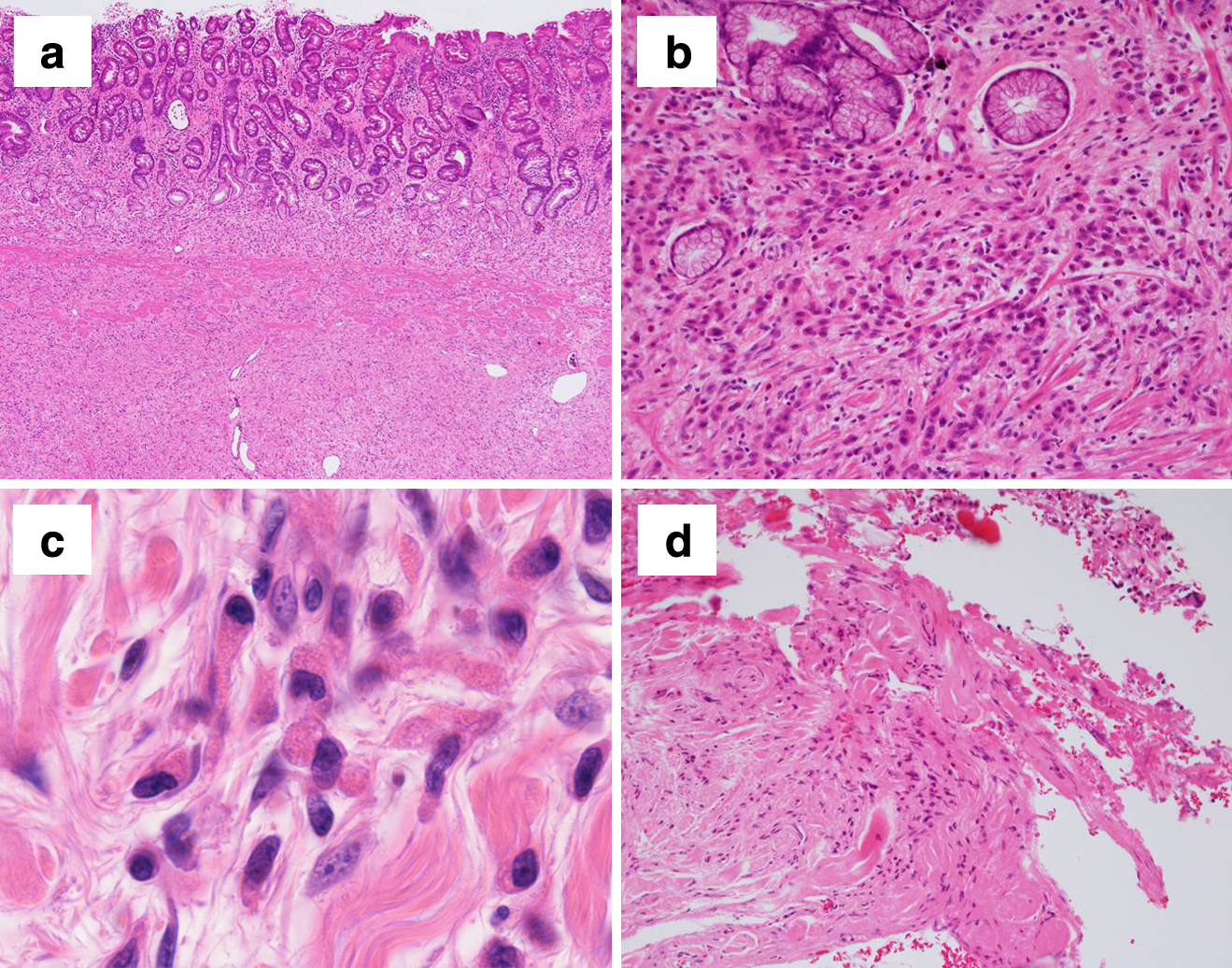
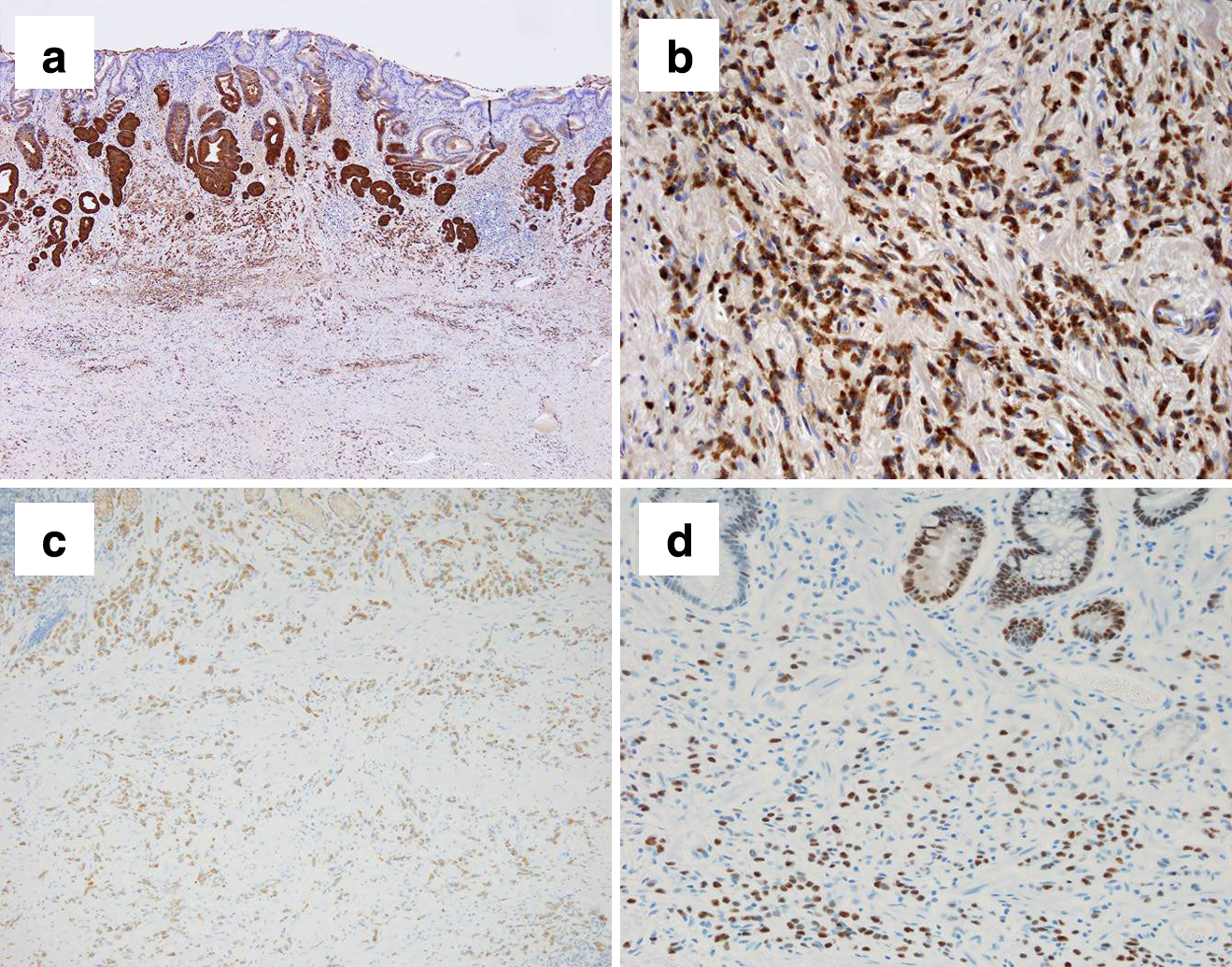
摘出標本および病理組織学的検査所見:腫瘍径は15.7×11.0 cmであった.胃体中部から前庭部にかけて平坦で壁肥厚を伴う4型腫瘍を認め,一部が漿膜外へ露頭していた(Fig. 5).病理組織学的には,腺管構造を伴わず,HE染色で好酸性顆粒を有し,リゾチーム染色陽性の腫瘍細胞が孤立性に粘膜下を中心として漿膜外まで進展していた.強拡大においては,全ての腫瘍細胞の細胞質内に多数の好酸性顆粒を認めた(Fig. 6).腫瘍細胞は高度の散在性浸潤傾向を有し,十二指腸側断端には漿膜面にのみ腫瘍細胞を認め,病理組織学的には肛門側断端陽性と診断した.脈管内に少数の腫瘍細胞侵襲を認め,これらの腫瘍細胞もリゾチーム染色陽性であった(Fig. 7a, b).また,幽門下リンパ節に2か所の転移を認め,いずれも微小転移であったが,同じくリゾチーム染色陽性であった.最終診断は,パネート細胞胃癌,LM,4型,pT4a(SE),sci,INF C,ly1,v1,pN1(2/42),cM0,pStage IIIA,pPM0(20 mm),pDM1,D2,R1.免疫染色検査ではAE1/AE3(+),Lysozyme(+),Ki-67:15~30%,P53(–),CD34(–),CDX-2(+),H+K+ ATPase(–),Pepsinogen I(–),MUC2(–),MUC5AC(–),MUC6(–),HER2 IHC score 0であった.本症例は本邦の胃癌取扱い規約(第15版)では,特殊型の中のその他の胃癌に分類されるが,WHOの胃癌分類においてはパネート細胞胃癌として,その他のまれなサブタイプに分類される3).
術後は,一時的な胃十二指腸吻合部の浮腫により食事摂取開始が遅れたものの保存的に軽快し,術後22日目に退院した.本症例は特殊な組織型であるため,術後化学療法として十分なエビデンスがないものの,胃癌治療ガイドライン5)に則りS-1+OHP療法(S-1+オキサリプラチン)を6か月行った.続けて十分な説明と同意のもと,S-1単独療法を6か月追加した.肛門側断端のさらなる追加切除を行う場合は膵頭十二指腸切除術が必要となる可能性があり,大きな侵襲を伴うため,追加切除を行うよりもすみやかに抗がん剤治療を行うことを選択した.術後22か月経過したが,再発所見は認めていない.
考察
パネート細胞は,主に小腸Lieberkurn腺の陰窩底部に存在し,腸管機能を担う4種類の分化細胞(吸収上皮細胞,杯細胞,内分泌細胞,パネート細胞)の一つとされている.そのうちパネート細胞のみが陰窩底部に局在し,その他の分化細胞は分化とともに陰窩から絨毛に移動していく6).小腸陰窩底部では,パネート細胞より分泌されるepidermal growth factor(EGF),transforming growth factor α(TGFα),Wnt3により,パネート細胞に隣接する腸管上皮幹細胞を増殖・分化させる6)7).
また,パネート細胞が分泌する抗菌物質として,リゾチーム,ホスホリパーゼA2,およびαディフェンシンが知られている.そのうち,抗菌ペプチドαディフェンシンは病原菌を選択的に強く殺菌することにより,腸内細菌叢による恒常性維持に重要な役割を果たしており8),パネート細胞の機能不全により,Crohn病や腸管感染をじゃっ起するともいわれている9)10).
パネート細胞の分布密度は,手術や悪性新生物,炎症性疾患により変化し11)12),さまざまな癌種においても発現しているが13),本来,胃にパネート細胞は存在しない.ヘリコバクター・ピロリ菌感染などの炎症による腸上皮化生の結果として胃にパネート細胞が発生することはよく知られており14),本症例でも術前検査においてヘリコバクター・ピロリ菌感染を認め,また,腫瘍および腫瘍の背景粘膜もCDX-2陽性(Fig. 7d)であり,腸上皮化生が存在していた.
本症例の診断においては,術前の生検材料において病理組織学的にHE染色で粘膜下層を中心に広がる腺管形成を伴わない低分化型腫瘍細胞を認め,その腫瘍細胞の全てに細胞質内にエオジンで染色される多数の顆粒を認めた.免疫染色検査を行ったところ,それらの顆粒はリゾチーム染色陽性でかつリゾチーム染色濃度がほぼ均一であった.これにより,術前診断をパネート細胞胃癌とした.さらに,摘出標本において,リゾチーム染色陽性顆粒を含有していない通常の腺癌細胞の混在は認められなかった.AE1/AE3陽性(Fig. 7c)であることから上皮性腫瘍であることを確認し,H+K+ ATPase陰性,およびPepsinogen I陰性であることから壁細胞腫瘍を除外し,S-100P陰性であることから顆粒細胞腫瘍を除外した.腫瘍細胞はリゾチーム染色陽性で,細胞質内の粗大顆粒に染色されていた.Synaptophysin(+/–),CD56(+/–)であったが,細胞質内の粗大顆粒のみに陽性を示し,非特異的染色と判断した.よって,神経内分泌腫瘍も除外した.また,MUC2,MUC5AC,MUC6はいずれも陰性であり,腫瘍細胞に粘液も含まれていないことから,最終的にパネート細胞胃癌と確定診断した.
そこで,医学中央雑誌で1964年から2020年3月までの期間で「パネート細胞,または,Paneth細胞」,「胃」をキーワードとして会議録を除いて検索したところ,8件の胃パネート様腫瘍細胞に関する報告を認めたが15)~22),これらの報告は全てパネート様腫瘍細胞(あるいは腫瘍性パネート細胞)が胃癌組織内に少数見られたという報告であった.これらのパネート様腫瘍細胞の報告はパネート様腫瘍細胞が分化型細胞や内分泌細胞などの他の形態に分化した胃癌細胞の中で散在性に混在する報告であり,びまん性浸潤性に増殖するとされるパネート細胞胃癌という定義には当てはまらない.
さらに,PubMedで1950年から2020年3月までの期間で「Paneth cell carcinoma」,「stomach」をキーワードとして検索したところ,8件の報告を認めたが22)~29),本症例のように全ての腫瘍細胞の細胞質内にエオジンで染色される多数のリゾチーム染色陽性顆粒を認める報告は認めていない.一般的にはパネート様腫瘍細胞は胃の細胞が癌化する際にさまざまな分化異常を起こすために出現すると考えられており20)23),分化の方向あるいは結果として論じられている.過去の報告例ではパネート細胞胃癌においても分化度の違う腫瘍細胞が混在し,パネート様腫瘍細胞以外つまりは顆粒を持たない胃癌細胞も混在している.そのため,術前にパネート細胞胃癌と診断されたものはなかった.本症例は一律に腫瘍細胞がパネート様腫瘍細胞である極めてまれな形態であったため,生検材料においてもパネート細胞胃癌の診断が可能であった.
反省点ではあるが,術前の生検でパネート細胞胃癌と診断しえた場合には,浸潤傾向が強い低分化型から未分化型胃癌を想定して,切除標本の断端の評価については術前および肉眼所見以上に慎重な対応が必要と考えられる.
一方,腸上皮化生で出現したパネート細胞が癌化したかどうかについては,胃腺腫の悪性化の危険因子としてパネート細胞が出現する完全腸型の腺腫は癌化の危険が低いとの報告や30),Ohtaniら26)のパネート様細胞を有する胃低分化型腺癌の検討でも,5例中2例はconcanabalin AIII型粘液(Con AIII)染色陽性との報告もあり26),一般的には不明とされている.
パネート細胞胃癌の治療については,Ooiら23)の症例では手術が施行され,術後2年の観察期間で再発はなかったとの報告もあり,基本的には他の胃癌と同様に手術が第一選択になるものと思われる.一方,Levら25)の症例では切除不能で5-FUとdoxorubicin hydrochlorideとmitomycin Cによる化学療法が行われ,治療3週間後に死亡したと報告されているが,特殊型とされるパネート細胞胃癌が通常の胃癌と同じ抗がん剤感受性があるかどうかは不明である.本症例では本邦のガイドラインに則り,S-1+OHP療法を選択した.さらに,肛門側断端陽性であることから,S-1+OHP療法6か月完遂の時点では明らかな画像上の再発所見は認めなかったが,十分な説明と同意のもとオキサリプラチンの末梢神経障害を防ぐ意味でS-1単独療法に切り替えた.その後6か月投与後も画像上明らかな再発徴候を認めなかったため化学療法を中止し経過観察としたが,現在術後22か月経過したものの明らかな再発は認めていない.今後,症例数を蓄積することでパネート細胞胃癌に対する至適な化学療法の知見が生まれるかもしれない.
特殊型の胃癌で,HE染色において明るく赤く染色される顆粒を細胞質に含んだ小型の腫瘍細胞がびまん性浸潤性に増殖する場合は,積極的にリゾチーム染色を行うことでパネート細胞胃癌と診断される症例は増加するものと思われる.その結果,今後の症例の蓄積によりパネート細胞胃癌の病態,分化形態の解明,さらにはパネート細胞胃癌に対する治療の確立につながることが期待される.
本論文の要旨は,第74回日本消化器外科学会(2019年6月.東京)において報告した.
利益相反:なし
文献
- 1) Heitz PU, Wegmann W. Identification of neoplastic Paneth cells in an adenocarcinoma of the stomach using lysozyme as a marker, and electron microscopy. Virchows Arch A Pathol Anat Histol. 1980;386(1):107–116.
- 2) Shepherd NA, Warren BF, Williams GT, Greenson JK, Lauwers GY, Novelli MR. Morson and Dawson’s Gastrointestinal pathology. 5th ed. Hoboken: Wiley-Blackwell; 2013. 197 p.
- 3) WHO Classification of Tumors Editorial. WHO Classification of Tumours: Digestive System Tumours. 5th ed. Geneva: World Health Organization; 2019. 92 p.
- 4) 日本胃癌学会編.胃癌取扱い規約.第15版.東京:金原出版;2017. p. 28–38.
- 5) 日本胃癌学会編.胃癌治療ガイドライン 医師用 2018年1月改訂.第5版.東京:金原出版;2018. p. 25–31.
- 6) 佐藤 俊朗.腸管上皮幹細胞.生化学.2013;85(9):743–748.
- 7) Sato T, van Es JH, Snippert HJ, Stange DE, Vries RG, van den Born M, et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature. 2011;469:415–418.
- 8) 中村 公則, 菊池 摩仁, 綾部 時芳.抗菌ペプチドαディフェンシンによる腸内細菌叢の制御.腸内細菌学雑誌.2019;33:129–135.
- 9) Hubbard VM, Cadwell K. Viruses, autophagy genes, and Crohn’s disease. Viruses. 2011;3(7):1281–1311.
- 10) 田邊 裕貴, 前本 篤男, 綾部 時芳, 河野 透, 蘆田 知史, 高後 裕.クローン病におけるPaneth細胞由来抗菌ペプチドの産生異常.分子消化器病.2007;4(2):110–115.
- 11) Elmes ME, Jones JG, Stanton MR. Changes in the Paneth cell population of human small intestine assessed by image analysis of the secretory granule area. J Clin Pathol. 1983;36(8):867–872.
- 12) 北洞 哲治.潰瘍性大腸炎における大腸粘膜リゾチーム局在の酵素抗体法的研究.日本消化器病学会雑誌.1980;77(6):898–907.
- 13) 曽我 倫久人, 鈴木 竜一, 米田 勝紀.パネート細胞様変化を伴った前立腺癌の1例.泌尿器科紀要.1995;41:891–894.
- 14) Inada K, Tanaka H, Nakanishi H, Tsukamoto T, Ikehara Y, Tatematsu K, et al. Identification of Paneth cells in pyloric glands associated with gastric and intestinal mixed-type intestinal metaplasia of the human stomach. Virchows Arch. 2001;439(1):14–20.
- 15) 岡島 邦雄, 藤井 康宏, 中川 潤, 曾我部 興一, 竹下 篤範, 寺田 紘一,ほか.Paneth細胞を伴った胃癌(3例).癌の臨床.1973;19(5):507–512.
- 16) 弘野 正司, 山田 吉隆, 松木 啓, 中上 和彦, 折出 光敏, 新本 稔,ほか.所属リンパ節転移巣にもパネート細胞を認めた早期胃癌(mucinous carcinoma,IIc+III,sm)の1例.胃と腸.1982;17(5):567–571.
- 17) 松木 啓.Paneth様腫瘍細胞を伴った胃癌の臨床病理学的,病理組織学的研究,特に腸上皮化生との関連について.広島大学医学雑誌.1984;32:1163–1188.
- 18) 中上 和彦, 松木 啓, 弘野 正司, 新本 稔, 服部 孝雄.腫瘍内Paneth細胞のみられた胃癌の4例.胃と腸.1984;19(8):925–931.
- 19) 吾妻 美子.進行胃癌におけるリゾチーム陽性細胞およびPaneth様細胞.高知県立中央病院医学雑誌.1985;12(1–2):27–41.
- 20) 辻本 洋行, 桑田 克也, 山口 陽弘, 中村 隆一, 馬渕 非砂夫, 九嶋 亮治,ほか.多数の腫瘍性Paneth細胞を認めた大きな胃の腺腫と癌の共存した1例.日本消化器病学会雑誌.1991;88(6):1354–1358.
- 21) 清水 健, 葛谷 嘉久, 畔田 浩一, 田中 守義, 真坂 彰, 毛利 勝昭,ほか.Paneth様腫瘍細胞を伴った早期胃癌の1例.日本消化器内視鏡学会雑誌.2001;58(2):64–67.
- 22) 深沢 智基, 鈴木 潮人, 藤井 秀樹.Paneth様腫瘍細胞をともなった早期胃癌の1例.日本消化器病学会雑誌.2006;103(11):1251–1256.
- 23) Ooi A, Nakanishi I, Itoh T, Ueda H, Mai M. Predominant Paneth cell differentiation in an intestinal type gastric cancer. Pathol Res Pract. 1991;187(2–3):220–225.
- 24) Capella C, Cornaggia M, Usellini L, Bordi C, Bondi A, Cook MG, et al. Neoplastic cells containing lysozyme in gastric carcinomas. Pathology. 1984;16(1):87–92.
- 25) Lev R, DeNucci TD. Neoplastic Paneth cells in the stomach. Report of two cases and review of the literature. Arch Pathol Lab Med. 1989;113(2):129–133.
- 26) Ohtani H, Sasano N. Ultrastructural immunolocalization of lysozyme in Paneth-like cells in undifferentiated (gastric)-type carcinoma of the stomach. Acta Pathol Jpn. 1988;38(7):861–871.
- 27) Kazzaz BA, Eulderink F. Paneth cell-rich carcinoma of the stomach. Histopathology. 1989;15(3):303–305.
- 28) Caruso RA, Famulari C. Neoplastic Paneth cells in adenocarcinoma of the stomach: a case report. Hepatogastroenterology. 1992;39(3):264–266.
- 29) Shi WD, He CN, Zhai JP, Sun JH, Chen C. Paneth cell-rich carcinoma of stomach: report of two cases. Zhonghua Bing Li Xue Za Zhi. 2006;35(2):123–124.
- 30) 八尾 隆史, 大屋 正文, 中村 俊彦, 恒吉 正澄.胃腺腫の悪性化の危険因子.胃と腸.2003;38(10):1367–1375.