2022 Volume 55 Issue 11 Pages 692-700
2022 Volume 55 Issue 11 Pages 692-700
症例は85歳の男性で,腹痛・嘔吐を主訴に前医を受診し,小腸閉塞の診断で保存的加療を行ったが食事摂取で再燃を繰り返したため,精査・加療目的に当院に紹介受診となった.腹部ダイナミックCTにて,空腸に造影効果を伴う壁肥厚とその口側の腸管拡張を認め,空腸腫瘍とそれに伴う腸閉塞と診断した.寛解・増悪を繰り返す腸閉塞を認めており,手術適応と判断し腹腔鏡下小腸部分切除術と所属リンパ節郭清を施行した.術後病理検査にて小腸組織内に膵腺房組織を認め異所性膵が存在し,異所性膵組織の一部と連続性を持って異型細胞を認め異所性膵癌と診断した.根治切除可能であったが,術後2か月で多発肝転移・腹腔内リンパ節再発を認め,S-1内服を継続し現在も外来通院中である.今回,術前診断が困難な小腸異所性膵癌の1例を経験したので報告する.
An 85-year-old man was referred to our hospital due to frequent vomiting and abdominal pain. Abdominal CT revealed a jejunum tumor and small bowel obstruction. Laboratory tests showed elevated CA19-9 of 601.3 U/ml. Conservative treatment failed to improve the symptoms. Laparotomy identified an obstruction of the jejunum about 70 cm distal from Treitz’s ligament. Small bowel partial resection was performed, including the 5-cm tumor and dissected lymph nodes. Pathological examination revealed adenocarcinoma arising from a Heinrich type II aberrant pancreatic tumor in the jejunum. Radical resection was possible; however, two months after surgery, multiple liver metastases and intra-abdominal lymph node recurrence were found. The patient has since been treated with S-1. Aberrant pancreatic cancer in the small intestine is rare and difficult to diagnose preoperatively. We report this case with a review of the literature.
小腸の異所性膵における癌化の報告はまれであり治療方針や手術術式は確立されていない1).今回,我々は腸閉塞を契機に発見された小腸腫瘤に対し腹腔鏡下小腸部分切除術を施行し,術後病理検査にて異所性膵癌と診断した症例を経験したので文献的考察を加え報告する.
患者:85歳,男性
主訴:腹痛,嘔吐
既往歴:高血圧症,高脂血症,糖尿病,前立腺肥大症
家族歴:特記事項なし.
現病歴:2020年10月上旬頃からの腹痛・嘔吐を主訴に前医を受診した.小腸閉塞の診断で入院となり保存的加療で症状の改善を認めたが,経口摂取開始後に症状が再燃したため,精査・加療目的に当院に紹介受診となった.
入院時現症:身長167.8 cm,体重66.9 kg,体温36.3°C,血圧126/60 mmHg,脈拍68 回/分,腹部は平坦・軟,腹部正中に腫瘤を触知した.
入院時検査所見:Hb 10.6 g/dl,CA19-9 601.3 U/mlと軽度貧血があり,腫瘍マーカーは高値であった(Table 1).
| TP | 7.1 g/dl | WBC | 5,400/μl |
| Alb | 3.9 g/dl | RBC | 331×104/μl |
| AMY | 58 U/l | Hb | 10.6 g/dl |
| AST | 30 U/l | Ht | 30.7% |
| ALT | 13 U/l | Plt | 18.1×104/μl |
| LD | 195 U/l | ||
| ALP | 225 U/l | PT-INR | 1.00 |
| γGTP | 46 U/l | APTT | 32.2 sec |
| UN | 11 mg/dl | D-dimer | 1.1 μg/ml |
| Cre | 1.03 mg/dl | ||
| Na | 142 mEq/l | CEA | 2.5 ng/dl |
| K | 4.5 mEq/l | CA19-9 | 601.3 U/ml |
| Cl | 106 mEq/l | ||
| T-Bil | 0.8 mg/dl | ||
| CRP | 0.05 mg/dl |
来院時腹部ダイナミックCT所見:近位小腸に造影効果を伴う壁肥厚と,その口側で腸管拡張を認めた.所属リンパ節の軽度腫大を認めた.肝転移や腹膜播種などの遠隔転移を示唆する所見はなかった(Fig. 1).
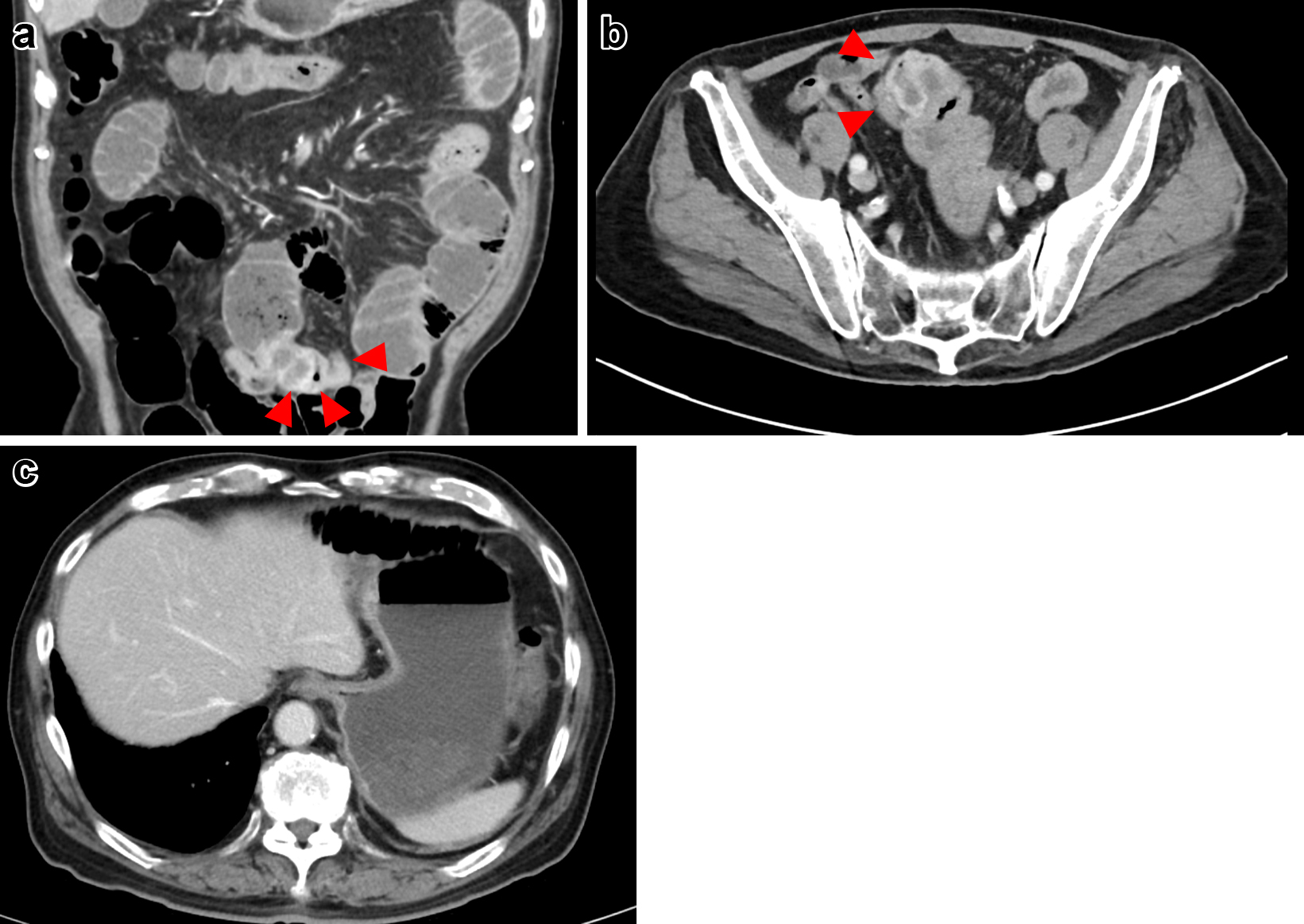
Contrast-enhanced abdominal CT at diagnosis showed a mass of 5.0 cm in diameter in the jejunum (a, b, arrowheads). There was no clear liver metastasis (c).
上部消化管内視鏡検査所見:異常所見を認めなかった.
入院後経過:上記画像所見より,空腸癌,悪性リンパ腫,gastrointestinal stromal tumorを鑑別診断に挙げ,CA19-9の上昇より空腸癌を第一に考えた.寛解・増悪を繰り返す腸閉塞を認めており,手術適応と判断し腹腔鏡下小腸部分切除術を施行した.
手術所見:腹腔鏡下小腸部分切除術および所属リンパ節郭清を施行した.オプティカル法にて臍部に12 mmポート,左上下腹部に5 mmポートを2本挿入した.Treitz靭帯より70 cm肛門側の小腸に約5 cm大の腫瘤を認め,その口側の小腸は軽度拡張していた.リンパ節腫大や肝転移,腹膜播種などの遠隔転移を示唆する所見は認めなかった.周囲辺縁動脈および腫瘤を含めた約25 cmの小腸を切除した.
切除標本肉眼所見:5.2×4.1 cm大の黄白色の腫瘤を認め,腸管内は高度に狭窄していた(Fig. 2).特に黄色成分の強い組織が内腔側に突出していた.
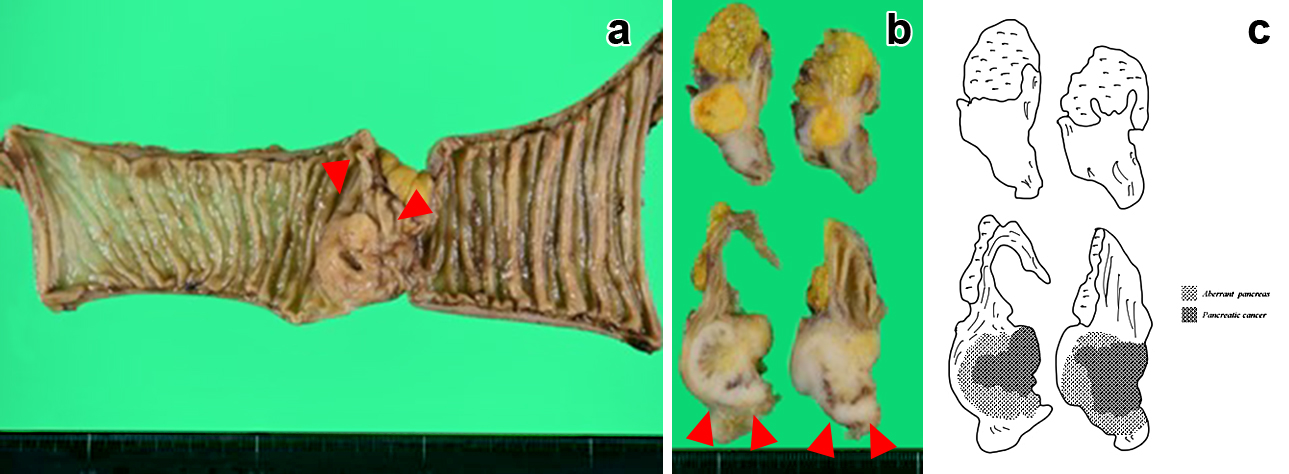
The resected specimen was a yellowish-white tumor of 5.2×4.1 cm in diameter located in the jejunum (a, b, arrowheads). The diagram shows the aberrant pancreatic cancer (c).
病理組織学的検査所見:立方上皮が小型腺管を伴い小葉構造を形成し一部に膵腺房組織を認め異所性膵と考えられた.異所性膵組織の一部と連続性を持った線維性間質に異型高度な腫大核を持った上皮が孤在性や小型胞巣を形成して増生し,漿膜直下にも浸潤していた.腫瘍細胞はCK7,CK19陽性で,胞巣を呈している細胞はp40陽性を示していた.INSM-1は陰性であった.静脈浸潤は明らかでなく,粘膜下層から粘膜固有層にリンパ管浸潤を認めるものの,明らかなリンパ節転移は認めなかった(Fig. 3).

Microscopic findings. Histopathological findings revealed aberrant pancreatic cancer tissue (a, HE stain, ×20). Immunohistochemistry showed expression of CK7 (b, ×20) and CK19 (c, ×20), but no expression of CK20 (d, ×20). Microscopic findings for (e) (HE stain, ×20) and (f) (HE stain, ×40) revealed tubular adenocarcinoma in contact with aberrant pancreatic cancer tissue.
術後経過:経過は良好であり第9病日に退院した.85歳と高齢ではあるがADLは自立しており,膵癌に準じ術後4週間後より補助化学療法としてS-1(80 mg/日,2週投与1週休薬)を開始したが,自己判断でS-1内服を中止していた.術後2か月で食思不振・右上腹部痛の訴えがあり,精査施行したところCA19-9 >12,000 U/mlと著明に上昇しており,造影CTにて多発肝転移と腹腔内リンパ節再発を認めた(Fig. 4).S-1内服を継続し,術後6か月現在も外来通院中である.
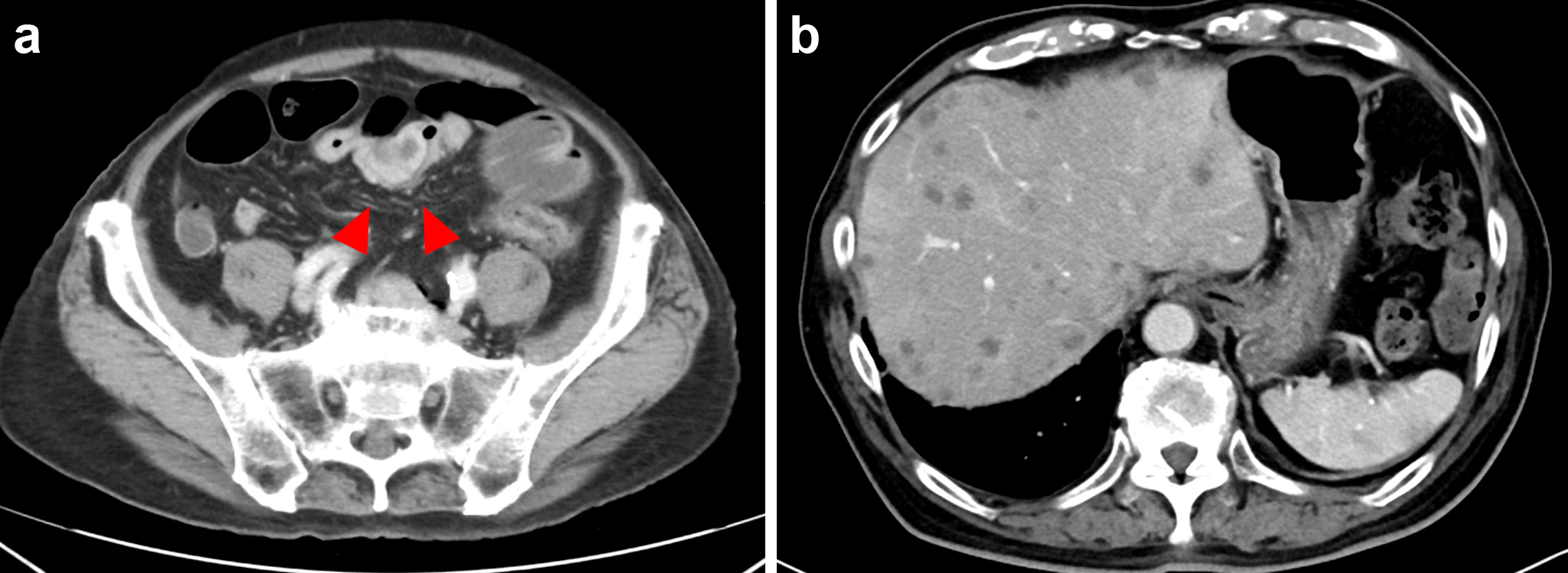
Contrast-enhanced abdominal CT at recurrence showed a mass in the mesentery proper (a, arrowheads) and multiple hepatic metastases (b).
小腸腫瘍は全消化管原発悪性腫瘍の0.3~4.9%を占めるに過ぎないといわれており比較的まれである2).その内訳は平滑筋肉腫,悪性リンパ腫,腺癌,神経内分泌腫瘍の順に多いとされている.本症例では腸閉塞を契機に小腸腫瘍を発見し,術前CA19-9値が高値であったため,空腸癌を第一に疑い腹腔鏡下小腸部分切除術を施行したが,術後病理検査では異所性膵の癌化であった.
異所性膵は本来の膵臓とは解剖学的にも血行的にも離れた部位に膵組織が存在するものと定義され,迷入膵や副膵などとも呼ばれる.異所性膵組織は胎生期における形成異常として,背側膵の一部の残存あるいは両原基の癒合が不完全な場合に両側膵が残存,あるいは迷入して発現すると考えられている.そのため,膵臓に近い胃および十二指腸に多く,次いで空腸・回腸・腸間膜・胆管系(胆囊・胆囊管・総胆管)・脾臓に多いとされる3).他にも,食道,縦隔,肝臓,横行結腸,臍,卵管にも存在が確認され4)5),男女比は2:1で男性に多いと報告され,剖検例における異所性膵の頻度は0.5~13%といわれている.Barbosaら6)の異所性膵471例の報告によると,その発生部位は十二指腸143例(30.3%),胃125例(26.5%),空腸77例(16.3%),回腸27例(5.8%),Meckel憩室25例(5.3%)であった.胃異所性膵の診断は30~50歳代の中年期に多いとされる7).大きさは1~3 cm未満のものが80%を占め,病変の主座は粘膜下層から固有筋層にあるものが多い8).胃異所性膵は胃透視にて胃粘膜下腫瘍の形態をとり管腔内に開口する導管が造影されることがある3).また,上部消化管内視鏡検査にて導管の存在を示す陥凹が認められれば診断的価値が高いとされる9).しかし,術前の確定診断は困難なことが多く,その原因としては異所性膵の局在が粘膜下層・固有筋層を主体とすることに加え,漿膜側へ病変が進展する傾向を示すことから,EUS-FNAなどでの組織採取の難易度が高いためと考えられる10).また,十二指腸異所性膵の診断は60~70歳代の中高年期に多く,また局在部位は下行部,球部,水平部の順に多く,膵臓に近い部位でより多い傾向であった11).胃異所性膵と同様,十二指腸異所性膵でも術前診断は困難なことが多く,特に原発性十二指腸癌との鑑別が重要となる.空腸異所性膵の診断は50~70歳代の中高年期に多く,男女比は11:3とされている.腫瘍局在に関しては,Treitz靭帯からの距離はさまざまであり,明らかな傾向は見られなかった12).回腸異所性膵の診断は小児に多く,発生部位は回腸末端部より100 cmの部位に好発するといわれている13).Meckel憩室は胎生期の卵黄腸管の遺残による先天性小腸憩室で,その発生頻度は約0.6~2.3%と報告されており,男女比は2:1とされる.Meckel憩室に伴う異所性迷入組織は胃粘膜が多いとされているが,異所性膵を伴うこともあり,Meckel憩室に伴う異所性膵は回腸末端から50~80 cmに好発するとされる.多くは無症候性であるが,腸重積や腸閉塞,憩室炎,出血,穿孔などの合併症を伴うことがある14).
異所性膵の組織分類としては,その構成成分から分けたHeinrichの分類が知られており,I型は膵導管,膵腺房細胞,ランゲルハンス島から成り,II型はランゲルハンス島のみを欠き,III型は膵導管組織のみから成るものと分類される15).III型は十二指腸腺,幽門腺,胆管にも類似した組織と捉えることもでき,adenomyomaと呼ばれることがある.また,この組織分類は,Gaspar Fuentesら16)によって後に改訂され膵外分泌組織を持たないランゲルハンス島のみからなるIV型が追記されている16).
異所性膵が悪性転化することは以前から報告があり,異所性組織由来の腫瘍の診断は,異所性組織から癌への移行部を確認することが根拠となることが多い.三林ら17)は,異所性膵の癌化の診断基準として,①癌巣の主座が粘膜下層以下にあり粘膜穿破以外に粘膜と関連を持たないこと,②他からの転移性病変でないこと,③異所性膵組織が癌と共存し癌への移行が認められるか,少なくとも組織像が膵癌に似ていること,と定義されている.本症例ではランゲルハンス島は欠くものの膵腺房組織を有しHeinrich分類のII型と考えられた.また,前述の癌化の診断基準を満たしており,異所性膵癌と診断した.
膵癌に関連する腫瘍マーカーの上昇を認める症例では異所性膵癌も鑑別診断の一つとなると考えられる.異所性膵癌と診断された場合には,平田ら18)は,組織学的特徴から膵癌に準じた治療を行うことを推奨している.根治切除可能であれば手術が第一選択の治療と考えられる.リンパ組織の豊富な粘膜下層を主座とすることが多く,比較的早期にリンパ節転移を来す可能性があり,発生部位に応じた術式,リンパ節郭清が必要と考えられている18).
胃および十二指腸異所性膵やその癌化に関する報告は散見される一方で,小腸における異所性膵癌の発生はまれであり,医学中央雑誌(1964年~2020年)にて「異所性膵(あるいは迷入膵)」,「小腸」,「癌」,PubMed(1950年~2020年)にて「aberrant(or heterotopic or ectopic)pancreas」,「small intestine」,「cancer」をキーワードとして検索した結果,小腸に発生した異所性膵癌の報告(会議録を除く)は,自験例を含めて20例のみであり,これらを総括してTable 2に示した1)12)14)19)~34).小腸異所性膵癌は50~70歳代で多く平均年齢は62歳であり,男女比は2:1と男性に多い傾向であった.無症状で開腹時に偶発的に発見された症例は3例で,17例で腸閉塞に伴う腹痛や嘔吐といった症状を呈していた.小腸異所性膵癌の多くは空腸に存在しており,20例のうち回腸に存在していた3症例はその全てがMeckel憩室に迷入した異所性膵の癌化であった14)26)34).異所性膵およびMeckel憩室はどちらも胎生期に形成されること,単独の回腸異所性膵はその発生頻度が空腸と比較し低いことからは,回腸異所性膵とMeckel憩室が発生の過程で関連している可能性が推察される.組織学的診断では,腺癌が85%と最も頻度が高かった.Heinrich分類ではII型が最も多かった.また,20例のうち自験例を含め3例で腹腔鏡下手術が行われていた.腹腔鏡下手術は術前診断がついていない腫瘍性病変に対しても低侵襲に肉眼的および質的診断が得られる可能性があり,治療の選択肢に含める施設も多いと考えられる.
| No | Author/Year | Age | Sex | Main symptoms | Size (cm)§ | Location (cm)§§ | Type | CA19-9 (U/ml) | Open/Laparoscopic | Cancer histology | N | M | Chemotherapy | Prognosis |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Fujiki19)/1990 | 54 | M | None | 2.3×1.5 | 50 | I | 1,300.0 | Open | Por | + | Liver | MTX/5-FU | Death: 7 months |
| 2 | Sato20)/1993 | 64 | M | Right flank pain | 2.0×1.5 | 110 | I | n.d. | Open | Mod | + | — | Unknown regimen | Recurrence; peritoneal: 3 months |
| 3 | Saegusa21)/1995 | 76 | F | Vomiting | 2.5×2.0 | 40 | I | n.d. | Open | Well | – | — | n.d. | No recurrence: 14 months |
| 4 | Arao22)/1999 | 63 | M | Abdominal pain Constipation Vomiting |
4.0×2.0 | 20 | II | 6,100.0 | Open | Well | + | Liver Peritoneum |
n.d. | n.d. |
| 5 | Uemura23)/2001 | 72 | M | Abdominal pain Vomiting |
3.0×2.0 | 130 | II | 70.0 | Open | Well | + | — | n.d. | No recurrence: 6 months |
| 6 | Matsubara24)/2004 | 79 | M | Vomiting | 2.0×1.0 | 30 | n.d. | n.d. | Open | Well | – | — | None | Recurrence; peritoneal: 6 months Death: 9 months |
| 7 | Sato25)/2007 | 78 | F | Abdominal pain Vomiting |
3.0×2.0 | 50 | II | n.d. | Open | Mod | n.d. | — | n.d. | n.d. |
| 8 | Koh26)/2009 | 50 | M | Bleeding | 2.2 | n.d. | n.d. | n.d. | Open | n.d. | n.d. | Peritoneum Omental deposit |
None | Recurrence; peritoneal: 2 weeks Death: 6 weeks |
| 9 | Ono1)/2010 | 51 | F | Abdominal pain Vomiting |
2.6×2.2 | 170 | III | 72.0 | Open | Well | n.e. | — | UFT GEM |
Recurrence; peritoneal: 7 months Death: 28 months |
| 10 | Nagai27)/2014 | 70 | M | Abdominal pain | 2.5×2.2 | 60 | II | 205.2 | Laparoscopic | Mor | n.e. | Peritoneum | GEM | Death: 4 months |
| 11 | Okada28)/2014 | 71 | M | None | 4.0×3.5 | 7 | I | 657.0 | Open | n.d. | – | — | GEM | Recurrence; Liver: 10 months |
| 12 | Ogawa29)/2015 | 70 | M | None | 4.0×3.5 | n.d. | I | 372.9 | Open | Well | – | — | GEM | Recurrence; Liver: 10 months |
| 13 | Matsuyama30)/2015 | 72 | M | Abdominal pain | 2.5×1.5 | 30 | II | 1,195.0 | Open | Well | + | Ascending colon | None | Death: 25 days |
| 14 | Ito31)/2016 | 66 | F | Vomiting | 2.0×1.5 | 80 | II | 9.6 | Open | Mor | – | — | S-1 | No recurrence: 3 months |
| 15 | Yogi32)/2017 | 82 | M | Vomiting | 3.5×2.5 | 40 | I | 1,634.4 | Laparoscopic | Well | n.d. | — | S-1 | No recurrence: 7 months |
| 16 | Miyazaki12)/2017 | 72 | M | Asitia | 3.0×3.0 | 5 | I | 23.6 | Open | Mor | n.d. | — | S-1 | No recurrence: 24 months |
| 17 | Sakoda14)/2018 | 91 | M | Abdominal pain | 5.5×4.0 | 50 from ileocecal junction | n.d. | 54.1 | Open | Anaplastic carcinoma | – | — | None | Recurrence; pelvic Death: 4 months |
| 18 | Shigemasa33)/2019 | 96 | F | Abdominal pain Vomiting |
2.0×2.0 | 15 | II | 918.5 | Open | Mor | n.d. | — | None | Death: 6 months |
| 19 | Sakurai34)/2019 | 69 | F | Abdominal pain Vomiting |
4.5 | 60 from ileocecal junction | n.d. | 52.4 | Open | Por | – | Peritoneum | GnP | No recurrence: 6 months |
| 20 | Our case | 82 | M | Abdominal pain Vomiting |
5.2×4.1 | 70 | II | 601.3 | Laparoscopic | Well | – | — | None | Recurrence; Liver, Lymph node: 2 months |
§: Tumor size. §§: Distance from left edge of Treitz ligament, excluding cases 17 and 19.
また,手術時にリンパ節転移や遠隔転移を認めたものが8例で,うち1例は術後3か月で再発し,3例は1年以内に死亡している19)20)22)23)26)27)30)34).根治切除できているが術後1年以内に再発所見を認めているものは自験例を含め8例で,そのうち術後1年以内に死亡しているものは4例と,異所性膵癌の予後は不良であり1)14)20)24)26)28)29),膵癌に準じた術後補助化学療法を導入している報告が多い.過去の症例においては,Methotrexate(MTX)/5-FU療法や,gemcitabine(以下,GEMと略記)+テガフール・ウラシルあるいはGEM単剤投与,S-1単剤投与,GnP投与などを施行された報告があるが,依然報告症例が少なく確立された化学療法レジメンは存在しない1)12)19)27)~29)31)32)34).近年では切除膵癌患者のS-1とGEMの術後補助化学療法を比較した無作為化第III相試験(JASPAC-01study)の報告があり,GEM群の2年生存率53%に対してS-1群の2年生存率が70%と有意に良好であったとの結果から異所性膵癌においても術後化学療法としてS-1を選択している症例が多かった35).これまでの症例報告では,S-1開始後は全例無再発で経過しており12)31)32),その有用性が示唆されるが症例数が少なく,かつ観察期間も短いためレジメン選択に関しては今後の症例の蓄積が待たれる.
また,近年のランダム化第III相比較試験の結果から,切除可能性膵癌に対して術前補助療法を導入する施設が増えてきている36).異所性膵癌においても予後延長のための術前補助療法の導入が考慮されるが,そのためには適切な術前診断が不可欠となる.今回文献検索した中で術前に異所性膵癌を疑い手術された症例は2例あり,いずれもMRIとPETを施行されていた.特にMRIでは正常な膵組織や通常の膵癌と同様の所見を示し,また囊胞や膵導管を示唆する所見を認めた場合に異所性膵癌が疑われると報告されており術前診断の一助となると考えられた28)29).術前化学療法を施行する際には術前に病理診断がついていることが必須であることから,画像診断で異所性膵癌を疑う症例では,バルーン内視鏡といった肉眼的評価および質的診断が望まれる.しかし,実際には腸閉塞を契機に診断される症例が多く,切除による診断および治療が主となり,化学療法の導入は術後となる.通常の膵癌術後と違い,小腸異所性膵癌では侵襲の少ない術式で対応可能であるため,化学療法開始時期を逸することなく速やかに導入することが重要であると思われる.異所性膵癌に対する有用な術前診断の開発が望まれるとともに,異所性膵癌と診断された際の治療戦略に関しても,今後検討が必要であると考えられた.
腸閉塞を契機に発見された小腸異所性膵癌に対し腹腔鏡下に切除した1例を経験した.異所性膵癌の術前診断は困難であるが,小腸腫瘍の鑑別診断として考えるべき疾患であると思われた.
利益相反:なし