2024 年 83 巻 4 号 p. 199-207
2024 年 83 巻 4 号 p. 199-207
Background: The relationship between cisplatin and vestibular function still remains controversial. Some clinical and animal studies have reported high-frequency vestibulo-ocular reflex (VOR) impairments induced by cisplatin. The video head impulse test (vHIT) may enable clinicians to detect the effects of cisplatin therapy in the high frequency range of the VOR.
Materials and Methods: The subjects were two males with laryngeal cancer and five females with uterine cervical cancer (mean age: 59.4 years) who received treatment with cisplatin. The vHIT and the subjective visual vertical (SVV) measured by the bucket method were examined before the start of cisplatin and after every cycle (weekly 40 mg/m2 or triweekly 80 mg/m2) of cisplatin-based therapy. Air conduction hearing was also evaluated in the patients with uterine cervical cancer.
Results: The group mean VOR did not differ significantly depending on the cumulative cisplatin dose in the range of 0 to 240 mg/m2. However, five and two patients exhibited an increase and decrease, respectively, of the VOR gain outside the normal range (0.8–1.2). Furthermore, two patients also exhibited covert catch-up saccades. The occurrence of covert saccades was not correlated with the VOR gain, but increased as the cumulative cisplatin dose increased. No significant change in the SVV was observed either during or after the treatment. The hearing levels fluctuated slightly. The ranges of fluctuation at 500 and 1000 Hz were smaller than that at other frequencies.
Conclusion: Cisplatin did not impair the functions of the semicircular canals at moderate doses, on average. However, some patients exhibited decrease and increase of the VOR gain and covert saccades. The increase in VOR gain and covert saccades was possibly associated with slight cisplatin-induced vestibulopathy or endolymphatic hydrops. vHIT is a simple tool to monitor the functions of the semicircular canals during and after cisplatin treatment.
シスプラチン(CDDP)は多くの癌治療に用いられる薬剤であるが,腎臓・内耳・神経などの臓器に障害を生じる。内耳のうち蝸牛への影響は難聴としてあらわれるが,CDDPによる難聴は年齢,用量,投与頻度により増加する1)。とくに,1日投与量が80 mg/m2以上で累積投与量では300 mg/m2を超えると難聴出現の傾向は顕著となるとされる2)。一方,内耳のうち前庭への影響については報告が一定していない。組織学的にはCDDPを高用量で投与後の患者の剖検例で前庭感覚上皮は保たれていたとする一方3)4),動物実験では低用量でも前庭有毛細胞の障害がみられたとの報告もある5)6)。機能的には回転いす検査や温度刺激検査(以下カロリックテスト)で調べた半規管機能について高度障害例の報告もあるが7)~10),投与量に関係なくCDDPによる半規管障害のエビデンスはないとする報告もある11)。
ところが高周波数刺激による報告はカロリックテストのような低周波数刺激の場合と結果が異なる。Kitsigianisらのヒトによる報告では3~5 Hz刺激で前庭動眼反射(vestibulo-ocular reflex: VOR)のゲインの低下をみとめ12)13),Takimotoらもマウスでの実験で2.5 Hz刺激に対するVORの障害を報告している14)。
半規管機能の検査にはカロリックテスト,回転いす検査のほか近年では高解像度カメラを用いたvideo head impulse test(vHIT)も盛んに行われるようになってきた。CDDPによる前庭障害が前述のように主に高周波数域で生じるのであれば,vHITは4~7 Hzの高周波数刺激での検査であり15),CDDPによる半規管障害の有無を調べるには最適と考えられる。近年CDDP治療患者に対するvHITも報告されるようになったがまだかなり少数である16)17)。今回CDDPでの治療を受けている患者に対し投与前・中・後にvHITを行い,VORゲインの低下だけでなく増加やサッケードなど多彩な反応も認めたので報告する。
対象は2018年2月~2020年4月までに京都府立医科大学附属病院耳鼻咽喉科・頭頸部外科および産婦人科にてCDDPを用いた放射線化学療法を行った7名である。なおCDDP以外の影響を避けるため,いずれの患者もめまい疾患の既往,白金製剤の使用歴,腎機能低下などでのCDDP投与量の制限もなく,耳を照射野に含まないものとし,頚椎疾患の既往もあるものも対象外とした。
7名の内訳は喉頭癌症例2名(男性)と子宮頸癌症例5名(女性)で,年齢は41~79歳(平均59.4歳)であった。CDDPの投与は,喉頭癌症例(患者1,2)では3週毎に80 mg/m2を3クール,子宮頸癌症例(患者3~7)は毎週40 mg/m2を5または6クールで投与され,累積投与量は245~384.9 mgであった(表1)。CCDPによる治療に際し投与された他の共通する薬剤は喉頭癌・子宮頸癌症例ともに輸液負荷のほかアプレピタント,パロノセトロン,デキサメタゾンであった。
| 患者 | 年齢 | 性別 | 疾患 | TNM分類 | レジメン | 累積投与量 |
|---|---|---|---|---|---|---|
| 1 | 70 | 男性 | 喉頭癌 | T3N0M0 | 80 mg/m2 × 3 | 380.6 mg |
| 2 | 70 | 男性 | 喉頭癌 | T3N0M0 | 80 mg/m2 × 3 | 384.9 mg |
| 3 | 63 | 女性 | 子宮頸癌 | T2bN1M1 | 40 mg/m2 × 5 | 341 mg |
| 4 | 68 | 女性 | 子宮頸癌 | T2bN0M0 | 40 mg/m2 × 5 | 245 mg |
| 5 | 31 | 女性 | 子宮頸癌 | T2bN1M0 | 40 mg/m2 × 6 | 358 mg |
| 6 | 42 | 女性 | 子宮頸癌 | T2bN1M0 | 40 mg/m2 × 6 | 298 mg |
| 7 | 72 | 女性 | 子宮頸癌 | T2bN1M0 | 40 mg/m2 × 5 | 325 mg |
vHITはEyeSeeCam(ミュンヘン大学,www.eyeseecam.com,サンプリング率:220 Hz)を用いてCDDP投与前,各クール間,総投与終了後に行った。薬剤の影響をみるためであり,患者の負担軽減のためにも3つの半規管(水平・前・後半規管)すべては不要と考え,水平vHITのみ行った。VORゲインはゴーグルのすべりの影響を最小化するため,瞬目・閉眼などノイズのある眼球運動の試行を除去したのち,各試行の頭部運動開始から停止までの眼球・頭部速度のArea Under Curve(AUC)の比を求め,中央値をVORゲインとした18)。回転中にcovert saccade(CS)を含むものは加速度>2000°/s2でde-saccadeと線形内挿し計算した(図1)。VORゲインの正常域は過去のアジア人の報告をもとに0.8~1.2とした19)。以上はMATLAB®(MathWorks社)を用いて解析した。

AUC比による計算.眼球・頭部速度ともに曲線が横軸(時間軸)で交わる点で面積(眼球運動:灰色,頭部運動:黒色)を求める。眼球速度曲線中のCS(矢印)は加速度>2000º/s2でde-saccadeし,一次挿間(点線)で補正される。VORゲイン=AUC(眼球)/AUC(頭部)となる。
さらにCDDPの耳石器機能,蝸牛に対する影響も含め,患者への負担を考慮して前庭誘発筋電図(vestibular evoked myogenic potentials: VEMP)は行わず,バケツ法による自覚的視性垂直位(subjective visual vertical: SVV)の計測20)と子宮頸癌患者のみ気導聴力検査も行った。SVVは時計回りを正として2回以上の平均値をとり,正常値は2.3°以内とした20)。
検討項目として喉頭癌,子宮頸癌症例のCDDP投与前・投与毎のVORゲイン,SVVを比較した。また子宮頸癌症例で気導聴力検査の変動も比較した。さらに個々の症例でVORゲインが正常域を超えて上昇・低下した患者について検討した。最後にCSを認める患者では出現率,VORゲイン,CDDPの累積投与量との関係などについて検討した。
検定は,投与量とVORゲインの関係,聴力変動ではFriedman検定,VORゲインの増減,SVVと投与量の関係ではKruskal-Wallis検定を用い,多重比較はBonferroni法で行った(いずれも有意差はp < 0.05)。
本研究は,本学医学倫理委員会において承認されたものである(ERB-C-1133-1)。ヘルシンキ宣言ならびに文部科学省・厚生労働省が定める「人を対象とする医学系研究に関する倫理指針」などの倫理指針を遵守し行った。患者へは研究の目的,方法,結果の取り扱い,坂への拒否などについて説明を行い,文書による承諾を得た。利益相反に該当する事項はない。
図2に喉頭癌症例,子宮頸癌症例の蓄積投与量毎のVORゲインの平均の推移を示す。喉頭癌症例は投与前(0),80,160,240 mg/m2投与後×2方向(左右)でのFriedman検定で差はなかった。子宮頸癌症例のうち患者4,5の投与前データは瞬目・キャリブレーション不良により解析から除外し,患者6の3回目投与後(120 mg/m2)は熱発のためvHITが行えず,患者5,6以外は6回目(240 mg/m2)の投与がなく欠損値となるため,40,80,160,200 mg/m2投与後×2方向(左右)でFriedman検定を行ったが差はなかった。

喉頭癌と子宮頸癌は1回あたりの投与量が異なるため別々に示す。喉頭癌症例( ),子宮頸癌症例(
),子宮頸癌症例( )ともに各投与量間での有意差はない。エラーバー:SD
)ともに各投与量間での有意差はない。エラーバー:SD
結果1では全体としてVORゲインはCDDP投与前・中・後に差はないが正常域(0.8~1.2)から逸脱して増減を示す患者もあった。治療の経過中に7名中5名(71%)でVORゲインが1.2を超え,2名(29%)で0.80以下となった。VORゲインの増減のあった患者のCDDP累積投与量を表2に示す。さらにVORゲインの正常・増加・低下での累積投与量についてKruskal-Wallis検定と多重比較を行うと,VORゲイン増加例は低下例との差はないが正常ゲイン例より有意に投与量が多かった(p < 0.05)。
| 患者 | レジメン | VORゲイン増加 | VORゲイン低下 | CS出現 |
|---|---|---|---|---|
| 1 | 80 × 3 | 右0,160 | ||
| 左0,80,160 | ||||
| 2 | 80 × 3 | 右160 | 右80 | |
| 左160 | 左80 | |||
| 4 | 40 × 6 | 右200 | ||
| 5 | 40 × 6 | 右200 | ||
| 6 | 40 × 6 | 右160,200,240 | 右240 | |
| 左160,200 | 左160,240 | |||
| 7 | 40 × 5 | 右120 | 右40,80,160,200 | |
| 左120 | 左80,160,200 |
単位:mg/m2
患者4の右側へのvHITでは40 mg/m2投与後と異なり,200 mg/m2終了後では明らかに眼球速度が頭部速度より小さい(図3a,b)。VORゲインの推移も40~160 mg/m2投与後までは正常域だが,200 mg/m2終了後の値は0.75と下限値を下回り(図3c),左側でも0.80と正常域下限値であった。一方VORゲインの上昇は患者1の投与前,患者2は投与終了後にみられ,患者5~7では投与経過中・投与後など上昇は患者によりばらつきがあった(表2)。代表例として図3中段に患者6の右側へのvHITを示すが,投与前と200 mg/m2投与後を比較すると眼球速度は頭部速度より大きく(図3d,e),VORゲインの推移も投与に従い上昇し,200 mg/m2投与後が最大で1.49(図3f),対側の左側でも同投与量後で1.36であった。

上段:VORゲイン低下例(患者4,右).40 mg/m2投与後(a)では,頭部速度と眼球速度はほぼ同じだが,200 mg/m2投与後(b)眼球速度が頭部速度より低下している.VORゲインの推移(c):200 mg/m2以上投与後で正常域下限より低下.
中段:VORゲイン上昇例(患者6,右).投与前(d)では,頭部速度と眼球速度はほぼ同じだが,200 mg/m2投与後(e)眼球速度が頭部速度より上昇している.VORゲインの推移(f):160 mg/m2以上の投与後で正常域上限より上昇.
下段:CS出現例(患者7,左).投与前(g)では,CSは見られないが,200 mg/m2投与後(h)はCSを認める(矢印).VORゲインの推移(i):80 mg/m2以外は正常範囲内である.
黒線:眼球運動(反転),灰色線:頭部運動,○:VORゲイン,点線:VORゲイン正常域(0.8~1.2)
頭部回転後のovert saccade(OS)は振幅の小さなものは生理的なものと区別がつかないので,頭部回転中にみられるCSのみ検討した。患者1,2,4,5ではCDDP投与前・中・後を通じてCSは0~1試行のみで,患者3は投与前のみであった。したがって治療後に生じた患者6,7で検討した。患者7の左へのvHITを図3d–fに示す。CDDPの投与前はCSを認めないが,投与終了後では76.9%の試行でCSを認めた(図3h,i)。VORゲインは概ね正常域である(図3j)。VORゲインとCS出現率の関係は,患者6は相関係数0.10(p = 0.75),患者7は0.19(p = 0.56)で,いずれも有意な相関はないが(図4a),累積投与量とCS出現率は患者6で相関係数0.65(p < 0.05)で有意な相関,患者7は0.57(p = 0.05)であり,有意ではないが累積投与量(投与回数)とともに増加する傾向にあった(図4b)。

a.VORゲインとCS出現率.患者6(○),患者7(×)ともに有意な相関はない。B.CDDP累積投与量とCS出現率.患者6(○)は相関係数0.65(p < 0.05)で有意な相関,患者7(×)は0.57(p = 0.05)であり,有意ではないが累積投与量(投与回数)とともに増加する傾向にある。
図5に喉頭癌・子宮頸癌の治療投与量に共通し欠損値がない投与前(0),80,160 mg/m2と投与終了後(200もしくは240 mg/m2)のSVVの推移を示す。SVVの角度は投与量により有意差は認めなかった。2.3°を超えるSVVを認めたのは患者3の40,120 mg/m2投与後のみであった。

欠損値を省き,投与前(0),80,160 mg/m2,終了後(200–240 mg/m2)の比較。有意な変化はなかった。エラーバー:SD
子宮頸癌症例のみ施行した。図6に示すVORゲイン減少・減少,CS陽性例のvHITと同側の聴力図を示す。3例ともに低音域を中心に変動がみられる。加齢により投与前から感音難聴をきたしている症例もあるため,各周波数でCDDPの各投与量後の閾値と投与前の閾値の差(⊿閾値)の最大値―最小値(変動幅)を比較した。500–1000 Hzでの変動幅が小さい,即ち低音域の125–250 Hzと2000 Hz以上で変動幅が大きい傾向にあった。Friedman検定で有意差を示したが(p < 0.01),多重比較では周波数による変動幅の差はなかった(図7)。
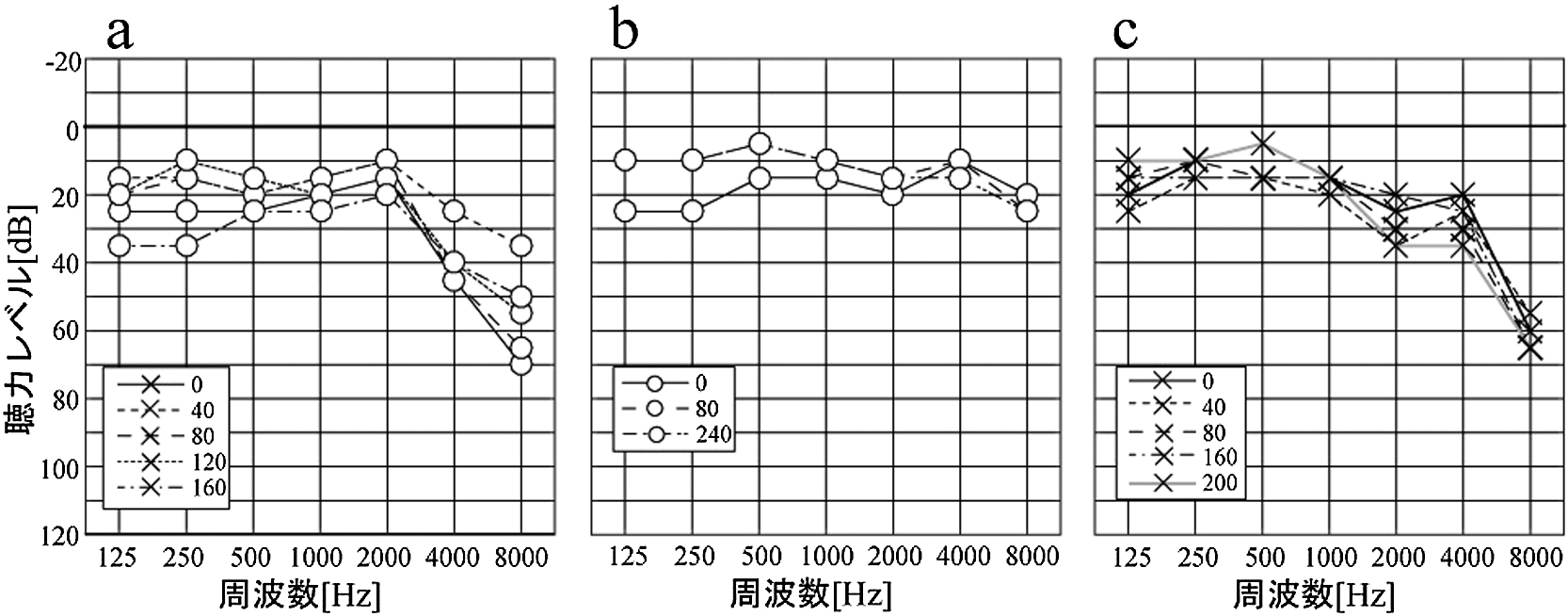
図2で示した同患者およびvHITと同側の聴力像の推移を示す。a.VORゲイン低下例(患者4右).b.VORゲイン上昇例(患者6,右).c.CS出現例(患者7,左).
投与量0 mg/m2(投与前): ,40 mg/m2:
,40 mg/m2: ,80 mg/m2:
,80 mg/m2: ,120 mg/m2:
,120 mg/m2: ,160 mg/m2:
,160 mg/m2: ,200 mg/m2:
,200 mg/m2: ,240 mg/m2:
,240 mg/m2:

各周波数における聴力閾値を投与前の閾値から引いた差(⊿閾値)の変動幅(最大⊿閾値-最小⊿閾値)で求め比較。黒棒グラフ:平均変動幅,エラーバー:SD。低音域(125・250 Hz),2000 Hz以上は500・1000 Hzより変動幅が大きい。
CDDPの聴器毒性については多くの研究・報告がなされており,年齢,累積投与量,遺伝的な脆弱性に依存する21)22)。CDDPによる障害メカニズムについて,蝸牛ではCDDPがNAPDH Oxidase 3(NOX-3)などの酵素を活性化して活性酸素種を過剰産生し,抗酸化物質を枯渇させ,炎症経路とアポトーシスを誘導し障害が生じる23)。前庭器についても少数ではあるが障害メカニズムについて報告されている。Chengらはモルモットの実験で,CDDP投与による膨大部組織内のNa+,K+-ATPaseとCa2+-ATPase活性の減少とカロリックテストの緩徐相速度の減少がよく相関し,酸化ストレスを示唆するlipid peroxidase,nitric oxide(NO)が膨大部組織内で上昇したと報告している24)。免疫染色でもCDDP投与後に前庭の血管壁及び前庭神経節細胞でNO合成酵素のアイソザイムの一つであるinducible nitric oxide synthase(iNOS)の存在も報告されている25)。CDDPによるアポトーシスについては,アポトーシス時に活性化されるcaspase-activated deoxyribonuclease(CAD)やcaspase 3が前庭感覚上皮,移行上皮,暗細胞で検出されており26),アポトーシスの存在を示す単鎖DNA(single-stranded DNA: ssDNA)も前庭感覚上皮,移行上皮,暗細胞,神経節細胞で検出されている27)。そのほか癌抑制タンパクp53が前庭や蝸牛でもCDDPによるアポトーシスに重要な役割を果たしていると示唆する報告もある28)。
CDDPの前庭機能に対する影響については多数の報告があるが,測定する方法により結果が異なる。カロリックテストや回転いす検査を用いたものとしては,Schaeferらは少量・中程度量(平均487 mg)の投与後24例中1例のみカロリックテストが無反応29),Hartwigらも130~590 mg/m2の投与量でカロリックテストおよび回転いす検査での反応低下は74例中3例(4.1%)で9),両報告ともかなり少ない。さらに,Myersらはカロリックテストや低周波数刺激(0.01~0.16 Hz)の回転検査で120~1600 mgのCDDPによる前庭障害はなかったとしている11)。しかし高い率での前庭障害を示す報告もある。Blackらは31%(5/16例)の反応低下8),Kobayashiらも80~550 mgの投与量で50%(5/10例)のカロリックテスト異常例を報告している10)。一方高周波数刺激で行ったものでは結果が異なる。Kitsigianisらは327–933 mgの投与量下の症例において3~5 Hzの回転刺激でVORゲインの低下を示している12)13)。
CDDPによる影響は半規管だけでなく耳石器に対しても調べる必要がある。HülseらはCDDP投与の患者にvHITとVEMPを行い,VORゲイン低下とc-VEMP,o-VEMP双方の無反応を報告している17)。我々は患者の負担を考慮しVEMPは行わず,バケツ法によるSVVの測定を行った。SVVは急性の一側前庭障害とくに耳石器障害で異常を示す。CDDP投与前後・経過中も有意な角度の増大はなかった。CDDPによる薬剤性障害があるとすれば一側ではなく両側と予想されるのでSVVで異常が検出されにくい可能性はあるが,本研究ではvHITもCDDP投与終了後で平均してVORゲインの低下がないため耳石器についても障害がなかったと考える。
近年,少数ではあるがCDDP投与患者に対するvHITも報告されている。Prayuenyongらは治療後の症例(平均203 mg/m2投与)に対するvHITでVORゲインは正常でサッケードもなかったとしている16)。Hülseらは,本研究より長い期間の治療前,治療後6週後,3か月後にvHITを行い,6週後にVORゲインが投与前より有意に低下したが,3か月後は若干上昇し有意差が消失したとしている17)。しかし彼らの報告ではVORゲインが投与前の1.01から投与6週後に0.87までの低下であり本研究の基準にてらせば正常域内の変化である。サッケードも6週後に41例中23例でみとめ,このうち16例がCSとOSの混在,7例がOSのみ,3例がCSのみであった。本研究では2例でVORゲインの低下を示した。患者4のVORゲイン低下は投与終了後のみでありCDDP累積による前庭障害に一致すると思われるが,患者2は80 mg/m2のときのみであり,有毛細胞の障害とは異なる機序でのVORゲイン低下の可能性もある。
本研究ではVORゲインの低下だけでなく5例で上昇を認める。さらに患者6,7ではVORゲインとは相関なく,累積投与量(投与回数)の増加とともにCSを認めた(図4)。このようなVORゲインの上昇や正常ゲインにもかかわらずサッケードがみられる現象はメニエール病患者でのvHITで報告されている30)31)。CDDPによる内リンパ水腫形成について動物実験でいくつか報告がある。de Grootら,Cardinaalらはモルモットに対して高用量(計16 mg/kg)の投与後の蝸牛において内リンパ水腫の形成を報告している32)33)。また,Breglioらもマウスでの実験で注射後60日後でも血管条にCDDPの蓄積があり,CDDP治療後のヒトの死後検体でも血管条に蓄積を報告しており34),CDDPが有毛細胞だけでなく内リンパになんらかの影響を与える可能性も否定できない。本研究の子宮頸癌患者5例の気導聴力検査では,低音域(125–250 Hz)は中音域(500–1000 Hz)より変動幅が大きく,CDDPによる内リンパ水腫形成の可能性も否定はできない。また,8000 Hzでの変動幅は周波数の中でも最も大きくCDDPによる蝸牛障害の可能性を考える。
内リンパ水腫以外でも正常ゲインでのサッケード陽性の報告もある。KabayaらはMeniere病以外の前庭疾患でも正常ゲインでサッケード陽性を報告しており,軽度の前庭障害の存在の可能性を示唆している35)。またFujiwaraらは嚢状の内耳奇形でのサッケード陽性例を報告しており,膨大部での構造上の場合もある36)。本研究でみられたVORゲインの増加やCSの出現は膨大部でのクプラの過剰偏位がCDDPによる何らかの機序で生じた可能性もある。しかしCDDPによるクプラの短縮や半規管における内リンパ腔の拡大などの構造変化などの報告はない。
CDDPによる治療はそれ以外の薬剤も投与されている。一般にCDDPによる腎毒性の予防に投与前に静脈内投与で輸液負荷が行われる1)。輸液負荷は容易に脳脊髄液を通して外リンパに影響を与える。動物実験では脳脊髄液の加圧にて内・外リンパ圧ともに上昇したとの報告もある37)。本研究の患者1はCDDPの投与前からVORゲインの上昇があり,輸液負荷のみでも内耳に影響がある可能性はある。また,CDDPの嘔気を抑えるために制吐剤適正使用ガイドラインにより,NK1受容体拮抗薬,5-HT3受容体拮抗薬,デキサメタゾンの3剤併用が行われる38)。本研究でも喉頭癌・子宮頸癌症例ともアプレピタント(NK1受容体拮抗薬),パロノセトロン(5-HT3受容体拮抗薬),デキサメタゾンが投与されているが,いずれもVORに及ぼす影響について報告はない。以上よりCDDPを用いた治療でVORゲインの変動やCSが生じた機序は不明のままだが今後の研究が待たれる。
本研究は残念ながらサンプル数が少ない欠点がある。CDDPはその副作用のため投与量を減量するようレジメンが従来から改良されてきているほか,より内耳に対し副作用の少ないカルボプラチン,ネダプラチンなどの白金製剤も存在する39)。さらに近年分子標的薬,免疫チェックポイント阻害薬による治療も行われており40),CDDPの使用自体が以前より減っている。本学でもレジメンの変更でCDDP使用症例が減ったことと耳を照射野に含まないよう厳しい選別基準にしたこともあり対象がかなり絞られた。また患者の状態により急遽CDDPの治療自体が中止されたり,CDDPの副作用によりデータがとれない日もある患者もあった。第二に本研究のCDDPの投与量は過去の報告と比べても少なく障害が生じなかった可能性もある。最後にVORゲインの上昇例もあることから,仮にVORゲインの低下があったとしても相殺されて正常域になった可能性も否定できない。
・CDDPの投与患者に対しvHITを行った。
・中等度量(200–240 mg/m2)のCDDP投与ではVORゲインは平均して投与後も正常範囲であった。
・VORゲイン上昇・低下,CSを生じた患者もあった。これらの機序としてCDDPによる内リンパ水腫の形成,軽度の前庭障害,輸液負荷の影響などが考えられるが現時点では不明である。
京都府立医科大学産婦人科学教室 黒星晴夫先生をはじめとする教室員の皆さまに感謝申し上げます。
利益相反に該当する事項はない。