2019 Volume 40 Issue 1 Pages 30-35
2019 Volume 40 Issue 1 Pages 30-35
従来,歯科医療における光線力学的療法といえば,歯周ポケットやインプラント周囲溝の中の細菌に対する抗菌療法に用いられてきた.しかし我々は宿主細胞の活性化という観点から,発光ダイオード(Light Emitting Diode: LED)を用いて硬組織再生治療に応用できないか模索している.本稿では,我々が報告した硬組織再生治療に向けてのバイオロジーについて紹介する.
東日本大震災の影響もあり,全世界的に太陽光発電などの再生可能なエネルギーの話題は事欠かない.それは医療界でも同様で,医療界では光エネルギーを用いた光線力学的療法(Photo-dynamic Therapy: PDT)の臨床応用は様々な分野で席巻している.PDTは1900年にRaabらがアクリジン色素と光の併用により,ゾウリムシに致死作用が生じることを示したことで始まり,その後抗菌薬の開発に押され目立たない存在となった.しかし1924年にPolicardらがポルフィリンという光感受性物質が特異的に腫瘍組織に集積し蛍光を発することが示されてから癌治療への応用として発展し1),口腔外科分野でも同じような原理での臨床応用が始まろうとしている2).歯周病学分野においては,日本歯周病学会のご尽力でEr;YAGレーザーが歯肉剥離掻爬術の際の歯根面に対するデバイスとして保険適用されているが,本格的なPDTとは少し一線を画している.
Er;YAGレーザーは現在臨床家の先生方に広く使用されているが,価格が高く医療デバイスとしては非常に大きく汎用性に欠く面は否めない.最近では,発光ダイオードLight Emitting Diode(LED)が歯周病原細菌に対する抗菌的光線療法の一デバイスとして商品化され本邦においても様々な形で臨床研究が進められている3).その原理は元来のPDTと似ていて,光感受性物質にLEDを照射することで,嫌気状態にある歯周ポケット内に活性酸素が発生し歯周病の初発病因である嫌気性の歯周病原細菌が減少することは様々な研究報告でなされている.ただ医科分野では標的対象が腫瘍細胞であったのに対し,宿主組織に影響を及ぼす歯周病原細菌ということになる.また,光感受性物質が必要でその安全性評価は完全ではないのが現状で,今後更なる検証が必要である.
近年,LEDを用いたPDTによる再生医療への応用が検討されている4).これは再生の3要素の一つである宿主の活性化として「光」が注目されているわけである.我々も,従来より光感受性物質を必要としないLEDの使用方法を模索して,ヒト歯根膜幹細胞に対し高出力赤色LEDを適切な照射条件の下で照射することで硬組織分化を促進することを報告している5).現在,本邦において,歯周組織再生療法としてGTR法,エナメルマトリックスタンパクや塩基性線維芽細胞増殖因子を用いて行うのが主流であるが,再生に必要な三因子の一つである宿主細胞の活性化に医療デバイスであるLEDを使用できないかと考えている.また,骨髄間葉系細胞や骨芽細胞にLEDを照射し硬組織分化を促進することも確認できており,歯周組織再生治療やインプラント埋入手術の際に用いる自家骨移植の補助的ツールとしての活用方法が考えられる.
間葉系幹細胞の一つであるヒト歯根膜幹細胞は高い増殖能と骨芽細胞分化能を持っており,歯周組織再生において重要な働きをすることが分かっている.これまでヒト歯根膜幹細胞の増殖や硬組織分化能に対するLED照射の影響に関する報告がほとんどない.我々はLED照射を歯周組織再生に応用できないかと考え,LED照射のヒト歯根膜幹細胞の増殖能や硬組織分化能に対する影響を検討した.
ヒト歯根膜幹細胞に対する赤色LED照射による影響についての報告は少ないが,照射した赤色光はミトコンドリアの酵素であるシトクロムCを活性化するといわれている6).これは酵素をもう一度呼吸鎖活性を再開させることができ,ATP合成をもたらす7).したがって歯根膜幹細胞内のATP濃度が増加することにより,細胞内シグナル発現を誘導し増殖能を増強すると考えられる.我々は,赤色LED照射によってヒト歯根膜幹細胞の細胞増殖およびATPレベルを促進させることを報告した(Fig.1).そして8 J/cm2のエネルギー量の照射によって最も細胞増殖を促進させ,至適エネルギー量が存在することが示唆されたわけである.Phototherapyの分野において,抗菌療法でも同様であったが,再生治療においてもパワーやエネルギー密度,波長など様々な要因があり,特定の組織ごと,また使用法に応じて最適な照射パラメーターを見つけることが重要である8-10).

Effects of LED irradiation on PDLSC proliferation and ATP levels. Effects of energy density of 0 to 10 J/cm2 on PDLSC proliferation cultured for 3 hours (A), 24 hours (B), and 72 hours (C). ATP levels after culture for 3 hours (D), 24 hours (E), and 72 hours (F). PDLSC proliferation and ATP levels were significantly elevated following 8 J/cm2 LED irradiation.
RLU = Relative Light Units. *P < 0.05 versus control.
(Figures from Yamauchi et al., High-power, red-light-emitting diode irradiation enhances proliferation, osteogenic differentiation, and mineralization of human periodontal ligament stem cells via ERK signaling pathway. J Periodontol 89: 351-360, 2018. ©Copyright (2018) American Academy of Periodontology. DOI: 10.1002/JPER.17-0365.)
LED照射の分化に対する影響については議論が続いており,これまで様々な分化マーカーや波長が使用され,そして異なる時間で評価されている.我々は,赤色LED照射によって硬組織分化誘導後のヒト歯根膜幹細胞のALP活性,Procollagen Type I C-peptide(PIP)およびオステオカルシン(OCN)産生を促進させ,細胞外カルシウム沈着およびAlizarin red染色の強度を増大させることがわかり,ヒト歯根膜幹細胞の硬組織分化が増大されることを示した(Fig.2).また転写因子であるRunx2やOsterixについてもmRNA発現がLED照射により促進された.Turrioniらは硬組織分化誘導を行った後に乳歯より分離したヒト幹細胞に対し850 nmのLED照射を行うことによりALP活性やコラーゲン合成が有意に増大したと報告している11).間葉系幹細胞は多能性であり多様な系統に分化できる12)が,分化誘導がなければ自発的に分化はできない.Pengらによると赤色光のみでは骨分化を制御するシグナル経路を活性化できないが,分化誘導によりシグナル経路がすでに活性化されていれば,赤色光は骨分化を増加させる13).すなわち赤色光は骨分化のみを誘導できないが,骨分化を増大させる補助的な役割をする.過去の報告でも分化誘導をかけなかったものはLED照射の有無による分化能に有意差はなかった14).我々も分化誘導開始の重要性を考え,誘導後のLED照射により硬組織分化は増大されたと考えられる.

Effects of LED irradiation (dose, 8 J/cm2) on osteogenic differentiation and mineralization. (A) Alkaline phosphatase (ALP) activity was significantly enhanced after 3, 7 and 14 days of irradiation. (B) Osteocalcin (OCN) production were significantly increased at 7 and 14 days. (C) Procollagen type 1 C-peptide (PIP) production were significantly increased at 7 and 14 days. (D) Calcium deposition significantly increased after irradiation for 21 days. (E) The intensity of formed calcified nodules was determined with Alizarin red staining. Irradiation for 21 days led to increased nodule formation. (F) Gene expression of Runx2 mRNA after 3, 7 and 14 days of irradiation, as determined using quantitative real-time PCR. Runx2 mRNA expression was significantly enhanced at 3, 7 and 14 days. (G) Gene expression of Osterix mRNA after 3, 7 and 14 days of irradiation, as determined using quantitative real-time PCR. Osterix mRNA expression was significantly increased after 3 days of irradiation, but decreased significantly by day 14, as compared with untreated control. *P < 0.05 versus Control; scale bar = 300 μm.
(Figures from Yamauchi et al., High-power, red-light-emitting diode irradiation enhances proliferation, osteogenic differentiation, and mineralization of human periodontal ligament stem cells via ERK signaling pathway. J Periodontol 89: 351-360, 2018. ©Copyright (2018) American Academy of Periodontology. DOI: 10.1002/JPER.17-0365.)
我々はシグナル伝達経路への影響についても検討し,ヒト歯根膜幹細胞の細胞増殖および硬組織分化誘導ともに,赤色LED照射によりERK1/2発現が増強されたことを報告している5)(Fig.3).そしてERK1/2阻害剤であるPD98059を用いることでLED誘導されたヒト歯根膜幹細胞の増殖能および硬組織分化誘導能を抑えることがわかった(Fig.4, 5).つまり赤色LED照射は,ERK1/2を介して細胞増殖能および硬組織分化誘導能を促進することを示唆している.
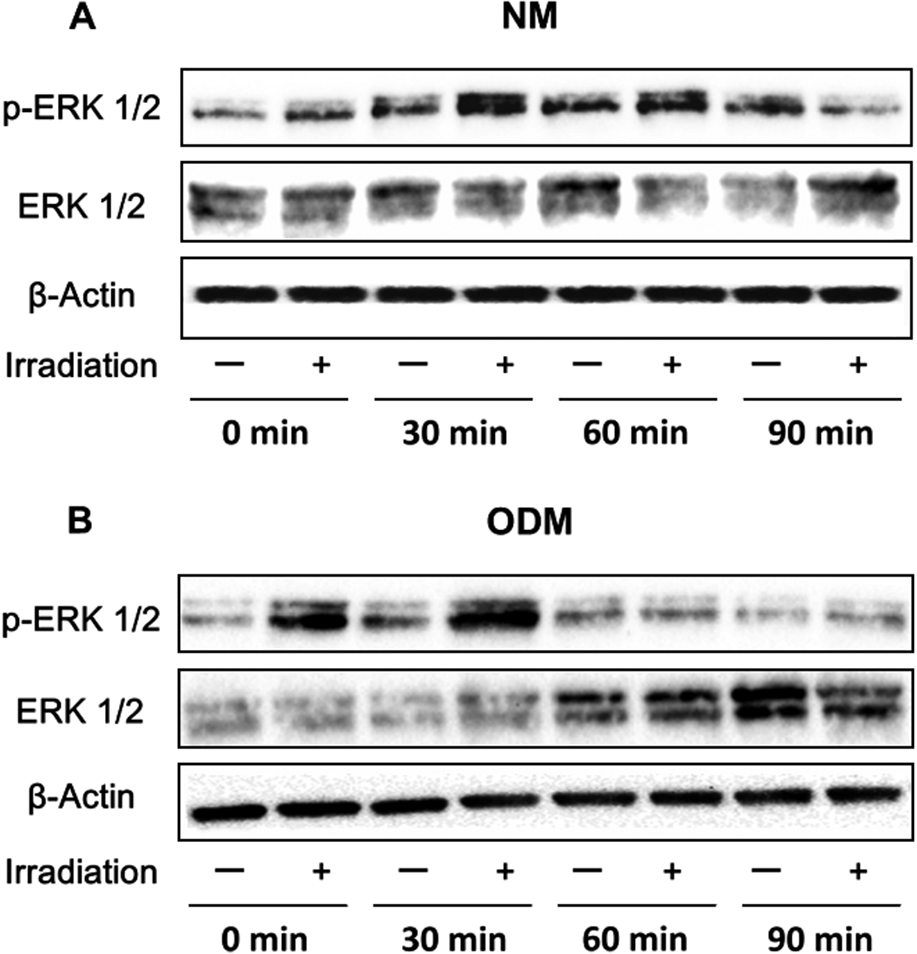
Effects of LED irradiation on the ERK1/2 pathway in PDLSCs treated for 0, 30, 60 and 90 min. (A) In normal medium (NM), phosphorylated ERK1/2 was upregulated after 30 min of irradiation. (B) In osteogenic differentiation medium (ODM), protein expression of phosphorylated ERK1/2 was upregulated at 0 min and 30 min. P = phosphorylated.
(Figures from Yamauchi et al., High-power, red-light-emitting diode irradiation enhances proliferation, osteogenic differentiation, and mineralization of human periodontal ligament stem cells via ERK signaling pathway. J Periodontol 89: 351-360, 2018. ©Copyright (2018) American Academy of Periodontology. DOI: 10.1002/JPER.17-0365.)

Effects of PD98059 (ERK1/2 inhibitor) on LED-induced PDLSC proliferation and ATP levels. Treatment with PD98059 (PD) prevented the LED-induced PDLSC proliferation (A) and ATP levels (B) at 3, 24, and 72 hours. *P < 0.05, Control versus Irradiation (8 J/cm2); †P < 0.05, Irradiation (8 J/cm2) versus Irradiation+PD98059.
(Figures from Yamauchi et al., High-power, red-light-emitting diode irradiation enhances proliferation, osteogenic differentiation, and mineralization of human periodontal ligament stem cells via ERK signaling pathway. J Periodontol 89: 351-360, 2018. ©Copyright (2018) American Academy of Periodontology. DOI: 10.1002/JPER.17-0365.)

Effects of PD98059 (ERK1/2 inhibitor) on LED-induced osteogenic differentiation and mineralization. Irradiated PDLSCs cultured in osteogenic medium in the presence of PD98059 (PD) showed a decrease in alkaline phosphatase (ALP) activity at 14 days (A), osteocalcin (OCN) (B) and procollagen type 1 C-peptide (PIP) (C) production at 14 days, mineralization at 21 days (D and E), and Runx2 and Osterix mRNA expression at 3 days (F). *P < 0.05, Control versus Irradiation (8 J/cm2); †P < 0.05, Irradiation (8 J/cm2) versus Irradiation+PD98059; PD = PD98059; scale bar = 300 μm.
(Figures from Yamauchi et al., High-power, red-light-emitting diode irradiation enhances proliferation, osteogenic differentiation, and mineralization of human periodontal ligament stem cells via ERK signaling pathway. J Periodontol 89: 351-360, 2018. ©Copyright (2018) American Academy of Periodontology. DOI: 10.1002/JPER.17-0365.)
歯周組織再生に必要不可欠である歯根膜幹細胞は,LED照射によってERK 1/2経路を介して増殖および硬組織分化を助長することが示唆された.現在,実際の歯科臨床においてGTR法,エナメルマトリックスタンパクや塩基性線維芽細胞増殖因子が用いられているが,宿主細胞の活性化という観点での医療デバイスも併用できるのではないかと考えられ,歯周組織再生をより促進させる補助的な新たなツールの一つとしてLEDという光源を利用できる可能性を探求したいと考えている.
近年ではLEDが骨芽細胞の細胞増殖を促進させること,骨髄間葉系細胞の骨芽細胞分化を促進させ,その作用機序としてMitogen-activated Protein Kinase(MAPK)経路が関与することが明らかになっている15).またラットを用いた動物実験においてもLEDが新生骨形成を促進することが報告されている16).これらの実験結果はLEDによる骨再生が可能であることを示唆しており,歯科領域における顎骨再生への応用も期待できるのではないかと考えられている.
しかし,これまでの過去の研究で検討されたLEDはいずれも低出力であり,照射エネルギー量を確保するために5分~数十分の照射時間が必要であると報告されており,この長時間の照射時間が必要になることは実際の臨床において大きなデメリットになると考えられる.すなわち,チェアーサイドでのより短い照射時間で新生骨形成が可能になる新しいLEDの開発が期待されている.
そこで,我々はより短時間で照射エネルギー量を得ることができる高出力赤色LEDを用いて骨形成に重要な役割を担うヒト骨髄間葉系幹細胞(BMSCs)に対する細胞増殖と硬組織分化能への効果を検討した.
BMSCsは中心波長650 nmの高出力の赤色LEDを用いて,照射時間を変えることでエネルギー量を調節(0, 2, 4, 6, 8 J/cm2)し照射した.その結果,LED照射群で細胞増殖が有意に促進され,6 J/cm2の照射で最も有意に促進された.また硬組織分化能も細胞増殖の結果と同様にLED照射群で硬組織分化能を示すALP活性や石灰化物形成が有意に促進され,6 J/cm2の照射で最も有意に促進された.したがって,高出力赤色LEDはヒト歯根膜幹細胞同様,骨髄間葉系細胞の細胞増殖と硬組織分化を促進することによって新生骨形成を促すことが示唆された.これらの実験結果は高出力赤色LEDが顎骨再生の新たな医療デバイスとしての可能性を示している.さらに,歯周治療の領域やインプラント周囲骨増生だけでなく口腔外科領域における顎骨再建にも有効なツールになる可能性が示唆される.
しかし,我々が用いた高出力赤色LEDは照射エネルギー量依存的に細胞毒性が認められるという結果も得ており,照射エネルギー量の検討や様々な処置における至適条件について,今後の臨床応用へ向けた課題であると考えられる.
利益相反なし.