2020 Volume 40 Issue 4 Pages 301-308
2020 Volume 40 Issue 4 Pages 301-308
本研究では,新規レーザー治療装置に対する迅速かつ低コストな評価手法として,レーザー治療における計算機臨床試験を提案する.レーザー光照射により生じる生体組織内の光熱伝搬とそれに伴う熱損傷過程をモデル化し,レーザー治療における安全性を数値シミュレーションにより評価する.皮膚良性色素疾患治療用ナノ秒パルスレーザー装置の承認申請機器を対象とし,パルス幅の異なる既承認機器と比較して熱損傷の観点から安全性が同等であることが,計算機臨床試験により評価可能であることを示した.
This paper proposes a computational clinical trial of laser treatment for rapid and low cost evaluation of novel medical laser devices. The optical propagation and photothermal damage process after pulse laser irradiation are modeled and the safety of the laser treatment with the evaluation target devices is evaluated by numerical simulation. The computational clinical trial result shows the safety of a novel nanosecond laser device for skin treatment is equivalent to the device that has been approved for clinical use.
超短パルスレーザーをはじめとしたレーザー技術の進展は,レーザー治療の高度化や適用範囲の拡大につながる1,2).ミリ秒からピコ秒オーダーのパルス幅を持つレーザー装置を用いた治療は,①レーザー光が組織や病変に吸収され,②組織や病変の温度が上昇し,③組織や病変が凝固,溶融,膨張,蒸散することにより,治療効果が得られる3).各作用の物理モデルやそのパラメータは,レーザー光の波長,照射時間幅,照射フルエンス(あるいはピーク強度)により変わる.そのため,特性の異なる新規レーザー装置の積極的な臨床利用により,新たな治療法や,従来と比較してより安全でより効果的なレーザー治療の展開が期待できる.
レーザー治療では外部から光エネルギーを注入して治療効果を得るため,リスクが全くないことはありえない.そのため,レーザー装置を臨床利用するためには,その装置のリスク評価が必要となる.医療機器におけるリスクの評価には,装置自体の品質と生体への安全性の評価が求められる.レーザー治療装置としての品質に関しては,JIS規格やIEC規格など標準化が進められており,安全規格や基準が定められている4).一方,生体に対する安全性評価には,主に,臨床試験や動物実験のデータをエビデンスとした統計的評価手法がとられている.臨床試験にはコストと時間が必要になるため,レーザー装置の安全性を十分に評価するための障壁となる.これは,日進月歩のレーザー装置開発と臨床応用とに時間差を生じさせるだけでなく,レーザー医療の進歩を停滞させる要因となり得る.また,未承認レーザー装置を用いた施術は,医療過誤の要因の一つともいえる.新規レーザー装置に対して,低コストで迅速に十分な評価を行うためのレギュラトリーサイエンスが重要となる.
レーザー装置を医療現場へ迅速に展開する取り組みは,日本の医療機器承認審査を担う独立行政法人医薬品医療機器総合機構においても進められている.例えば平成28年に,レーザー医療機器の承認申請では,使用目的と作用原理の既承認機器が存在し,性能及び使用方法に既承認機器との同等性が認められる場合,臨床試験の成績の提出が不要と定められた5).臨床試験の成績提出が不要とされるパスも用意されたが,性能及び使用方法に既承認機器との同等性の証明が必要である.現状では,追加の評価試験として動物やファントムを用いたex vivo実験が必要なままである.
低コスト・迅速な評価手法の確立は,医薬品や医療機器開発における共通の課題である.その中で,前臨床試験や臨床試験に加えて第三の試験として,モデリングとシミュレーションに基づくComputational clinical trials(計算機臨床試験)の重要性が高まっている6).これまで物理空間で実施されていた前臨床試験・臨床試験を計算機上に再現することにより,迅速・低コストな医療機器評価が可能となる.また,これまでの評価試験や実験では,例えば,臨床試験データにおける患者の個人差や手技者によるばらつきや,動物実験データのヒトへの外挿性の科学的根拠が課題と考えられるが,シミュレーションに基づく計算機臨床試験ではそれらを排除して,明確な前提条件のもと生体への作用を定量的に扱うことができる.レーザー治療においては,種々の物理パラメーターにおける光・生体組織相互作用のシミュレーションがこれまでに多く示されている7-10).レーザー照射による蒸散深さシミュレーションでは,非臨床試験結果との同等性が確認されており,シミュレーションに基づく評価の有効性がすでに実証されている10).これは,光・生体組織相互作用における熱的影響のモデル化により,高精度に数値シミュレーションできることを意味する.そのため,レーザー医療機器の承認申請に必要となる既承認機器との同等性の証明においても,ex vivo実験に替わる,モデリングとシミュレーションに基づく計算機臨床試験の適用が期待できる.レーザー医療機器に対する計算機臨床試験により,迅速かつ低コストに定量的安全評価が実現でき,新規光学機器の医療・医用応用の促進につながる.
本研究の目的は,新規レーザー医用装置の計算機臨床試験の一例を示し,新たなレーザー治療装置おける評価のための方法論を示すことである.一例として,本研究では,皮膚良性色素疾患治療用ナノ秒パルスレーザー装置を用いた治療に対する計算機臨床試験を行う.ナノ秒パルスレーザー照射における熱損傷過程をモデル化し,熱損傷体積を数値シミュレーションにより求める.正常皮膚組織へパルス光照射した際の温度上昇と熱損傷体積を安全性の指標として,既承認機器に対する承認申請機器の安全性を評価する.
本研究では,既承認レーザー装置(装置A,装置B)の2機種を用いた.それぞれの仕様をTable 1に示す.いずれもフラッシュランプ励起式Qスイッチアレキサンドライトレーザーであり,皮膚良性色素疾患治療用として承認されている.アレキサンドライトレーザーから出力される波長755 nmは,紫外域,他の可視域および中赤外域の波長の光と比較して,ヒト皮膚組織への光侵達深さが比較的大きい.装置Aが先に承認された経緯から,本研究では装置Aを既承認機器,装置Bを承認申請機器と想定して,装置Aに対する装置Bの安全性を計算機臨床試験にて評価した.両機器にてレーザー光を皮膚組織へ照射した際の,組織内の温度分布の時間変化とそれに伴う熱損傷体積を比較項目とした.
| Device A | Device B | |
|---|---|---|
| Wavelength [nm] | 755 ± 20 | 755 ± 5 |
| Repetition rate [Hz] | 1, 2, 3, 4, 5 | 1, 2, 5 |
| Spot diameter [mm] | 2, 3, 4 | 2, 3, 4 |
| Fluence [J/cm2] | 10–18, 5–10, 3.0–3.5 | 10–18, 5–10, 3–5 |
| Pulse width [ns] | 54–100 | 50–100 |
| Output stability (3σ) [%] | ±15.5 | ±15.5 |
| Output accuracy [%] | ±20 | ±15.5 |
ナノ秒パルスレーザーを照射した際に生じる皮膚組織への熱損傷作用のシミュレーションモデルを構築した.熱損傷計算の概要をFig.1に示す.まず,皮膚組織モデルを構築し,モンテカルロ法による光伝搬計算によって,皮膚組織に吸収される光エネルギー分布を求めた11).皮膚組織中の光伝搬速度と比較すると,熱拡散速度は無視できるほど低い.この近似の下,全パルスエネルギーがパルス幅の間に均一に入射すると仮定し,組織内の温度上昇とその後の熱伝搬による温度変化を計算した.その後,温度分布を元に,アレニウスモデルにより,凝固や細胞死領域を算出した.以下ではその詳細を示す.

Outline of calculating photothermal damage by a laser pulse irradiation. Light propagation in skin structure model is calculated with optical property parameters. The absorbed energy distribution is used for the initial value of a heat source to calculate thermal diffusion. From the calculated spatiotemporal temperature change, spatial distribution of thermal damage ratio is obtained numerically.
本計算機臨床試験では,Fig.2に示す三次元皮膚組織モデルを仮定した12).組織の面積を5 × 5 mm2とし,厚さを4 mmとした.皮膚組織は平面かつ層状の構造とし,表皮,真皮,皮下組織の3層モデルを仮定した.より詳細な多層皮膚モデル13)などの多層モデルとシミュレーション結果を比較したところ差異がなかったため,本研究では3層モデルを採用した.Fig.2に示すように,組織の深さ方向をz軸とし,表皮上面をz = 0とした.z軸に垂直にxy面をとり,三次元皮膚組織モデルのxy面中心を(x, y) = (0, 0)とした.各層は文献12)を参考に,表皮を0.1 mm,真皮を1.1 mm,皮下脂肪を2.8 mmと設定した.真皮には毛細血管,真皮上部血管,真皮下部血管が含まれる血管叢を仮定した.各血管の構造は文献14)より,Table 2に示す値を用いた.血液の体積分率と血管の体積分率が等しいとし,血管の体積分率から組織中に含まれる血管本数を決定した.Tables 3,4に示す光学特性値,熱伝導パラメータを,皮膚組織モデルの各組織の対応する位置へ割り当てた三次元モデルを構築した15-23).皮膚組織モデルの作成には,数値計算ソフトウェアのMatlab(MathWorks Inc.)を使用した.

Three dimensional skin model for the computational clinical trial.
| Center depth [μm] | Diameter [μm] | Thickness [μm] | Volume fraction [%] | |
|---|---|---|---|---|
| Capillary vessel | 175 | 10 | 150 | 4 |
| Upper blood net plexus | 290 | 50 | 80 | 30 |
| Deep blood net plexus | 1160 | 80 | 80 | 10 |
| μa [cm−1] | μs [cm−1] | g [-] | |
|---|---|---|---|
| Epidermis | 22.6 | 394 | 0.9 |
| Dermis | 0.25 | 238 | 0.9 |
| Subcutaneous | 0.09 | 118 | 0.9 |
| Blood | 3.0 | 321 | 0.9 |
| Density [g/cm3] | Specific heat [J/(g·°C)] | Thermal conductivity [W/(cm·°C)] | |
|---|---|---|---|
| Epidermis | 1.19 | 3.60 | 2.09 × 10−3 |
| Dermis | 1.12 | 3.22 | 3.00 × 10−3 |
| Subcutaneous fat | 0.97 | 2.30 | 2.05 × 10−3 |
| Blood | 1.00 | 3.84 | 4.92 × 10−3 |
皮膚組織内の光伝搬計算を,モンテカルロ法にて計算した11).レーザー光の波長は,フラッシュランプ励起式Qスイッチアレキサンドライトレーザーの755 nmとした.レーザースポットサイズをメーカー公称値である2,3,4 mmとし,それぞれの場合において,皮膚組織表面に対して均一な強度で垂直に入射した際のエネルギー密度を計算した.空間グリッドサイズを10 μmとし,入射光子数は1.2 × 107とした.Oregon Medical Laser Centerが公開している,組織内の光伝搬シミュレーションコード11)を使用した.
3.2.3 温度分布シミュレーション光伝搬シミュレーションにより得た算出した吸収エネルギーの空間分布を熱源エネルギーの空間分布として,各位置における温度上昇,熱拡散過程を計算した.三次元熱伝導方程式は,皮膚組織の温度T,熱源のエネルギー密度Sを用いて,
| (1) |
と表せる10).ここで,ρ,Cp,λは皮膚組織の密度,比熱,熱伝導率を表す.皮膚組織,空気層の初期温度は32°C,24°Cとした.皮膚モデル外への熱伝達はないものと仮定した.空間グリッドサイズを10 μmとし,有限要素法により算出した.時間ステップ間隔は,パルス光照射中はパルス幅を100分割した時間とし,パルス照射後は10 nsとした.温度分布シミュレーションコードはC言語を用いて実装した.
3.2.4 熱損傷シミュレーション熱損傷はアレニウスモデルに従ってモデル化し24),温度分布シミュレーション結果を元に熱損傷を計算した.組織の熱損傷指標Ωはアレニウスの式から,
| (2) |
と表すことができる.Cはある時間における熱変性を受けていないタンパク分子濃度である.A,ΔE,R,Tはそれぞれ,頻度因子(1/s),活性化エネルギー(J/mol),気体定数(J/(mol·k))絶対温度(K)である.Ωが大きいほど熱変性タンパク質の割合が高くなり,生体組織の熱損傷割合が高くなる.Ω ≥ 1となる場合,すなわち熱変性を受けていないタンパク質の割合C(t)/C(0)が0.37より低くなると,不可逆的損傷となる25).本研究においても,この不可逆的損傷を有意な損傷として,Ω ≥ 1となる領域を熱損傷領域として計算により求めた.このとき,皮膚組織のA,ΔEは実験的に求められた,
| (3) |
| (4) |
を用いた26).
装置A,装置Bともに設定可能なスポットサイズが同じであったため,各スポットサイズにおいて両者の皮膚損傷を比較した.パルス光エネルギーは,各スポットサイズにおいて公称値の最大となるように設定した.この設定のもと,装置の出力しうる照射パワー密度となる条件として,出力安定性を考慮して公称値から3σ加算した照射フルエンスかつ装置の出力しうる最小のパルス幅となる条件を過酷条件と定義した.一方,公称値の照射フルエンスかつ装置の出力しうる最大のパルス幅の条件を穏和条件と定義した.レーザー光は,組織モデルの組織表面の中心に垂直方向に照射した.装置Aにより,各スポットサイズにて照射した際の組織内光エネルギー分布と吸収エネルギー分布をFig.3に示す.装置Bにおいても,波長,スポットサイズは同じであり,1パルスのエネルギーに大きな違いがないため,同様の組織内光エネルギー分布と吸収エネルギー分布が得られ,光侵達深さはほぼ等しい結果が得られた.この場合の光侵逹深さは,0.95 mm(スポットサイズ:2 mm),1.10 mm(スポットサイズ:3 mm),1.16 mm(スポットサイズ:4 mm)と求まった.一方,装置Bにおいても同様に組織内光エネルギー分布と吸収エネルギー分布を計算した結果,光侵逹深さは0.95 mm(スポットサイズ:2 mm),1.10 mm(スポットサイズ:3 mm),1.16 mm(スポットサイズ:4 mm)であった.装置A,装置Bにおいても,波長,スポットサイズが同じであるため,光侵逹深さは同じ結果となった.スポットサイズ間の吸収エネルギー分布を比較すると,スポットサイズが4 mmの場合,ほぼ表皮層で光吸収しており深部への熱影響は小さいことがわかる.
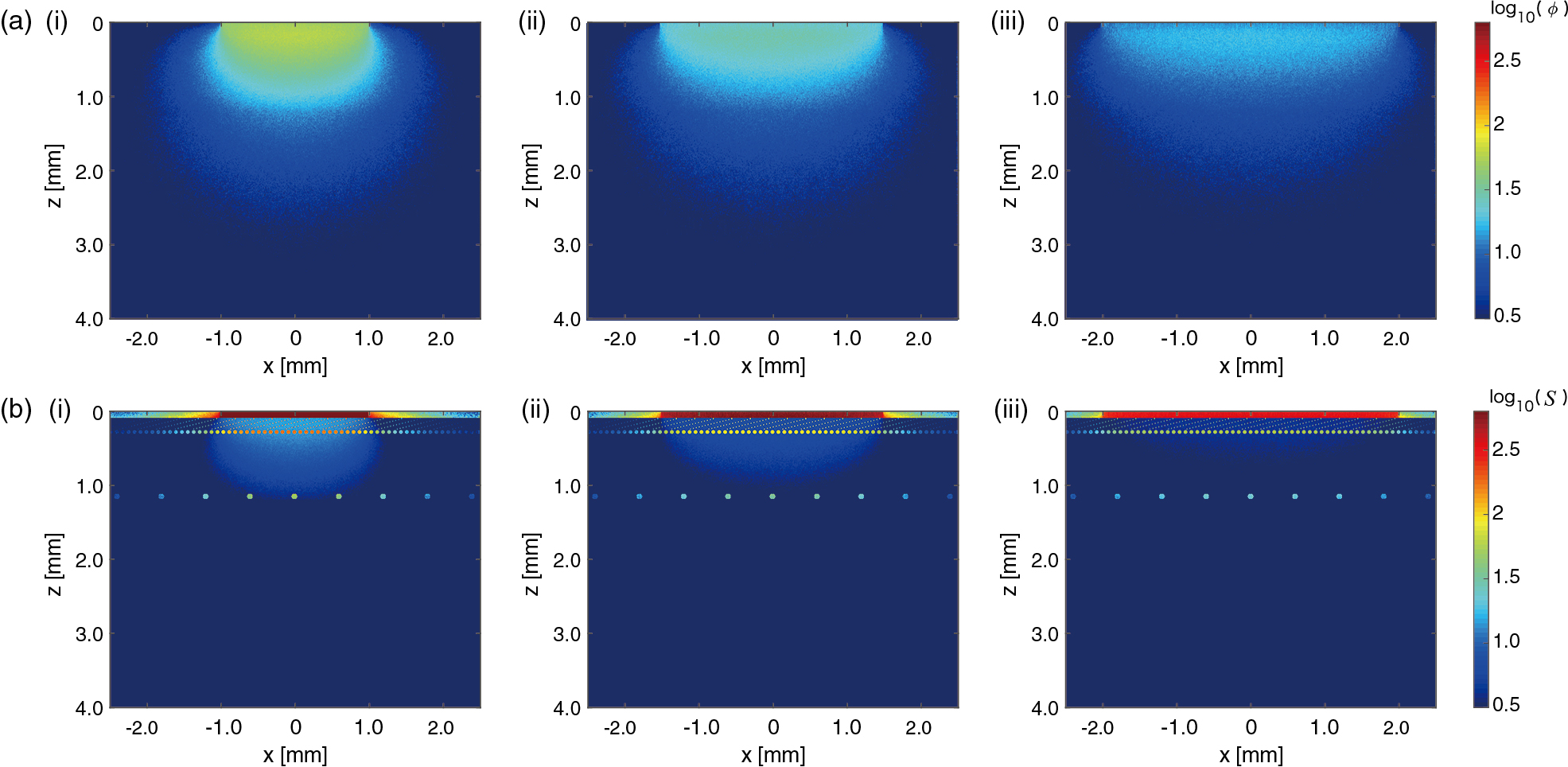
Spatial distributions of (a) light fluence ϕ and (b) absorbed energy S on zx plane (y = 0) after a laser pulse irradiation with device A. The spot sizes are (i) 2, (ii) 3, and (iii) 4 mm.
装置A,装置Bいずれにおいても,最も照射エネルギー密度が高くなるスポットサイズ2 mmの場合の結果を挙げる.Fig.4に,装置Aと装置Bのレーザーパルスを照射した際の,直後(0 s),50,100,150,200 ms後の組織中心における深さ方向の温度分布を示す.装置A,装置Bともにレーザーパルス照射直後0 sでは,波長775 nmの吸収係数が大きい表皮,血管領域に対するz = 0.11,0.18,0.29,1.16 mm付近で温度上昇のピークが観察できる.表皮組織における最高温度は,装置Aと装置Bともに,レーザー光照射直後の表皮層で計測された206°Cであった.その後,周辺組織への熱拡散により,表皮,血管領域の温度は低下した.200 ms後には,表皮層の最高温度は119°Cまで低下した.装置Aと装置Bともに温度上昇に差はなかった.装置Aと装置Bに各スポットサイズにおける,最高温度をFig.5にまとめる.いずれも照射直後の表皮組織で最大となり,最高温度の差は,スポットサイズ4 mmにおける,6.9°Cであった.
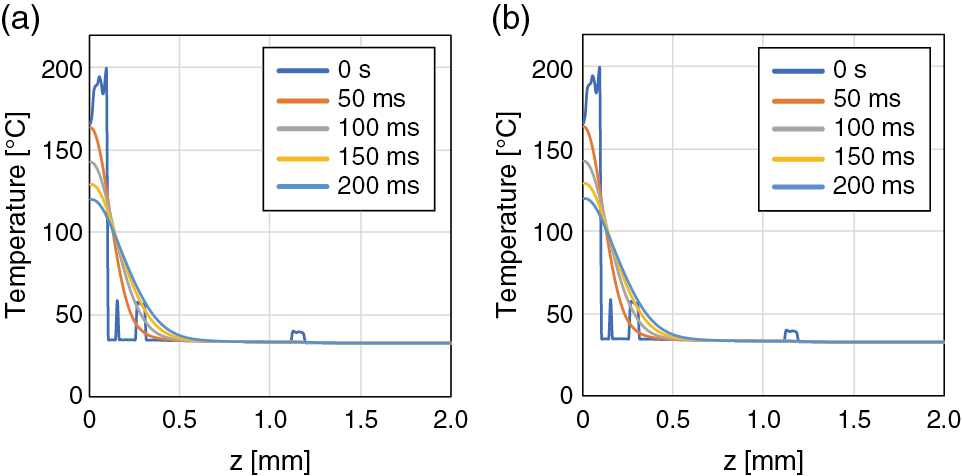
Temperature profiles of skin tissue on z axis (x = 0, y = 0) 0 (immediately after irradiation), 50, 100, 150, and 200 ms after a single pulse irradiation with (a) device A and (b) device B.
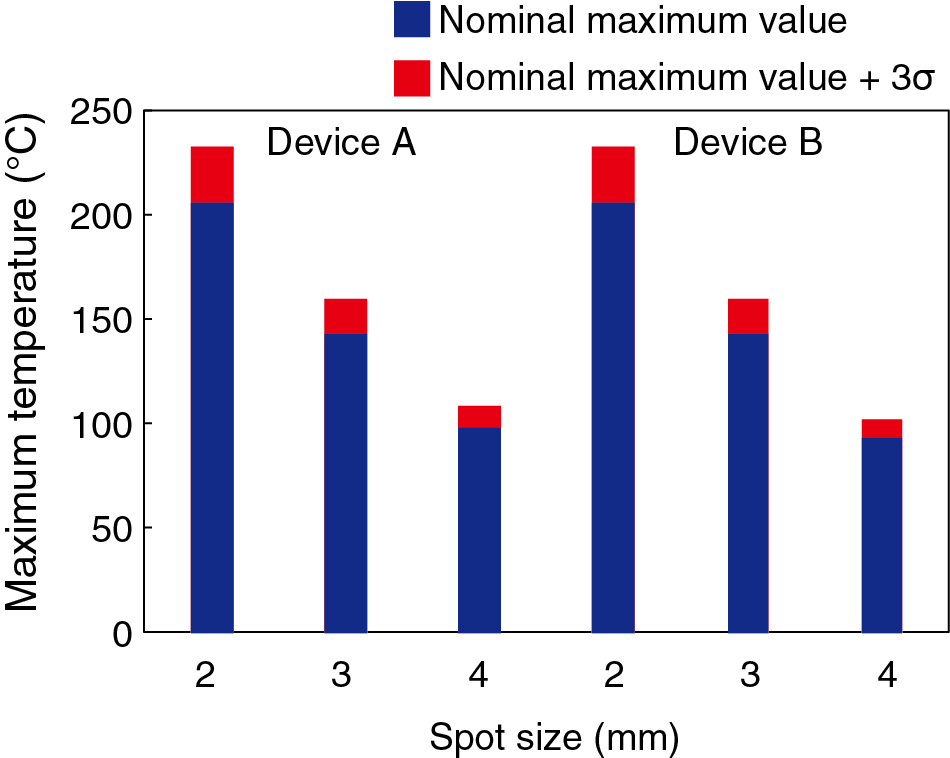
Maximum temperature in skin tissues after one single pulse irradiation.
レーザーパルス照射200 ms後の熱損傷指標のy = 0となる,zx平面での空間分布をFig.6に示す.装置Aの穏和条件と装置Bの過酷条件では,いずれのスポットサイズにおいても,熱損傷指標の分布は深部までわずかに広がっているものの,両者に大きな差はみられない.装置A,装置Bの,熱損傷領域の計算結果をFig.7にまとめる.装置Aの穏和条件における損傷体積は,スポットサイズ2,3,4 mmでは,0.88,1.38,0 mm3であった.装置Aの過酷条件における損傷体積は,スポットサイズ2,3,4 mmでは,0.97,1.53,0.99 mm3であった.装置Bの穏和条件における損傷体積は,スポットサイズ2,3,4 mmでは,0.88,1.38,0 mm3であった.装置Bの過酷条件における損傷体積は,スポットサイズ2,3,4 mmでは,0.97,1.53,0 mm3であった.各条件においても,熱損傷部位体積は,装置Aを用いてスポットサイズ3 mmとした場合に最大となった.穏和条件,過酷条件ともに,既承認機器である装置Aを用いた場合に生じ得る熱損傷体積に対して,装置Bを用いた場合に生じる熱損傷体積は同等または小さくなった.計算機臨床試験から,正常組織に生じる熱損傷の観点から装置Bは装置Aと比較して同等もしくは高い安全性を有するといえる.
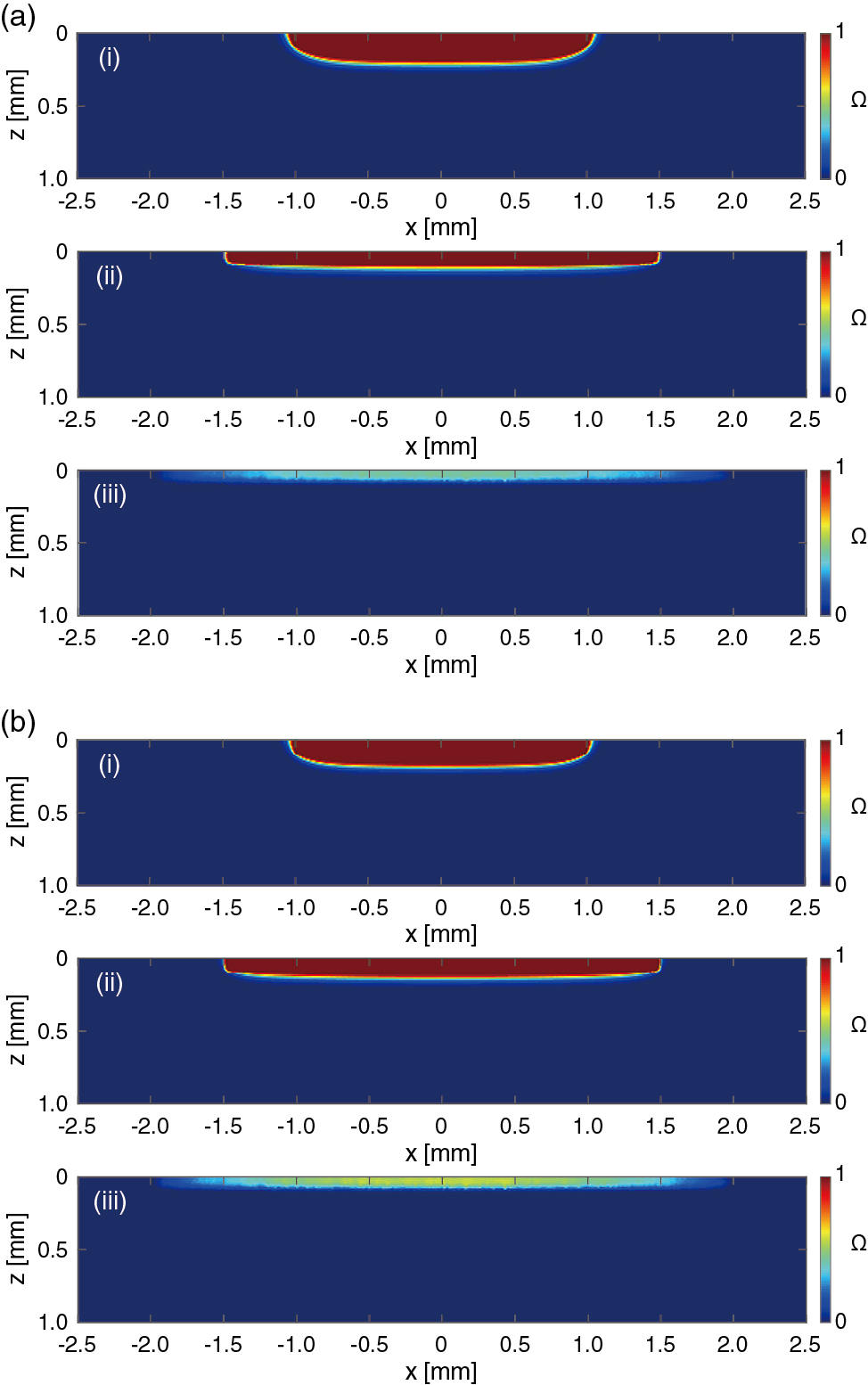
Spatial distributions of thermal damage index on zx plane (y = 0) by irradiation with (i) 2, (ii) 3, and (iii) 4 mm sized laser spot of (a) device A and (b) device B.

Thermal damages after one single pulse irradiation.
Fig.5とFig.7に示したように,計算機臨床試験の結果は,パルス幅による温度上昇,熱損傷に大きな差はみられなかった.今回比較対象とした装置A,装置Bでは波長と光照射フルエンスが同じであり,比較したパルス幅が異なった.各層の熱拡散係数α = λ/ρCpは,表皮,真皮,皮下組織中で,4.88 × 10−4,8.32 × 10−4,9.19 × 10−4[cm2/s]となる.皮膚組織モデルにおける熱閉じ込め条件を満たすパルス幅τは,τ = d2/4α,と表せる.dは各層の厚さであり,τは,表皮,真皮,皮下組織で,それぞれ,0.051,3.6,21.3[s]と求まる.装置A,装置Bの両条件とも熱閉じ込め条件を満たしていたことがあげられる.今回のシミュレーションでは,熱閉じ込め条件近似を用いず熱伝搬を計算していたが,温度上昇,熱損傷が両条件ほぼ等しい結果となったのはこのためである.
ナノ秒パルス領域においては組織の体積膨張による熱弾性波も生じ得るが,今回の計算機臨床試験では熱損傷が最大となる条件として,組織が吸収した光エネルギーは全て熱変換され作用するものとした.この場合,組織の光吸収後のモデリングに必要なパラメータは温度のみであり,本研究でも利用したように三次元熱伝導方程式により精度よく計算機上で再現できる.また,熱損傷の生じるしきい値などのパラメータなど,これまでに十分な知見が得られており,熱損傷評価には数値シミュレーションを取りれることが標準となっている24).装置A,装置Bの両条件とも正常生体組織への作用として熱損傷を計算することにより,安全性が高精度に評価できる.
Fig.4に示すように,両条件においても200 ms後の温度は初期値である32°Cまで戻らず,119°Cと温度上昇したままであった.装置A,装置Bともに最大繰り返し周波数は5 Hzであるため,同一箇所への連続照射した場合,熱の蓄積による温度上昇が想定される.そのため,同一箇所へのパルス光照射間隔は十分にとる,施術中の皮膚組織を冷却するなどの対応が求められる.ただし,本皮膚組織モデルでは光吸収の大きい血管の血流が考慮されていないため,温度上昇に対しては過剰評価となっている.血管系による冷却効果が大きな温度変化を与えることは多くの報告例があるが24),数値シミュレーションにより現象を再現するための物理パラメータは十分に蓄積されていない.今後,実験的な解析により,適切な冷却機能等の設計が可能となる.
「外科的な処置を使用目的とするレーザー機器の性能評価指針」5)において,実際の手技を反映した使用方法により,機器の設定可能なモード,出力全体で行うことが求められている.これまでは,動物やファントムを用いた試験が必要であったのに対して,計算機臨床試験においては,計算機上でパラメータを設定するのみの簡便な操作で試験を完結することができる.本研究で利用したモンテカルロ法による光伝搬計算,熱伝導方程式による温度計算はすでに広く利用される確立された手法である.また,アレニウスモデルによる熱損傷計算では,生体組織における熱的作用を高精度にシミュレーション可能であることが示されている10).そのため,ヒト皮膚組織においても高精度にシミュレーションできていると考えられるが,今後,実測実験との比較などによる精度保証が課題となる.本論文では,安全性評価として正常組織に対してパルス光を照射した際の熱損傷評価にとどまっているが,病変部位を含む皮膚組織モデルを導入することにより,今後,計算機臨床試験による有効性評価への適用が期待できる.
本研究では,計算機臨床試験により,承認申請機器と想定したナノ秒パルスレーザーの安全性を評価した.既承認機器における穏和条件と承認申請機器における過酷条件の熱損傷を計算機シミュレーションにより比較し,両機器の安全性が同等であると結論づけた.今回対象とした機器は実際に承認されており,本計算機臨床試験の示す結果と同じである.今後,臨床研究データや物理パラメータの高精度な取得により,計算機臨床試験の確度や信頼性を向上させることにより,新たな医療機器評価手法として展開できる.
開示すべき利益相反なし.