2020 Volume 40 Issue 4 Pages 399-402
2020 Volume 40 Issue 4 Pages 399-402
獣医学領域においても,悪性腫瘍に対しての治療は,外科療法,化学療法,放射線療法が三大治療と呼ばれ,治療の中心である.最近,第四の治療として免疫療法が注目されている.しかし,獣医学領域において腫瘍に対する免疫療法の効果は一定ではなく,三大治療の治療効果には及ばない.免疫療法以外では,温熱療法,凍結療法,光線力学療法等があるが,十分なエビデンスが得られていないことや使用する機器や薬剤が高価であるなどの理由で普及には至っていない状況である.今回,犬の乳腺腫瘍に対しての半導体レーザー光による温熱療法およびインターフェロンγの併用治療により,腫瘍が劇的に縮小した2症例を紹介する.
Surgical therapy, chemotherapy and radiotherapy are the main treatments for cancer treatment in the veterinary medicine. Treatment using immunity has attracted attention as the fourth treatment. However, immunotherapy for tumor in veterinary field is not put to practical use as a standard therapy yet. Except for immunotherapy, hyperthermia, cryotherapy, and photodynamic therapy are also being carried out for canine cancer treatment, but these therapies are not spread out because of insufficient evidence, and high cost of instrument and drug. In this study, we will introduce two canine cases in which the mammary gland tumor has shrunk by conducting combination ablation using semiconductor laser and interferon γ against tumor.
乳腺の腫瘤の増大と,その自壊,出血を主訴に来院した(Fig.1).レーザーによる止血および温熱療法を目的として,半導体レーザー(DVL-20・飛鳥メディカル・京都)の照射(出力5.0 Wで腫瘍表面から約5 cmの距離.腫瘍表面における1秒間当たりのエネルギー量は0.025 J/cm2)を腫瘍自壊部全域(35.8 cm2)に対して実施した.レーザー照射を開始して15分後に自壊部表面は黒色に変化したため,照射を終了した.照射総エネルギー量は5 (W) × 15 (min) × 60 (sec) = 4,500 (J)であり,単位面積当たりの総照射量は125.7 J/cm2だった.処置時に鎮静剤や局所麻酔薬は使用しなかった.処置後に,インターフェロンγ製剤(インタードッグ・東レ・東京)を1万単位/kgで皮下投与した.照射は,7日おきに3回実施し,インターフェロンγの皮下投与も同時に実施した.腫瘍は徐々に縮小し,腫瘍からの出血も確認されなくなり,2ヶ月後には腫瘍は触知できなくなった(Fig.2).
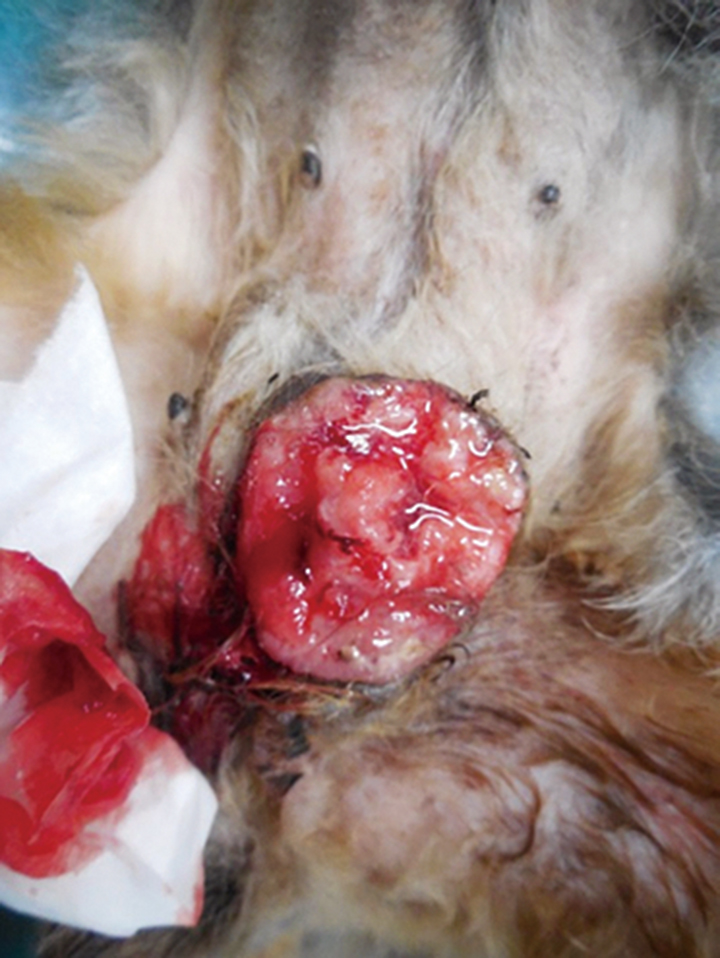
Before treatment mammary gland tumor.
A tumor with bleeding of 6 cm × 5.5 cm was confirmed in the left fifth mammary gland tumor.

Mammary gland at the end of treatment (after 2 months).
The tumor contracted and bleeding was not observed.
腹部腫瘍からの出血,元気消失を主訴に来院した.左第4乳腺に13 cm × 12 cmの出血を伴う腫瘍が確認された(Fig.3).症例1と同様,レーザーによる止血および温熱療法を目的に半導体レーザーの照射を実施した.初診日には,出力5.0 W,腫瘍表面から約5 cmの距離から腫瘍表面全域(156 cm2)に合計60分間(時々休憩を入れながら実施.以後の治療においても時々休憩を入れながら実施)のレーザー照射を実施した.60分間の照射により,症例1と同様に腫瘍表面全域が黒色に変化した(Fig.4).照射総エネルギー量は5 (W) × 60 (min) × 60 (sec) = 18,000 (J)であり,単位面積当たりの総照射量は115.4 J/cm2だった.またインターフェロンγ製剤の皮下投与とフィロコキシブ(5 mg/kg,SID,プレビコックス,メリアルジャパン,東京)の経口投与を開始した.症例1と同様,治療時に鎮静剤や局所麻酔薬は使用しなかった.その後もレーザー照射終了後にインターフェロンγの皮下投与は1万単位/kgで実施した.初診から2日後に腫瘍深部へのさらなる温熱効果を期待して出力5.0 Wで120分間にわたり腫瘍表面へのレーザー照射を実施したところ,腫瘍に凝固もしくは壊死の傾向が認められたため,腫瘍の一部を採取し病理検査を実施した.なお,レーザー照射を実施後には,照射部位より漿液が確認された.病理検査の結果は,乳管上皮由来の悪性腫瘍性病変(腺癌)であった(Fig.5).組織学的には,レーザー照射を実施した腫瘍組織は,壊死傾向が強かった.レーザー照射実施後,腫瘍からの排膿が顕著になったため,局所感染を予防するためにセファレキシン(25 mg/kg,BID,セファレキシン錠250 mg,日医工株式会社,富山)の経口投与を実施した.その後,第8と11病日に5.0 Wで各90分間のレーザー照射を実施し,さらなる腫瘍の縮小を確認した.縮小した腫瘍表面に半導体レーザー光を効率よく吸収させることと正常組織へのレーザー光の到達を防止する目的でインドシアニングリーン(ICG)(ジアノグリーン注射用25 mg,第一三共,東京)2.5 mg/mlを3~5 ml腫瘍表面に散布し,第21と28病日に7.5 Wで各90分間照射,第42と53病日に9.0 Wで各90分間の照射を実施した.計8回のレーザー照射により,肉眼的に腫瘍の消失が確認できたので全ての治療を終了した.治療終了から16歳10ヶ月で死亡するまで局所再発は認められなかった(Fig.6).しかし,死亡直前の来院時に胸部レントゲンを撮影したところ,胸腔内に腫瘍の転移と考えられる像が確認された.
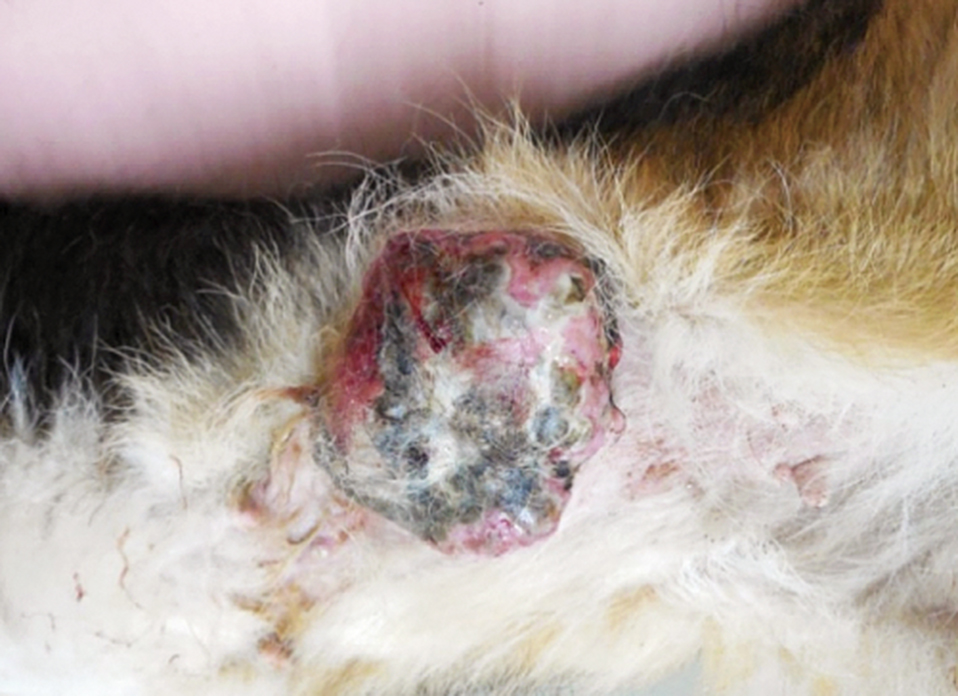
Mammary gland before treatment.
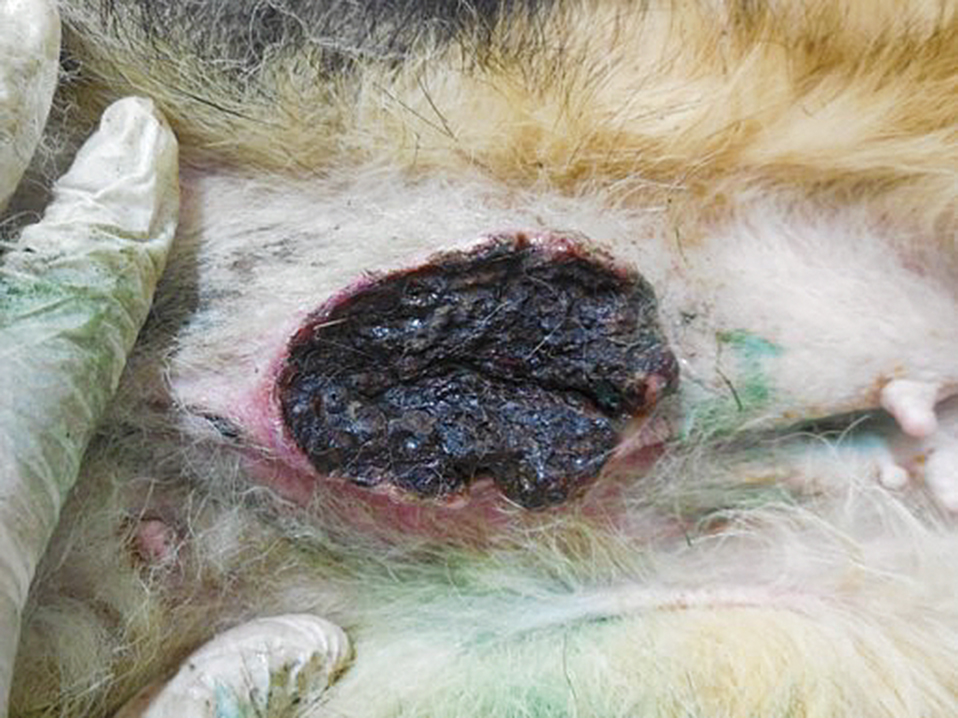
Mammary gland just after treatment.
The color of tumor surface change to black.

Pathological tissue photograph.
As a result of pathological examination, this tumor was diagnosed as adenocarcinoma derived from mammary ductal epithelium. At the part where laser irradiation was performed, the inside of the tumor was extensively necrosed.
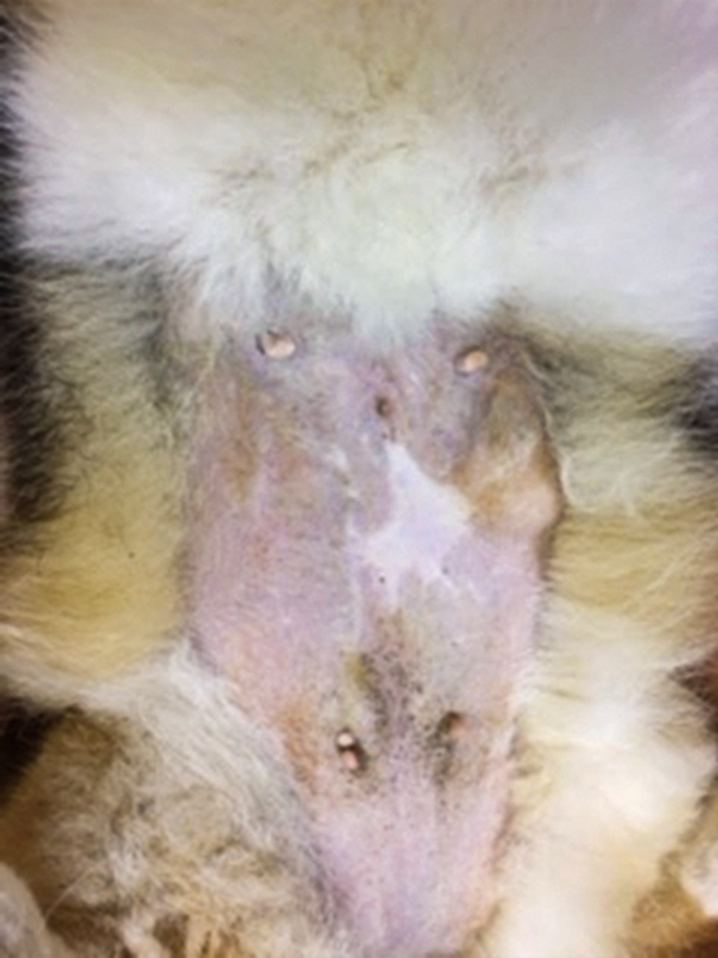
One year after the end of treatment the mammary gland.
The palpation tablet could not touch the tumor. Local control was achieved.
雌犬において,乳腺は腫瘍発生の最も一般的な部位の一つであり,雌犬に発生する腫瘍の約半数が乳腺腫瘍である1,2).直径3 cm以下の乳腺腫瘍を有する犬は,3 cm以上の乳腺腫瘍を有する犬よりも有意に生存期間が長いことが知られている3).すなわち,早期治療によって生存期間を延長させることが可能となる.犬の乳腺腫瘍に対しては,外科的切除が第一選択である.一方,重大な基礎疾患がある場合には,全身麻酔を行うことに大きな危険を伴うことがある.しかし,そのような症例に対して全身麻酔を用いない有効な局所療法の報告は極めて少ない.
今回,全身麻酔を用いず,腫瘍に対して半導体レーザーを用いた温熱治療,犬遺伝子組み換えインターフェロンγおよび非ステロイド系消炎剤の併用による治療を試みた.筆者の知る限り,これまで無麻酔下でのレーザー照射による腫瘍の温熱療法の報告は見当たらない.
半導体レーザーを用いて腫瘍表面から照射をおこなうと腫瘍表面は肉眼的に黒色に変化した.すなわち炭化したと考えられる.組織は150°C以上の温度で炭化することが知られている4).また,炭化した腫瘍組織の深部に存在する腫瘍細胞も炭化した部位からの熱伝導で高温に暴露され,壊死することが期待された5).腫瘍細胞は熱障害を受けると,細胞内でヒートショックプロテイン(HSP)が産生される.犬の腫瘍細胞においてもHSPが産生されることが報告されている6).このHSPは免疫機構に関与し抗原提示度が高まれると考えられている.
症例1では腫瘍表面を炭化させるのに15分間を要した.その時の単位面積当たりのエネルギー量は125.7 J/cm2であった.いっぽう,症例2に関しては,腫瘍表面を黒色に変化させるのに60分間を要した.その時の単位面積当たりのエネルギー量は115.4 J/cm2であった.すなわち,腫瘍表面に単位面積当たり115~125 J/cm2のエネルギー量を与えれば,腫瘍表面は炭化させることが明らかとなった.症例2では,さらに効率よく腫瘍表面を炭化させることと,レーザー光が腫瘍組織を貫通して正常組織に達しないためにICGを使用した.その結果,より効率よく腫瘍を縮小させることができ,正常組織への障害を認めなかった.
症例2に関しては,照射時間を当初60分間としていたが,その後さらなる温熱効果を期待して最大120分間まで延長した.しかし,時間を延長した効果に関して明確な結論は得られなかった.今後,腫瘍の大きさと照射時間の関連性に関して,さらなる検討が必要である.
今回の2症例ではレーザー照射による温熱治療に併用してインターフェロンγ(インタードッグ・東レ・東京)1万単位/kgを併用した.インターフェロンγは,T細胞やNK細胞により産生され,マクロファージの活性化,MHCクラスI分子およびMHCクラスII分子への発現を誘導し,抗原提示能を増強することが知られている7).筆者らは過去にインターフェロンγの単独使用でも腫瘍に対して縮小効果が認められることを経験している.著者らの経験では,インターフェロンγの投与回数が120回を超えた犬もいるが,副作用と考えられる症状は確認されなかった.このことより,インターフェロンγは極めて安全性が高いことが示唆された.しかし,免疫状態が低下している症例に対しては,インターフェロンγや樹状細胞免疫療法は効果的ではなかった.今回の症例において,抗原提示能増強効果が促進されたかどうかについては不明であるが,治療終了後約1年間以上にわたり,局所再発が見られなかったことから,今回の方法により何らかの免疫が生体に付与された可能性が示唆された.今後この点についてはさらなる検討が必要と考える.
犬の乳腺腫瘍では,発癌過程においてシクロオキシゲナーゼ-2が強く関与していることが知られている8).シクロオキシナーゼ-2は,発癌過程における腫瘍血管新生の促進や腫瘍周囲における浸潤や炎症などに関与している9).実際に外科手術単独よりも乳腺腫瘍の術後に化学療法や非ステロイド系消炎剤を用いることで,有意な生存期間の延長が得られている10).したがって,犬の乳腺腫瘍に対しては,非ステロイド系の消炎剤の投与が有効であると考えることができたために,症例2で使用した.
今回の2症例から,レーザー光によって腫瘍表面を炭化させることを繰り返すことに加え,インターフェロンγの併用することにより,腫瘍を表面から漸次縮小させることに成功した.今後さらに効果的で簡便な治療法の開発のために検討を重ねる必要があり,同時に照射時間と照射量を詳細に記録し,その関連性を考察する必要がある.
犬の乳腺腫瘍に対しては,外科的な完全切除が最も理想である.しかし,一般状態の悪化などを含めた外科的な介入ができない場合の代替療法としてのレーザー照射による温熱療法とインターフェロンγの併用療法は,局所コントロールについては有効である可能性が高いと考えられた.
利益相反なし.