2020 Volume 41 Issue 1 Pages 31-36
2020 Volume 41 Issue 1 Pages 31-36
産学官において意見交換を繰り返した成果として,薬生機審発0629第4号通知「レーザ医療機器の承認申請の取扱いについて」が発出された.この通知は,治験不要となる仕様の範囲を通知したものではなく,レーザメス以外の製品も含めた開発の指針となる点に新規性があり,主に,非臨床評価項目,使用目的及び臨床試験の要否の考え方がまとめられている.本通知を解釈するにあたり,特に,既承認品との差分を非臨床試験によって評価可能か否かを判断する際には,独立行政法人医薬品医療機器総合機構と相談することを勧める.また,上記通知の対象外である市販後の安全対策は医療機器にとって重要であり,承認審査における論点の一つとなる.特に,レーザ医療機器に関しては,安全管理者の選定や安全管理区域の設定といった特有の安全対策が必要であることに留意しなければならない.引き続き,レーザ医療機器に係る医療現場における課題解決に向けて,産学官での継続的な議論と密な連携が重要である.
In the result of discussions between industry, academia and government, yakuseikishinhatsu 0629 No. 4 ‘Management of medical laser application for approval’ was notified. The new notification shows not the range of specification without clinical trial but the guideline for development of medical laser including laser scalpel, which is mainly composed of non-clinical evaluation items and basic concepts of indication for use and necessity of clinical trial. The consultation with pharmaceuticals and medical devices agency is recommended for the decision that it is possible to evaluate the differences between devices with only non-clinical testing. Additionally, it is important for medical devices to take safety measures for the post marketing, which is not subjected to the notification but one of the review points for approval. Especially, it should be noted that safety manager selection and safety management area setting are essential for medical laser use. It is significant for resolving the clinical problems relative to medical laser to keep discussing continuously and cooperating closely with industry, academia and government.
厚生労働省所管の独立行政法人医薬品医療機器総合機構(pharmaceuticals and medical devices agency以下「PMDA」という.)は,医薬品,医療機器,及び再生医療等製品などの承認審査業務や,開発支援(相談)業務等を行う組織である.医療機器は,不具合が生じた場合の人体への影響の程度に応じて,一般医療機器,管理医療機器又は高度管理医療機器に分類されている.炭酸ガスレーザやダイオードレーザ等のレーザ医療機器は,GHTF(Global Harmonization Task Force)ルールに基づき,エネルギーを投与または交換するように意図したすべての能動型治療機器のうち,「人体へ,あるいは人体からエネルギーを投与または交換するような特性を備えた際,エネルギーの性質,密度および使用部位によっては,潜在的に危険な場合」に該当するため,リスク分類:クラスIIIの高度管理医療機器としての規制を受けている.つまり,規制の観点からも,レーザ医療機器は潜在的な危険性を持つ装置に分類されている,という認識が必要である.
そのようなレーザ医療機器については,承認と医療現場の乖離をなくし,より有効で安全な製品を適切に医療現場に提供するため,特定非営利活動法人日本レーザー医学会,日本医用レーザ協会及びPMDAの産学官において意見交換を繰り返し,現状整理と開発を支援するための評価指標作成に取り組んできた1).その成果として,平成28年6月29日付けで,薬生機審発0629第4号厚生労働省医薬・生活衛生局医療機器審査管理課長通知「レーザ医療機器の承認申請の取扱いについて」(以下「取扱い通知」という.)が発出されているところである.この取扱い通知に関しては,発出されてから3年程度と年数も浅く,活用実績もそれほど多くはない.また,通知上には記載事項の詳しい意図まで説明がないため,その点の補足も必要と考える.また,取扱い通知作成を目指した活動をきっかけとして,特定非営利活動法人日本レーザー医学会に設置されたPMDA連絡協議会において,定期的に産学官での意見交換を継続している.その議論の過程で臨床現場における新たな課題も認められたことから,本稿では,取扱い通知の解説と新たな市販後の課題について説明する.
取扱い通知が発出される以前は,平成20年11月28日付薬食機発第1128001号厚生労働省医薬食品局審査管理課医療機器審査管理室長通知「レーザ手術装置の承認申請に際し添付すべき臨床試験の試験成績に関する資料の取扱いについて」(以下「従来通知」という.)が存在し(現在は,従来通知は廃止),レーザメスの範囲に限った臨床不要の範囲を明示していた.しかしながら,レーザメスのみの治験不要の通知は開発に有益か,今の医療現場ではレーザメスが求められているのか,レーザメス以外の装置(波長の色素選択性を利用した機器や美容目的の機器等)はどのように開発すれば良いのか,という問題点解決の一つとして取扱い通知が発出された.
取扱い通知は,本文と別添から構成されており,前者には,用語の定義や基本的な考え方,後者には基本的な考え方に沿った具体的な評価項目や臨床要否の判断方法をまとめている.そのため,取扱い通知は,単に治験不要の範囲を通知したものではなく,従来の考え方も一部踏襲しつつ,レーザメス以外の製品も含めた開発の指針となる通知である.ただし,従来通知と同様に,別途,承認基準が存在する眼科領域の製品は通知の対象から除かれている.また,こちらも従来通知と同様,光線力学的治療(Photodynamic therapy,以下「PDT」という.)に用いる製品も,医薬品と医療機器のコンビネーション製品であり,医療機器単独の品目と比較して評価が複雑であることや,承認されている品目数も少なく,評価指標を定めることが難しい等の理由から対象から除かれている.それでは,以降に,取扱い通知の各別添の趣旨について解説する.
別添1には,レーザ医療機器に共通した性能及び安全性に関する評価指針が記載されており,申請書上に規定が必要な項目,評価が必要な項目を例示している.ただし,記載の全ての項目について評価しなければいけない訳ではなく,各製品の特性に応じて,該当する項目を評価すれば良いとする考え方である.また,実使用環境を想定すれば当然であるが,プローブや先端チップ等との組み合わせ評価が必要であることを明確化している.
別添2には,当該機器の開発の経緯及び外国等の使用実態に鑑みて,想定される適切な使用目的を全て承認申請書に記載する旨が記載されている(以下抜粋).
1.臨床不要通知の対象とされた使用目的(外科的処置)
・生体組織の切開
・止血
・病変組織の切除,凝固又は蒸散
2.1. 以外の使用目的(例)
・う蝕,歯石の除去
・皮膚良性色素病変の治療
・刺青の除去
・皮膚血管病変の治療
・皮膚の瘢痕の治療,結石の破砕,等
1と2にて,外科的処置とそれ以外を分けた理由としては,従来通知と同様に,外科的処置(レーザメス)であれば,原則,臨床試験の添付は必要ないという考えを踏襲しているためであり,申請書の使用目的又は効果上も,それが客観的に判断(区別)できるようにするためである.ただし,2.1. 以外の使用目的に該当することが,必ずしも臨床試験の添付が必要となる訳ではなく,その点は,あくまでも既承認品との差分に基づき判断することになる(別添5の解説でも述べる).
別添3は,別添1に加えて,外科的な処置を使用目的とするレーザ医療機器の性能評価指針をまとめており,レーザメスであることの根拠として使用模擬試験を追加し,その代わりに,従来通知のスペックの範囲の限定は廃止している.なお,使用模擬試験は,開発品と既承認品の仕様に差分が生じた場合に必要となる項目であり,そもそも仕様の同等性が説明できる場合には,使用模擬試験は必要ない.また,レーザ光を照射する対象組織に対してアプローチ可能であることを裏付ける使用方法に関する評価が必要であることも明記している.
別添4については,外科的な処置以外を使用目的とするレーザ医療機器の性能評価指針をまとめており,基本的に従来の審査の要求事項を明示したものである.その具体的な内容は,別添1の項目について既承認品との同等性を評価することであり,使用方法に関する評価の考え方は,別添3と同様である.
別添5には,レーザ医療機器の臨床試験成績の要否の考え方をディシジョンツリー形式にてまとめている(Fig.1参照).この内容は,取扱い通知の作成において,新たに基準を定めた訳ではなく,これまでの承認審査の経験において判断していた内容を見える形にしたものである.ディシジョンツリーの分かれ道のうち,①~④については,客観的に判断することが比較的容易である一方,⑤既承認品との差分にかかる臨床的な影響を非臨床試験によって評価可能か,という判断基準は,個別品目毎に検討を要する事項である.
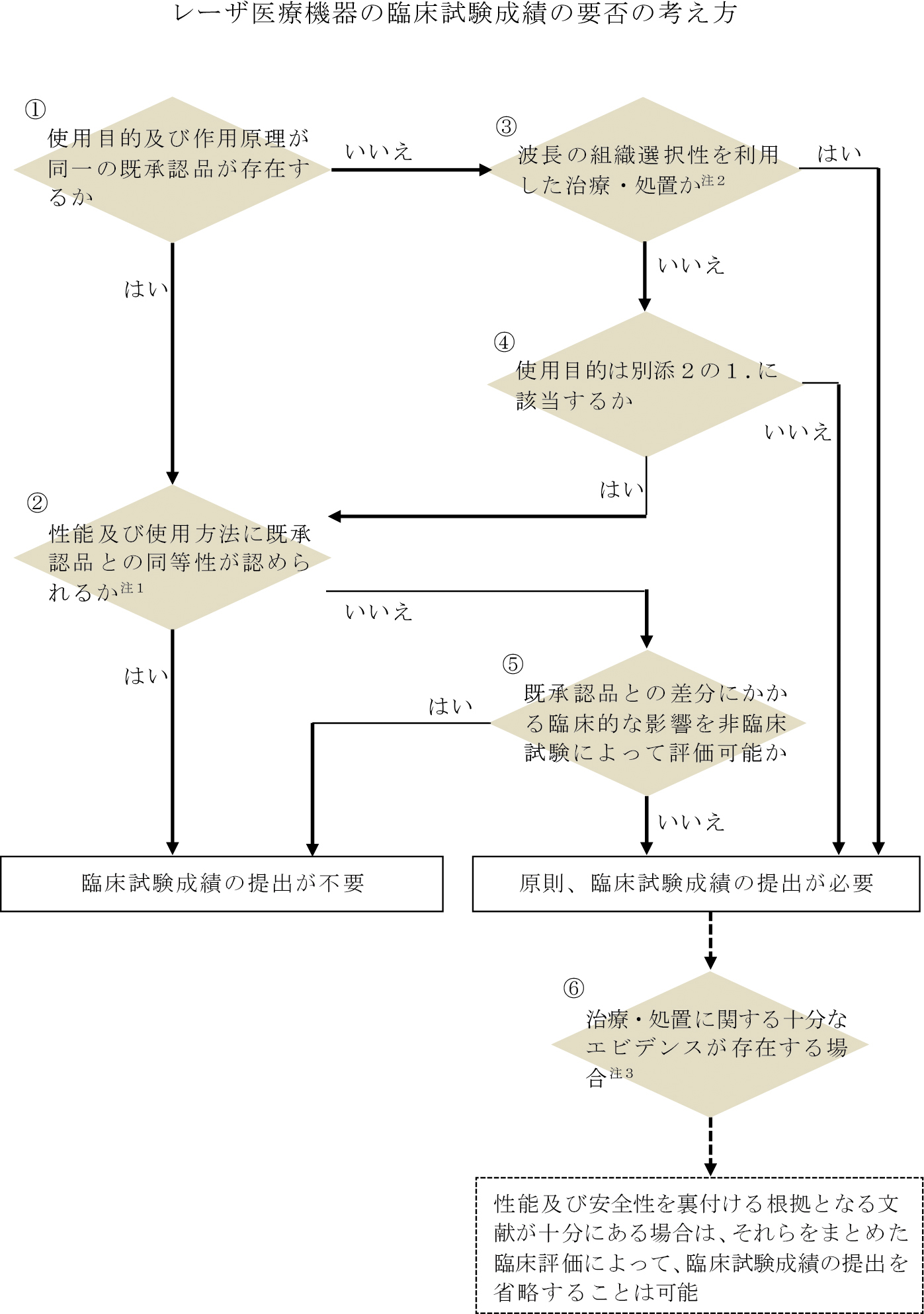
Decision tree relative to clinical evaluation of medical laser.
参考までに事例を紹介するが,取扱い通知別添2に記載のあるう蝕,歯石の除去に使用するエルビウム・ヤグレーザの既承認品は存在するものの,各社仕様が同等とは限らず,パルス幅や繰り返し周波数,エネルギー量について既承認品と開発品に差異が生じる可能性がある.そのような場合,使用目的や使用方法に鑑みて,既承認品に対する臨床的な位置づけに変更がなければ,非臨床試験により有効性と安全性を評価できる可能性はある.一方で,臨床的な位置づけの差別化を意図した結果,仕様を変更しているのであれば,臨床試験による評価が必要となる.そのため,このディシジョンツリー⑤に関しては,開発者だけで判断するのではなく,是非,PMDAの業務の一つである対面助言等の事前相談にて,議論することをお勧めする.
臨床使用における医療機器の有効性と安全性を担保するためには,医療機器の製品自体の性能や安全性の評価のみならず,適切な安全管理や適性使用が重要と考える.しかしながら,取扱い通知は,あくまで市販前の承認審査における評価指針や臨床試験の要否の考え方を取りまとめた内容であるため,市販後の安全対策や適正使用に関する留意点については対象外である.
しかしながら,レーザ医療機器に係わらず,医療機器の承認審査において市販後の安全対策は審査上の重要な論点の1つであり,製品の特性や治験データに基づき,対象患者や使用方法の制限,添付文書における注意喚起,及び承認条件(実施医や施設基準の策定,製品取扱いの研修・トレーニングの義務づけ等)等が主な安全対策の方法として挙げられる.
対象患者や使用方法の制限については,臨床試験の選択及び除外基準等を踏まえて,対象患者や対象疾患を制限する場合や,有効性と安全性が確認されている範囲に使用方法や手技を限定する場合がある.例えば,取扱い通知の対象外ではあるが,原発性悪性脳腫瘍に対するPDTに用いる製品の対象疾患は,あくまで腫瘍摘出手術を施行する場合に限定されている.また,使用方法の制限に関しては,レーザ医療機器で例えるなら,申請企業の責任の下,推奨治療パラメータを提示し,医師が設定するパラメータの組み合わせを制限する等である.
また,添付文書における注意喚起としては,重篤な合併症が想定される部位や患者を【禁忌・禁止】とする,慎重使用が必要な患者背景や使用方法に関連した注意事項を【使用上の注意】として記載することで,リスク低減措置を講ずるものである.
承認条件は,特に新医療機器の承認に際して,医薬品,医療機器等の品質,有効性及び安全性の確保等に関する法律第七十九条に基づき付す条件(下記参照)であり,あくまでも使用者(医師)ではなく,製造販売業者に課されるものである.ただし,第2項に記載のとおり,承認条件は必要最小限のものであり,過剰に不当な義務を製造販売業者に課すことがないよう配慮される.例えば,選択的熱作用による減毛を目的としたレーザは,基礎知識やレーザによる生体反応の原理を十分に理解していない医師が安易に製品を使用してしまうと重度の熱傷等の合併症を引き起こす恐れがあることから,一定の知識を得た上で適切に用いられるよう,関連学会と連携した講習の受講等を承認条件として義務付けている.
(許可等の条件)
第七十九条
この法律に規定する許可,認定又は承認には,条件又は期限を付し,及びこれを変更することができる.
2 前項の条件又は期限は,保健衛生上の危害の発生を防止するための必要な最小限度のものに限り,かつ,許可,認定又は承認を受ける者に対し不当な義務を課することとなるものであってはならない.
上記の市販後の安全対策は,医療機器全般に共通した事項であるが,その対策内容については品目毎に判断する必要があるため,画一的な承認審査における要求事項を提示することは難しい.一方で,レーザ医療機器に限った場合,市販後の安全対策として対応が必要な事項が存在する.しかしながら,PMDA連絡協議会における産学官での意見交換により,一部の現場では十分に周知徹底されていない可能性が認められたため,再周知も兼ねて,下記に述べる.
昭和55年4月22日付で,薬審第524号厚生省薬務局審査課長通知「レーザー手術装置について」(以下「S55通知」という.)が厚生労働省から発出されている(平成13年12月14日に改正).このS55通知では,安全性確保の観点から,製造販売時における遵守事項を定めており,主に下記の3つの事項が記載されている.
・「レーザー手術装置の使用上の注意事項」(Fig.2参照)を添付文書又は取扱い説明書に記載すること.

Precautions for medical laser use.
・製造販売業者は,装置を納入する際に使用及び取扱い上必要な注意事項を,使用者側に十分説明すること.
・製造販売業者は,納入時に保管・管理者が決められていること,管理区域が設定されていること等を確認した上で,装置を納入すること.
S55通知発出当時には,レーザ医療機器といえば,レーザー手術装置(いわゆるレーザメス)しか存在しなかったが,その後,技術の進歩に伴い,レーザー手術装置以外の治療機器が開発されている.また,日本レーザー医学会安全教育委員会編集のレーザー医療の基礎と安全においても,使用者の安全対策として,クラス4及び3Bのレーザ(JIS C 6802に基づく)に関しては,安全管理者の設置や管理区域とその標識の設置等が必要であることが記載されている.また,使用者の安全管理体制と管理項目も明記されている2).すなわち,高出力レーザを使用している場合,潜在的なリスクは手術装置でもそれ以外でも変わらない.そのため,基本的な考え方としては,高出力レーザである以上,手術装置(レーザメス)でも,治療装置(美容目的含む)であっても,S55通知への対応(安全管理者の選定,安全管理区域の設定等)は必要と考える.
3.2 取扱い通知の対象から除かれている製品の開発について取扱い通知では,PDTに用いるレーザ医療機器については対象から除かれている.そのため,PDTに用いるレーザ医療機器の承認審査における評価指標については,品目に応じて個別に検討している現状である.しかしながら,PDTに用いる製品開発において,承認申請のために参考となる資料としては,新医療機器として承認されているPDTに用いるレーザ医療機器に関してPMDAが作成した審査報告書が公表されている.審査報告書は,新医療機器に対して,開発の経緯をはじめ,審査上の評価項目や審査の論点等がまとめられており,一部の企業機密情報はマスキングされているものの,webページ(PMDAのホームページ)上に公開されており,誰でも閲覧することが可能である.審査報告書の内容を確認することで,承認審査において,総合機構が何を評価・検討したか,申請企業に対して何を要求し,企業はそれに対してどのように対応したのか等,審査の全体像を確認することが可能である.なお,直近では,「PDレーザ BT」(承認番号:22500BZX00420000)並びに「PDレーザ」(承認番号:21600BZZ00026000)及び「EC-PDTプローブ」(承認番号:22700BZX00165000)が承認(適応追加)された際の以下の2つについて審査報告書が公開されているため,開発の参考としてご利用いただきたい.
・原発性悪性脳腫瘍(腫瘍摘出手術を施行する場合に限る)(平成25年9月20日承認)
・化学放射線療法又は放射線療法後の局所遺残再発食道癌(平成27年5月26日承認)
本稿では,産学官による議論により発出された取扱い通知の趣旨について解説し,当該通知に含まれない部分についてもPMDAの考えを述べた.取扱い通知の解釈,特に,別添5のディシジョンツリー⑤の判断に関しては,積極的にPMDAの相談業務を利用して確認することを勧める.レーザ医療機器に係る医療現場における課題は開発支援や市販後安全対策以外にも残っている可能性があるため,引き続き,産学官で連携を密に図ることで,解決していきたいと考える.
利益相反なし.