2021 Volume 41 Issue 4 Pages 318-328
2021 Volume 41 Issue 4 Pages 318-328
原発性悪性脳腫瘍に対する光線力学的療法(Photodynamic therapy: PDT)が,腫瘍本体を摘出した後の浸潤細胞制御に関して有効性,安全性を示し,2013年に世界に先駆けて本邦で保険適応を獲得した.世界の脳神経外科医は40年前から悪性脳腫瘍に対するPDTの有効性を信じ,多くの前臨床研究,臨床研究を重ねてきた.そして,それらの叡智の結集が今回の成功の礎となったと言って過言ではない.本論文では,人類が初めてヒト悪性グリオーマにPDTを行なった1980年のイタリアの経験からの歴史を俯瞰し,光という武器を持った我々が,今歩んでいる状況,そして次の世代が果たすべきPDTの更なる発展に関して,著者の展望を述べた.
Photodynamic therapy (PDT) was approved to be covered by health insurance in Japan on 2013, as an additional intraoperative local treatment for invasive tumor cells after maximum safe resection of the primary malignant brain tumors. This review provides an overview of the clinical trials conducted over the last 40 years, illustrating how PDT is applied in the clinical practice in the world. Furthermore, examples from ongoing clinical trials are presented, and the author proposed the future perspectives of PDT for malignant brain tumors.
PDT: Photodynamic therapy; UCSF: University of California, San Francisco; HpD: Hematoporphyrin derivatives; KTP: Potassium-Titanyl-Phosphate; mOS: median overall survival period; mPFS: median progression free survival; BOPP: Boronated porphyrin; UV: Ultraviolet; RCT: Randomized Clinical Trial; 5-ALA: 5-aminolevulinic acid; FGR: Fluorescence guided resection; PPIX: Protoporphyrin-IX; i-PDT: Interstitial Photodynamic Therapy; IORT: Intraoperative radiation therapy; LED: Light emitting diode; CR: Complete remission; PR: Partial remission; NC: No change; IPA: International Photodynamic Association; TAM: Tumor associated macrophage
日本脳神経外科コングレスの学会誌には“温故創新”という連載があり,シニアあるいはリタイアした脳神経外科学の先逹らが,学会の今後を担う若き脳神経外科医に送るメッセージを記している.温故創新というタームは,誰もが知る孔子の言葉“温故知新”から派生したものであり,各分野の先逹らが築き上げた知識・智恵,技術・ノウハウ,つまり叡智に光を充て,新たな価値(知見)を想像するという意味がある.経験の無いことを想像・創造することは極めて困難であり,医学というサイエンスの基盤となっているのは,過去の経験を学び,その模倣から新たな知を想像し,その実践法を創造することにあるのではないかと思う.
著者が光線力学的療法(Photodynamic therapy: PDT)の基礎研究を始めたのは1999年末である.ある脳腫瘍病理の研究会で,先輩脳神経外科医に言われた“なぜ君がPDTを始めないのだ?”という一言が,著者がPDTという治療技術を知る機会となった.母校東京医科大学は世界に先駆けて早期肺癌のPDTを行なっており,その成果は標準治療を圧倒的に凌ぐものであった1,2).PDTの悪性脳腫瘍治療への展開の可能性を胸に,肺癌PDTの理論的構築を担っていた生理学講座の會澤勝夫教授の部屋を訪問した私は,そのpassionとvisionに圧倒された3).私は翌日から脳腫瘍治療におけるPDTに関して先逹らが残した叡智を学びながら,悪性グリオーマ細胞の培養を開始,ラット脳移植モデルの確立に励んでいた.
本稿では,悪性脳腫瘍に対してPDTの応用を目指してきた人類の叡智とも呼べる歴史的変遷を紹介し,それらを通して著者が現在のPDT protocolを確立する上で基盤となった知見の数々を記したい.そして,次の世代がPDTに関する新たな知を創造する為の著者なりのvisionを提示したいと思う.
人類が初めて光感受性物質を用いて癌と対峙したのは,1903年にTappeinerら4)が3例の皮膚癌患者にeosinを投与したことが最初とされる.その後,1942年にAulerら5)が光感受性物質hematoporphyrinが腫瘍組織内に選択的に取り込まれ,長く蓄積することを見出し,その治療への応用に関する多くの検証が続いた.その様な中,1972年にUCSFのDiamondら6-8)がグリオーマ細胞に対してhematoporphyrin投与下に可視光を照射することで,細胞傷害を生じ得ることを初めて報告している6).当時,多くの癌細胞や移植癌組織においても同様な知見が相次ぎ,1974年にDoughertyら9,10)が光感受性物質と光を用いて癌を治療するという方法論であるPDTを確立している.それと同期して,前述のUCSFのグループはnitrosourea誘発グリオーマ 細胞株と,同細胞の皮下移植ラットモデルに対し,hematoporphrinとXenon白色光を用いたin vitro/in vivo study7,8)を行い,劇的な細胞傷害効果を示している.この1975年に掲載された論文7)こそが,悪性グリオーマに対してのPDT研究の萌芽と呼べるものである.
2.2 その名称の変遷について光感受性物質を投与することを考えればchemotherapyの意味を有し,光を照射するという観点からはradiotherapyの要素もあろう.よって本治療法の萌芽と呼ばれる1970年代の論文にはphoto-radiation therapyやphoto-chemotherapyなどをタイトルがついたものが多い7-9).しかし,その治療機序は光感受性物質と励起光照射による,薬剤の基底状態~励起状態の項間交差から生ずるエネルギーが,組織溶存酸素を毒性を有する一重項酸素に変換して腫瘍細胞を攻撃するというものであり,これら一連の光化学反応のdynamicsを利用する治療である事から,Photo “Dynamic” Therapy(PDT)と名付けられ,その後はPDTという治療名が全世界的に確立されたのである10).
2.3 世界初の悪性グリオーマに対する臨床報告前述のUCSFのグループが悪性グリオーマに対するPDTの基礎研究の知見を積み重ねている中,意外にも1980年にイタリア北部Padova大学のPerriaらが世界初の臨床報告11)を行った.彼らは1988年にその詳細を続報12)しているが,8例のgradeを問わないグリオーマを対象としており,星細胞腫や乏突起細胞腫から悪性上衣腫,膠芽腫などであり,年齢も5歳から61歳と幅広い.その方法は,手術の24時間前に5 mg/kgのhematoporphyrinを静注し,手術中に腫瘍摘出腔に6 mm径のoptical fiberを6~12箇所に2 mm穿刺し,アルゴン色素レーザ(630 nm)を120~400 mWのパワーで33~225分間照射(720~2,400 Joules)するものであるが,どの様な選択基準で照射条件を設定したのか明確な記載もない.8例中6例が術後6.9ヶ月以内に死亡しており,膠芽腫の2例のみが生存しているという奇異な治療成績となっている.遮光期間はhematoporphyrinでありながら7日間とされ,光線過敏症は無かったと述べた.この論文をもとに,本治療がイタリアで国家承認を受けたとの事だが,著者が渉猟した限り,以後,同国から悪性グリオーマに対するPDTの論文は認めていない.
2.4 世界各国における悪性グリオーマに対するPDT臨床研究の変遷イタリアの1st in man報告後に世界各国から悪性グリオーマに対するPDTの臨床報告が続いた.その基礎的治療概念を確立したアメリカを端緒に,カナダ,オーストラリア,ドイツ,オーストリア,イギリスそして日本から続々と論文が発表されたのである.ここで興味深いのは,これらのhot spotと呼ばれる世界各地ごとに,首尾一貫として同じPDTの方法論で追求し続けていることである(Fig.1).つまり,初期の報告から現代に至るまで,同じ光感受性物質に拘り,光源は変化しつつも,その照射法は統一している国が多い.ここでは代表的なhot spotごとのPDT臨床研究の変遷を紹介してみたい.

Historical world hot spot of clinical research of PDT for malignant brain Tumors
・Australia(Melbourne)
Royal Melbourne病院のKayeらが先導してきた.彼らは1987年に初発,再発合わせて22例のgrade III~IVグリオーマに対しHpD(Photofrin®)5 mg/kgを手術24時間前に静注し,腫瘍摘出腔表面にアルゴン色素あるいは金蒸気レーザ光をfiberを用いて43~94分間照射するPDTを報告,Kaplan-Meierでの生存率の評価で,初めてPDTの有効性を示した報告であった13).1996年にはPopovic14)が,2005年にはStylli15)といったKayeの弟子らが臨床報告を相次いで行っている.特にStylliが2005年に報告した145例もの悪性グリオーマ(Grade III 59例,Grade IV 86例.初発61例,再発84例)に対するPDTの前向き比較研究が重要であった15).彼らはKayeの方法を踏襲し,手術24時間前にHpD 5 mg/kgを静脈投与し,アルゴン色素レーザ,金蒸気レーザ,KTPレーザの三種類のレーザを用い,腫瘍摘出腔を0.5%のintra-lipid solutionで満たした後に,70~240 J/cm2のエネルギーで照射している.全例に放射線照射,29%に化学療法を併用しているが,その結果,Grade IVの平均生存期間(以下mOS)は初発例14.9ヶ月,再発例13.5ヶ月であり,2年,5年生存率は,初発例で28%,23%,再発例で41%,33%と再発例での治療成績は眼を見張るものがあった.特に230 J/cm2以上の高エネルギー照射を行った群では,長期生存例も得られたのである.著者は10年前に国内で主催した学会にKayeを招聘し,彼らのPDT経験を報告していただいた.彼らはHpDに拘り続け,臨床経験が550例を超えたと述べていた.しかし光線過敏症の問題や,基礎研究基盤の脆弱性を憂いている点もあり,新しい光感受性物質の開発を目指していると述べていた.実際に彼らが開発したBOPPを用いたPDTのPhase I,II dataが続報16)されたが,膠芽腫のmOSが初発5ヶ月,再発11ヶ月と決して芳しいものでは無かった.すでに定年を迎えながらも新たなPDT fieldを目指すKayeの鋭い眼光に著者は圧倒され,敬意を抱くしか無かった.
・Canada(Toronto)
Toronto大学のMullerらが先導してきた.1990年の報告17)では光感受性物質としてHpD(Photofrin®)を用い,種々のグリオーマ症例を対象とし,励起光の種類はもちろん,そのパワー,エネルギー共に不均一な臨床経験を報告している.彼らの特徴は,腫瘍摘出腔を1,000倍希釈したintra-lipid solutionで満たし,バルーン拡散体を用いた照射法である.彼らはその後も一貫してこの照射法に拘った報告を重ねている18,19).特に2006年の報告20)ではPhotofrin® 2 mg/kgの一定量を手術12~36時間前に静注,アルゴン色素かKTPのいずれかのレーザを平均58 J/cm2に統一して腫瘍摘出腔にバルーン拡散体にて照射する方法であった.この報告では前向き比較研究を行っており,PDTを行なった43例と行わなかった34例の予後を比較している.全例で術後に放射線治療が施されているが,mOSの比較では PDT施行群11か月に対して非施行群は8ヶ月であったが,統計学的有意差を認めていない.ただし,6ヶ月生存率においてPDT群が有意差を持って良好であり,前向き比較研究においてPDTの有意性を示した初めての報告となった.しかしながら2008年に側頭葉の悪性グリオーマ3例のPDT後に一過性の脳神経障害(三叉神経,顔面神経)が発生したと報告し21),本方法論の注意を喚起している.おそらくintra-lipid solutionによる無菌性髄膜炎の可能性を示唆していると推察されるが,この報告以降,同グループからのPDTに関する報告が見られないことが気がかりである.
・Austria(Innsbruck)
Innsbruck大学のKostronらは1988年にHpDと630 nmのアルゴン色素レーザを用いたPDTを20例に行ったと報告している22).摘出腔の表面に対してfiberを用いて照射し,初発腫瘍に対しては27ヶ月ものmOSを得ている.しかし1995年に58例に症例を増やしての報告23,24)では,初発例は19ヶ月,再発例は7ヶ月となり,2006年の112例の報告25)では10.5ヶ月と徐々に下方修正されていることが気になる.ただし,それぞれの報告で,用いる薬剤は同一であるものの,照射エネルギーが一定しておらず,その事が予後の差につながっている可能性は否めない.その後,Kostronは新たな光感受性物質であるFoscan®(m-Temoporfin)に活路を求めている.2006年に26例の再発膠芽腫症例に対して行なった臨床研究26)では,手術の4日前に0.15 mg/kgのFoscan®を投与,手術中に370~440 nmのUV lightを用いた蛍光診断下の腫瘍摘出を行った後に,摘出腔表面に対して,652 nmの半導体レーザ光を拡散バルーンを用いて300 mW/cm2で20 J/cm2照射する方法論であった.対照として自らの施設における再発膠芽腫例をhistorical controlとして用いており,RCTとは言えないものの,radical resection率がFoscan®使用群,対照群でそれぞれ75%,52%,OSは9ヶ月と3.5ヶ月であった.2例で皮膚光線過敏症,1例でPDTに関連する脳浮腫を認めていた.摘出度に差があり,PDTの純粋な効果判定は困難かと思われるが,PDTの有効性は示せたと述べている.Foscan®を悪性グリオーマのPDTに用いたのはKostronが初めてであるが,2006年の本論文以降,彼らのグループからPDTの論文は公表されていない.
・Germany(Münich)
ドイツといえば5-ALAを用いたphotodiagnosisによるFGRを世界に広めた当時Düsseldorf大学のStummerが中心となって,光線力学的医療を展開してきた.2006年に報告されたFGRのPhase III studyの成果27)は,5-ALAという光感受性物質(PPIXのpro-drug)を脳神経外科医に広く認識させる契機となったことは間違いない.しかしながらStummerはPDTに関して多くを言及してこなかった.実際にドイツにおけるPDT研究を先導したのは,Stummerのグループの基礎研究者であるSteppである.彼らは5-ALAを用いた腫瘍組織内照射(interstitial PDT: i-PDT)に拘っており,再発悪性グリオーマ10例に対する同方法にて,mOS 15ヶ月というデータを2007年に報告28,29),さらに2008年にはStummerのfirst authorにて,PDT後56ヶ月もの長期制御が得られた,左島回に発生した再発膠芽腫の症例報告を行なった30).彼らの主旨は敢えて開頭術を行わず,laser diffuserと呼ぶoptical fiberを腫瘍組織に数箇所穿刺する方法論の低侵襲性であり,一貫して再発膠芽腫を対象としている.そして,その方法論は現在に至るまで継続されている31).
・Scotland(Dundee)
Dundee大学のEljamelがスコットランドのPDTを先導してきた.彼のprotocolは極めてユニークであり,まず手術の2日前に光感受性物質であるPhotofrin®を静注し,手術当日に5-ALA内服によるFGRを施行,その摘出腔にballoon diffuserを留置し,術中およびday 4までの5日間連続で100 J/cm2のPDTを行うというものである32).このdual photosensitizerによるFGRとrepetitive PDTの方法論は,これまでの世界の脳外科医が示してきたそれぞれの良さを併用した斬新なものであった.そしてEljamelが凄いところは,この斬新な治療法を自施設においてRCTという形で行ったことである32).症例数は27例で,治療群13例対照14例に過ぎなかったものの,mPFSがp < 0.01,mOSがp < 0.001という高い有意差をもって,治療群の有効性を示した.彼らのprotocolでは術後にconventional radiotherapyは行うものの,chemotherapyを行わなかったためか,治療群の優性を示しながらmPFS 8.6ヶ月,mOS 13.2ヶ月と決して良いデータではなかった32-34).その後,彼らのグループから73例の膠芽腫を対象とし,術中PDTと術中放射線照射(IORT: Hand-held typeのPRS 400®を用いて,摘出腔10~15 Gyの照射)の併用の有効性を検証する報告35)がなされた.その結果,PDT単独に終わった群のmOSが10ヶ月であったのに対し,PDT + IORTの群では19.8ヶ月と有意に延長していた.とにかくEljamelのグループからのPDT報告は斬新な方法論であり,それをRCTで行うという推進力には驚かされる限りである.しかしながら2012年に発表された本報告35)以降,EljamelのグループからPDTの報告は一切なされていない.
・USA(Milwaukee)
アメリカにおいてはWisconsin大学のWhelanが先導して,主としてPDTのPhase I~II studyが行われてきた36).彼らは光感受性物質として種々のdoseのPhotofrin®を用い,光源としてレーザを用いたり36),LEDを用いたり37),そして照射法も腫瘍摘出腔に対してlaser optic fiberやballoon diffuserを用いたりしている.まずphase 1で各種方法論の安全性を確認,そして小児例への施行安全性にまで言及している38).しかしながら,アメリカにおいては悪性脳腫瘍に対するPDTの有効性を示せた臨床研究は無く,PDTの最も有効で安全な方法論を探索している状況にある39,40).
・Japan(Sapporo)
本邦におけるPDT臨床研究の萌芽は,1988年のオーストラリアのKayeらのグループの報告に端を発した,科研費補助金研究事業平川班によるものであろう41).光化学療法と呼ばれたその方法は,手術の1~3日前にHpDあるいはPhotofrin II®を静脈注射した後に,患者を遮光管理.開頭術にて腫瘍を摘出したその腔の全面に,光ファイバーによるアルゴン色素レーザ緑色光(514.5 nm)を,ターゲットから3~5 cm離して20 mm径の範囲で,0.5~1.0 Wで10分間数箇所に照射している.実際の臨床報告例は極めて少なかったが,再発を疑って摘出した組織像において,PDT施行部の著明な壊死組織を確認できている.しかしながら,著者が渉猟した限り,本研究班からは世界に発信する様な英文論文は報告されていない.
ほぼ同じ時代に北海道大学の金子が悪性脳腫瘍に対するPDTの意義を基礎研究にて追及していた.そして1998年に臨床データを報告している42).その方法としてはhematoporphyrin ester(HPE)を手術の2日前に静注し,腫瘍組織内にoptical fiberを腫瘍のvolumeに応じて数本穿刺し,200 mWのアルゴン色素レーザを15分間照射する方法であり,17例の悪性グリオーマ,5例の転移性脳腫瘍を含む24例,28個の腫瘍に対してstereotactic i-PDTを行なっている.結果としてPDT後4週間の評価でCR 64%,PR25%の良好な結果を得ている.そして本方法論が有効なtumor volumeの上限が4.6 mlであることを明記している.その後,金子は2008年に5-ALAを用いたFGRに引き続き,HpDによるPDTを摘出腔表面照射あるいは組織内照射する(Eljamel らの方法),63例の経験を報告したのである43).そして2011年には前述のstereotactic i-PDTを,開頭摘出が困難な大脳基底核などに発生した再発悪性グリオーマ24症例27腫瘍を対象として行い,その有効性安全性を報告した44).Optical fiberの穿刺部位(照射target point)を術前MRI画像から三次元的に10 mm間隔となるように設定,局所麻酔下の穿頭術にてfiberを挿入,半導体レーザ光635 nmの光をfiber先端出力200 mWで15分間(180 Joule)照射,fiberの本数分繰り返した.PDT後4日の時点で治療効果を判定,CR 16腫瘍(59%),PR 8腫瘍(30%),NCが3腫瘍(11%)と極めて良好な成績を示した.CRが得られた腫瘍の最大体積は5 ccであり,腫瘍体積と治療成績の明らかな相関を認めている.有害事象となったのは軽度から中等度の脳浮腫であったが,大きな問題となることは無かったとのことであった.金子のスタンスとしては,開頭術下,5-ALA投与によるFGRにて腫瘍組織の多くが摘出できる症例では,FGR後の摘出腔に対し,表面照射という形でPhotofrin®-PDTを行うが,術前画像にて摘出が困難と思われる症例に対しては,stereotactic i-PDTをトライするという,腫瘍局在やサイズに応じた二刀流のPDTを選択するというものであった44).
2.5 悪性脳腫瘍に対するPDTの歴史的俯瞰これらhot spotの歴史的変遷を辿ると,1980年つまりは40年近く前に始まった悪性脳腫瘍に対するPDTの臨床経験の知見の蓄積が,本治療法の方法論を徐々に発展させてきたことがわかる.光感受性物質の選択然り,励起レーザ光の選択,条件設定然り,そしてPDTの手法然りであろう.ただ言えることは,各hot spotにおいてはこれらのPDTの基本となる薬剤,励起光,照射法の選択などは,終始一貫として拘りが見えるのである.
薬剤に関しては,HpDが用いられることがほとんどであるが,5-ALAやFoscan®といった新規光感受性物質をトライする臨床知見も徐々に出現してきた(Fig.2).そして励起光も昔はアルゴン色素レーザや金蒸気レーザが用いられていたが,その後は半導体レーザ光が主流となってきている.最後の照射法に関してが,hot spotごとの拘りが最も認められるものであり,腫瘍摘出腔にoptical fiberで表面照射するordinary surface irradiation法,摘出腔をintra-lipid solutionで満たし,balloon diffuserで照射するballoon surface irradiation法,腫瘍は摘出せず,腫瘍本体にoptical fiberを数本穿刺して腫瘍組織内照射を行うtumor interstitial irradiation法,そして腫瘍を摘出した後の摘出腔壁の残存腫瘍細胞に対して,optical fiberを穿刺して照射するcavity interstitial irradiation法(Fig.3)などがあり,hot spot毎に照射法の選択の特徴があり,興味深いものとなっている.

Methods of laser irradiation

PDT methods in hot spots
OSR: Ordinary surface irradiation, BSR: Balloon surface irradiation, TIR: Tumor interstitial irradiation, CIR: Cavity interstitial irradiation, HpD: Hematoporphyrin derivatives, 5-ALA: 5-aminolevulinic acid, BOPP: Boronated porphyrin
そしてPDTの有効性を示した報告も少なからず認められており,特にTorontoやDundeeのグループが行なったRCTによる,PDTの明確な優位性を示した治療効果の証明や,Melbourneのグループが示した照射レーザエネルギーの多寡による治療効果の差などの知見は,その後の悪性脳腫瘍に対するPDTの発展に大きな寄与となったものであった.
冒頭に記した様に,著者は20年ほど前に悪性脳腫瘍に対するPDTの基礎研究に着手した45).PDTの概念や,世界が光で悪性脳腫瘍に挑んできた叡智の数々を知るにつけ,特に悪性グリオーマ浸潤先端制御の可能性があることを実感してきた.特に著者のメンターとなっていただいた會澤がその開発に関与された,国産の光感受性物質であるクロリン誘導体Talaporfin sodiumが示してきた早期肺癌に対する成果を知り,本薬剤の悪性脳腫瘍治療への展開の可能性に大きな魅力を感じたのである45).In vitroの研究で悪性グリオーマ細胞への手応えを得たのち46,47),どの様なPDT方法論でin vivo studyからの臨床へ進めて行くか深慮を重ねた結果,腫瘍本体切除後の浸潤先端に対してのordinary (cavity) surface irradiation法で進めることとした48,49).その根拠としては,治療対象とする腫瘍細胞の絶対数が少ない方が勝算があると考えたこと,そしてターゲットをspotとして絞り,照射部位と非照射部位の位置を明確としたいと考えたこと,そして摘出困難な部位の脳にoptical fiberを穿刺することは脳損傷をきたすリスクがあると考えたことなどが挙げられる.
In vivo studyでの成果を得た後,東京医科大学倫理委員会の承認を得たのちに2006年5月29日に右側頭葉から島回に浸潤した59歳女性の膠芽腫例に対して初めてPDTを行うことができた.当然ながら照射方法論のみならず,薬剤投与量,照射タイミング,照射条件設定などには多くの科学的根拠の積み重ねが必要となったが,これらの設定にも多くの基礎的データが必要であった.薬剤投与量に関しては,すでに早期肺がん治療の確立のために行われたPhase 1 studyの結果を踏襲し,安全性の観点から早期肺癌と同一の投与量としている.照射タイミングを薬剤投与後24 ± 2時間とした根拠としてpharmacokineticsの基礎データ50)が重要であった.最も困難であったのは照射エネルギー設定であった.照射パワーは早期肺がんのプロトコールと同様の150 mW/cm2と設定したが,照射エネルギーを100 J/cm2とすべきか否かが大きな課題となった.早期肺がんでは腫瘍新生血管を障害し,癌細胞に広範な虚血性壊死を誘導することをPDTの主目的としているが,著者がターゲットとして悪性グリオーマ浸潤先端では,血管を障害することは正常脳に虚血性障害を来すリスクがあるため,より弱いエネルギーで腫瘍細胞へのダイレクトな障害のみを誘導したいと考えた.そのため,PDTの1例目を開始する前に,Talaporfin sodiumを投与後に摘出した腫瘍組織へのPDTを施行しての組織変化を検討するex vivo studyを施行したのである.27 J/cm2,50 J/cm2,100 J/cm2の三段階のエネルギーで摘出後,瞬時にPDTを行なった組織において,50~100 J/cm2のエネルギー照射では腫瘍細胞障害よりも血管内皮障害の方が強く生じ,27 J/cm2では明確な血管内皮障害が見られないことを確認したのである(Fig.4).この結果により27 J/cm2に設定して倫理委員会の承諾を得ることができたのであった.

Histopathological findings of glioblastoma tissue after 100 J/cm2 of ex vivo
PDT using Talaporfin sodium.
Case 1: 56-year-old man
A: Fluorescence imaging of resected tumor tissue
B: Findings of photobleaching after PDT
C, D: Massive necrotic change of part of the tumor tissue after PDT (H&E stain, C: ×100, D: ×400)
E: Fibrin thrombosis in the vessel (PTAH stain, ×400)
F: Damage of the endothelium of micro-vessels in the necrotic area of tumor tissue. (Factor VIII stain, ×400)
Case 2: 65-year-old woman
A: Fluorescence imaging of resected tumor tissue
B: Findings of photobleaching after PDT
C, D: Massive necrotic change of part of the tumor tissue after PDT (H&E stain, C: ×100, D: ×400)
E: Fibrin thrombosis in the vessel (PTAH stain, ×400)
F: Damage of the endothelium of micro-vessels in the necrotic area of tumor tissue (Factor VIII stain, ×400)
第一例を無事に施行し,その安全性を確認したことを倫理委員会に報告し,改めて臨床研究の継続につき承認を得ている.その後,初発6例,再発8例の膠芽腫に対するPDTの有効性安全性を多くの学会,研究会,論文で報告するに至った51).そして2009年から開始された医師主導治験においては,著者が設定したPDT方法論がそのまま採用され,初発膠芽腫のmOS 24.8ヶ月,mPFS 12ヶ月と,初発膠芽腫の治療の歴史において,過去に例を見ない成果を示し,安全性も確保されたことで52),2013年9月に保険承認を得ることが出来たのである.国家レベルで悪性脳腫瘍に対する保険承認を得たことは,人類が光を用いて悪性脳腫瘍に挑んできた歴史上初めてのことであった45,51,52).その後も本治療法の有効性安全性を示す検証的臨床報告を続け,本邦の脳神経外科に本治療を普及させるべく,厚生労働省や経済産業省のバックアップを受けて,その安全施行ガイドラインの作成,安全施行トレーニングコースの実施,企業主催のプロモーションビデオ作成,プレスリリース,WEBカンファレンス開催などを展開してきた.そして,未だ十分とは言い難いものの,日本国内の脳神経外科医に周知され,PDT施行可能施設も徐々に増加してきている.昨年末にはNittaら53)による最新のPDTの成果が報告され,世界の脳神経外科医にも我々の業績が徐々に認知されつつあり54),その方法論が確立されたと言って過言ではないと考える.
3.2 他国の臨床報告の最先端について2017年と2019年のIPAのworld congressにおいて,著者はscientific committeeとして脳神経外科領域のPDTのシンポジウム,ワークショップを企画,発表する機会を得た.この2回の学会では世界各国の脳神経外科医,基礎研究者から多くの発表を得たものの,脳腫瘍に対するPDTを臨床遂行しているのは,著者らの日本グループを除けば,ドイツのStepp,Stummerのグループと,フランスのReynsのグループだけである.
ドイツのグループは前述した方法(tumor interstitial irradiation: TIR)を踏襲し,開頭摘出が困難な部位に発生した直径3.5 cm以下の初発膠芽腫15例に対してinterstitial PDTを行なったGL01 studyの結果を報告している55,56).光感受性物質としては5-ALAを用い,彼らが開発したlaser calibrated fiberを,腫瘍を取り囲む様にstereotacticに1 cmずつ離して穿刺し,635 nmのレーザ光を200 mW/cm2のパワーで1時間かけて照射するという方法である.結果としてPFS 16ヶ月(controlは6.9ヶ月),3年生存率56%(controlは16%)と明確な有効性を示している.このGL01 studyはドイツ国内3施設で目標症例20例のPhase II studyであり,比較対照はStupp regimenによる標準治療データである55).あと5例の症例蓄積で国家申請に至ると述べていた.また,同時進行で直径25 mm以下の再発膠芽腫を対象としたNOA11 study(Phase IIb)も走っており,これはドイツ国内7施設で目標症例を76例としてRCTで行うこととなっている.いずれのstudyも開頭せずに行う低侵襲治療であることの利点を強調はしているが,一方で術前画像から立体的にfiber穿刺部位を決定する措置が煩雑であり,穿刺による腫瘍組織あるいは脳実質への侵襲が危惧され,さらに光の伝播に関しても不明確な点があるとの欠点も述べている56,57).実際に著者はGL01,NOA11 studyの両者の中心的役割を担っているSteppに本治療法の有害事象につき質問した.彼は,ある程度の浮腫や出血は覚悟しているものの,それによって追加手術が必要となった症例はなく,許容される範囲内であることを述べていた.また,5-ALAと635 nmの励起光を用いている限りは,光の進達度は3 mm程度に過ぎないため,1 cm間隔にoptical fiberを打つことが正解なのかは解らないと述べていた.
フランスは過去のPDT researchにおけるhot spotではなく,2017年のIPA congressからいきなり臨床研究として参加してきた.彼らの方法論は光感受性物質として5-ALAを選択57,58),FGRにて腫瘍を可能な限り切除したのちに,彼らが開発した最大径70 mmのballoon diffuser(intra-lipid solutionでballoonを膨張)を腫瘍摘出腔に挿入,635 nmのレーザ光を2分間隔で117秒間,5回照射するプロトコールである59).Intraoperative 5-ALA mediated photodynamic therapy for treating glioblastoma: INDYGOと名付けられた本研究は,フランス国家に大きな支援を受け,10例の単アーム臨床治験にて国家承認されるとNature誌に報告されていた59-61).しかしながら本年度のIPA congressでの報告では,治療に直接関連する有害事象は無かったことを報告しつつ,10例中5例が早期に死亡しており,その内訳としては2例が局所再発,2例が遠隔再発,1例が髄膜炎である.残りの5例のうち4例のみが非再発であるが,1例に遠隔再発が確認された.当初,フランス国内での保険承認を目指していた主導者のReynsは今回の結果はフランス国内における脳腫瘍に対するPDTの1st stepであることを主張し,会議後の私信では,5-ALAと励起光の限界を述べ,今後dose escalation studyを行う方針であるとのことであった(Fig.5).
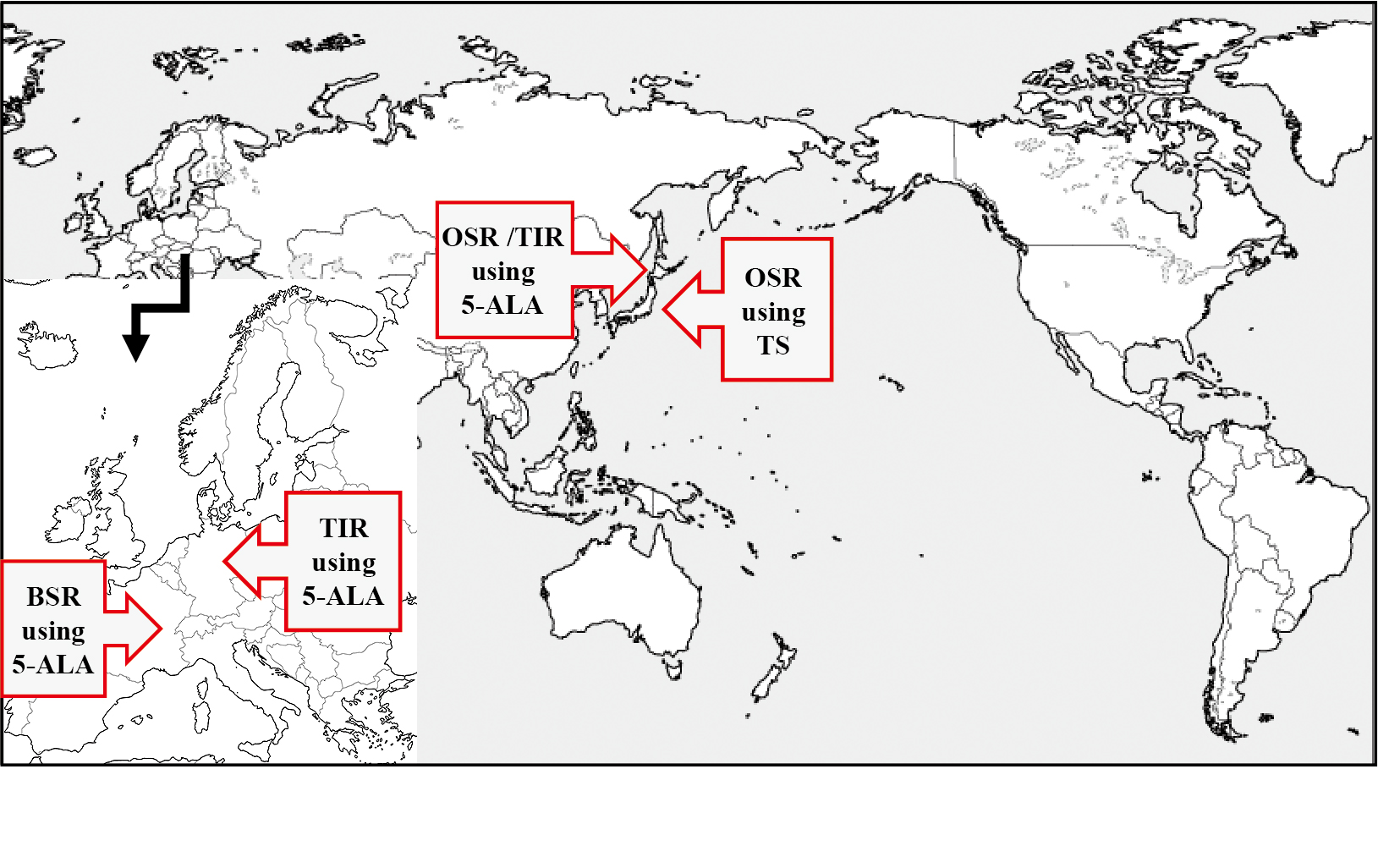
Ongoing clinical practice of PDT for malignant brain tumors
OSR: Ordinary surface irradiation, BSR: Balloon surface irradiation, TIR: Tumor interstitial irradiation, 5-ALA: 5-aminolevulinic acid, TS: Talaporfin sodium
諸外国の現状を鑑みても,悪性脳腫瘍に対するPDTがpromisingな実績を残せている方法論は,Talaporfin sodiumを用いる日本の方法と,5-ALAを投与後に腫瘍組織内照射を行うドイツの方法のみと言える.今後,ドイツはGL01 studyの総括と,NOA11 studyの結果を中心に展開してゆくであろう.著者らは現状の方法論で,すでに世界に類を見ないほどの治療成績を初発膠芽腫へのPDTとして示せており,現状の方法論をまず日本国内に隔たりなく普及させ,膠芽腫を患う全ての国民に提供できる日が来るべく,努力を続けていく所存である.一方で再発膠芽腫に対しては,まだまだ十分なPDTの有効性を示せているとは言い難く,今後は再発例に対する工夫が必要と思われる.再発例は画像診断よりも腫瘍細胞が広く浸潤していることが多く,さらに殆どの症例が放射線治療を受けていることから,薬剤の分布に関しても初発例とは多くの差異があることが予想される.著者らはこの事実に対してはi-PDTの方法が光伝播向上の面から有用ではないか56-58)と考えており,独自のレーザ光拡散fiber probeを開発中である.Probe完成の後には前臨床研究としてしっかりとしたデータを構築し,cavity interstitial PDTの第一例を遂行し得る日が来ることを期待している.
さらに言えば,腫瘍細胞のみならず,腫瘍増殖のサポートとなっている腫瘍浸潤マクロファージをもターゲットと成し得る新規光感受性物質の研究も同時進行で行なっている.膠芽腫組織にはM2マクロファージと呼ばれる腫瘍関連マクロファージTAMが多く浸潤しており,腫瘍増殖ばかりか血管新生,浸潤地盤形成に関わり,TAMの浸潤が多いほど予後が悪いことが示されている62).このM2には腫瘍攻撃性のM1マクロファージにはない,マンノース受容体をその表面抗原として有していることが知られており,著者らはこのマンノースを結合した“第三世代”光感受性物質をすでに作成し,in vitro studyでcell line毎のTalaporfin sodium PDTとの感受性の差を報告した63).しかしながら,TAMの評価を行うべき実験系としては,免疫能が維持されたin vivo studyを行うべきことが自明である.本課題の共同研究者らは,すでにマンノース結合クロリンのin vivo studyで,talaporfin sodium PDTに勝る治療効果を示しており64),今後,著者らの重要な課題として悪性脳腫瘍細胞株の移植モデルを用いたin vivo studyを早急に施行してゆきたいと考えている.
1980年の1st in human studyから40年近くに亘る,悪性脳腫瘍に対するPDTの人類の叡智が,現在の日本,ドイツ,フランスの臨床研究の発展に繋がっている.著者らはTalaporfin sodiumという日本独自の光感受性物質を用い,先逹が歩んできた道を模倣する様に,新たな治療としてのTalaporfin sodium-PDTを確立し,世界的にもpromising treatmentとしての評価をいただけるに至った.しかしながら,膠芽腫治療のmile stoneを打つことができたと言えるほどの認知度は,国内でさえまだまだ低いと思われ,今後も尽きることのない普及への努力が必要である.そして,現状では実績を残せていない再発膠芽腫例や,手術摘出不能例の治療に,どの様にPDTを組み込んでいけるかも次なる課題であると考える.その他,悪性髄膜腫や頭蓋底悪性腫瘍への展開,小児例や高齢者例への経験の蓄積など,我々は光という新たなメスを持って,悪性脳腫瘍の治療成績の更なる向上に寄与していきたいと考えている.
利益相反なし.