2021 Volume 42 Issue 2 Pages 37-43
2021 Volume 42 Issue 2 Pages 37-43
本研究では,計算機シミュレーションに基づく非臨床試験により,末梢型肺癌に対する光線力学治療用プローブを評価する.モンテカルロ法に基づく光伝搬シミュレーションにより,臨床利用が検討されている直射プローブ,側射プローブにて光照射した際の組織内光分布を算出し,それぞれの照射体積を比較した.直射プローブと比べ,側射プローブが腫瘍組織に対してより効率的にレーザー光照射が可能であることを定量的に示した.
This study evaluates photodynamic therapeutic probes for peripheral lung cancer by a preclinical trial based on computational simulation. By light propagation simulation based on a Monte Carlo method, light distributions in tissues by a direct transmission light irradiation probe and a diffused light irradiation probe were calculated to compare each irradiated volume. The simulated results demonstrated quantitatively that the diffused light irradiation probe can irradiate the tumor tissue more efficiently than the direct transmission light irradiation probe for peripheral lung cancer.
現在日本国内において保険診療下で実施可能な光線力学治療(photodynamic therapy: PDT)として,タラポルフィンナトリウムと中心波長が664 nmの半導体レーザーとの組み合わせによるPDTが挙げられる1).タラポルフィンナトリウムに対して薬事承認されている適応は,早期肺癌(病期0期又はⅠ期),原発性悪性脳腫瘍(摘出手術を施行する場合に限る),化学放射線療法又は放射線療法後の局所遺残再発食道癌である2).早期肺癌については,添付文書2)の禁忌に「肺癌において,亜区域支より末梢側に腫瘍のある患者」とあり,実質的に中心型肺癌に適応が限定されている.2020年版肺癌診療ガイドライン3)では,非小細胞肺癌において,推奨の強さ1(最も強い推奨度),エビデンスの強さC,合意率64%で,「中心型肺癌の中で,腫瘍全体にレーザー照射が可能な長径1.0 cm以下の病巣を対象に行うよう推奨する」とされており,早期肺癌に対するPDTは臨床において低侵襲治療として一定の地位を確立している.一方,末梢型肺癌についても,PDTの有効性が報告され4,5),医師主導治験が現在進行中である6).末梢型肺癌は,診断技術の向上により早期検出が可能になっているが,様々な合併症を有し,手術や放射線治療が不可能な患者に対しては標準治療がなく,無治療で経過観察をせざるを得ない3).経皮的に病変に針を刺して行うラジオ波焼灼治療(radiofrequency ablation: RFA)などの報告もあるが,一般診療で行うことはできず,また気胸などの合併症のリスクも伴う7,8).このような末梢型肺癌に対して,気管支鏡に挿入した細径の光照射プローブを介してレーザー光を照射する,経気管支的なPDTの適用が期待されている5).
PDTでは,薬剤の存在下にレーザー光を照射することにより抗腫瘍効果を得る.則ち,レーザー光の照射方法がPDT治療効果に直接的に影響する.そのため,末梢型肺癌に対するPDTでは,細径光照射プローブによる光照射性能が重要となる.これまで臨床研究により,プローブ長軸方向の前方へ照射する直射プローブ用いた,末梢型肺癌に対するPDTの有効性が示されている9).一方,気管支が狭く直射プローブによる照射領域の操作の困難性が指摘されている.狭隘な空間での効率的な光照射に向け,プローブ側面から長軸と垂直方向へ一様に光照射する側射プローブの開発が求められている.側射プローブでは,直射プローブと比較して,末梢型肺癌に対して経気管支により効率的な光照射が可能とされている10).ただし,そのPDTにおける光照射性能の比較評価は,生体組織のような吸収散乱体中の光分布を実測することが困難であることから,定性的議論にとどまっている10).今後,PDTのさらなる発展に向けて,PDTの治療対象に応じた適切な新規光照射プローブの設計や治療計画時の照射方法の検討において,組織内光分布を評価する安定した再現性のある手法の確立が必要となる.
生体組織中へレーザー光照射した際の光伝搬は,モンテカルロ法に基づく計算機シミュレーションによって確度良く計算できる11).これまでに,レーザー治療効果の比較評価への計算機シミュレーションの応用が提案されている12-14).PDTの治療効果評価に対しても光伝搬シミュレーションが活用されており,PDT作用機序の解析や光照射条件の最適化が検討されている15,16).医療機器の評価においては,近年,米国医薬品食品局(FDA)は,2016年9月にReporting of Computational Modeling Studies in Medical Device Submissionsをまとめ,医療機器の申請を支援するための計算機シミュレーション使用における正式なガイダンスを示している17).本邦においては,2019年3月にPDT用照射装置に特化してin silico評価の活用に関する基本的な考え方を示すことを目的とした「PDT機器開発ガイドライン2019(手引き)」が策定され18),医療機器製造販売承認を取得したPDT半導体レーザの評価にも計算機シミュレーションが利用されている19,20).末梢型肺癌に対するPDT光照射プローブの光照射性能の評価においても,光伝搬シミュレーションの活用が期待できる.
末梢型肺癌に対するPDT において,開発検討段階の光照射プローブに対して計算機シミュレーションを元にした非臨床試験を実施する.直射プローブと比較して,側射プローブの光照射性能を評価することを目的とする.
本研究では,開発検討段階の直射プローブ9)と側射プローブを対象とした(Fig.1).直射プローブでは,ファイバーコアからレーザー光が一様に射出されると仮定した.ファイバーコア径は0.43 mm,ビーム拡がり角は実測値から17.4°と設定した.側射プローブは,外径1 mm,射出領域長11 mmの円柱表面から一様になるようにレーザー光が射出されると仮定した.同一光源での光照射性能を比較するため,直射プローブ,側射プローブともに1回の光照射あたり,射出光の全パワー150 mW,照射時間667 sと同じ値に設定した.光波長は664 nmとした.

Schematic illustration of irradiation with (a) a direct transmission light irradiation probe and (b) a diffused light irradiation probe in PDT for peripheral lung cancer.
腫瘍形状は気管支中心に中心を置く球形と仮定した(Fig.1).腫瘍サイズの違いによる各プローブによる光照射特性を評価するために,直径10,20 mmの腫瘍サイズを対象とした.臨床条件を想定して直径10 mmの腫瘍に対しては1回照射,直径20 mmの腫瘍に対しては2回照射とした.光照射プローブはガイドシースによって気管支内腔に配置して光照射を行うと仮定した(Fig.1).気管支は直径2 mmとし,空気層と仮定した.照射プローブと腫瘍位置の関係をFig.2,および,Fig.3にまとめる.直射プローブでは,直径10 mm腫瘍に対して腫瘍手前5 mmから照射(Fig.2(a)),直径20 mm腫瘍に対して腫瘍中心手前5 mmから照射後に腫瘍手前5 mmから照射(Fig.2(b))を評価した.側射プローブでは,直径10 mmの腫瘍に対してプローブの拡散領域中心と腫瘍中心を合わせて照射(Fig.3(a)),直径20 mmの腫瘍に対して腫瘍中心後方と手前にプローブ領域が重ならないよう2回照射(Fig.3(b)),直径20 mmの腫瘍に対して腫瘍中心後方と手前にプローブ領域を1 mm重ねて2回照射(Fig.3(c))を評価した.

Irradiation conditions with a direct transmission light irradiation probe for (a) 10-mm and (b) 20-mm diameter of tumor tissue (xy plane (z = 0 mm)).

Irradiation conditions with a diffused light irradiation probe for (a) 10-mm and (b, c) 20-mm diameter of tumor tissue (xy plane (z = 0 cm)). For 10 mm tumor, the center of light emitting area is positioned at the center of the tumor tissue (a). For 20 mm diameter tumor, the light emitting area is positioned at (x, y, z) = (−0.505 cm, 0 cm, 0 cm) and (0.505 cm, 0 cm, 0 cm) not to be overlapped (b) and the light emitting area is positioned at (x, y, z) = (−0.5 cm, 0 cm, 0 cm) and (0.5 cm, 0 cm, 0 cm) to be overlapped by 1 mm at the center of the tumor (c).
光伝搬を計算するために,Fig.2,3に示す構造にて肺末梢部を模擬した3次元モデルをそれぞれ構築した.計算領域を50 × 50 × 50 mm,ボクセルサイズを0.1 × 0.1 × 0.1 mmとした.構築した3次元モデルは各部位に対応する光学特性値を割り当てた.光照射時のガイドシース内は空気と仮定した.空気層の光学特性値は吸収係数1 × 10−5 mm−1,換算散乱係数0.1 mm−1とした.正常組織と腫瘍組織の光学特性値は文献21-23)を参考に算出した値を用いた.換算散乱係数μs'(λ)は次式で表現できる.
a,bは組織ごと固有の定数であり,文献21)より肺組織における定数はa = 68.4 mm−1,b = 0.53 (no units)である.以上より,μs'(664) = 2.2 [mm−1]と算出した.吸収係数は,μa(λ)は,還元ヘモグロビン吸収係数μaHb(λ),酸化ヘモグロビン吸収係数
ここでx,SB,SWは組織ごとに求められるスケーリング因子であり,肺組織における定数はx = 0.85,SB = 0.15,SW = 0.85である21).μaHb(664) = 1.63 [mm−1]24),
モンテカルロ法に基づく吸収散乱体中の光伝播計算手法により,各条件におけるトータルフルエンスの空間分布を求めた.S. L. Jacquesらにより開発されたシミュレーションコード24)を元に,対象とする直射プローブと側射プローブを再現するように光源初期値を設定して計算した.空間グリッドサイズを100 μmとし,射出光子数は1.2 × 107とした.モンテカルロ法に基づく吸収散乱体中の光伝播計算手法は,過去にPDT用のレーザ照射装置の製造販売承認審査においても根拠資料として採用されており,レーザ照射装置の医療機器としての評価にシミュレーションを適用する際に用いられている19,20).
Fig.4に直射プローブ照射時の条件1,2におけるトータルフルエンスの空間分布の中心断面を示す.直射プローブ照射により,10 mm径腫瘍に対して1 J/cm2以上の領域にてカバーされるのに対して(Fig.4(a)),20 mm径腫瘍に対しては二回照射した場合においても1 J/cm2以下になる領域があった(Fig.4(b)).
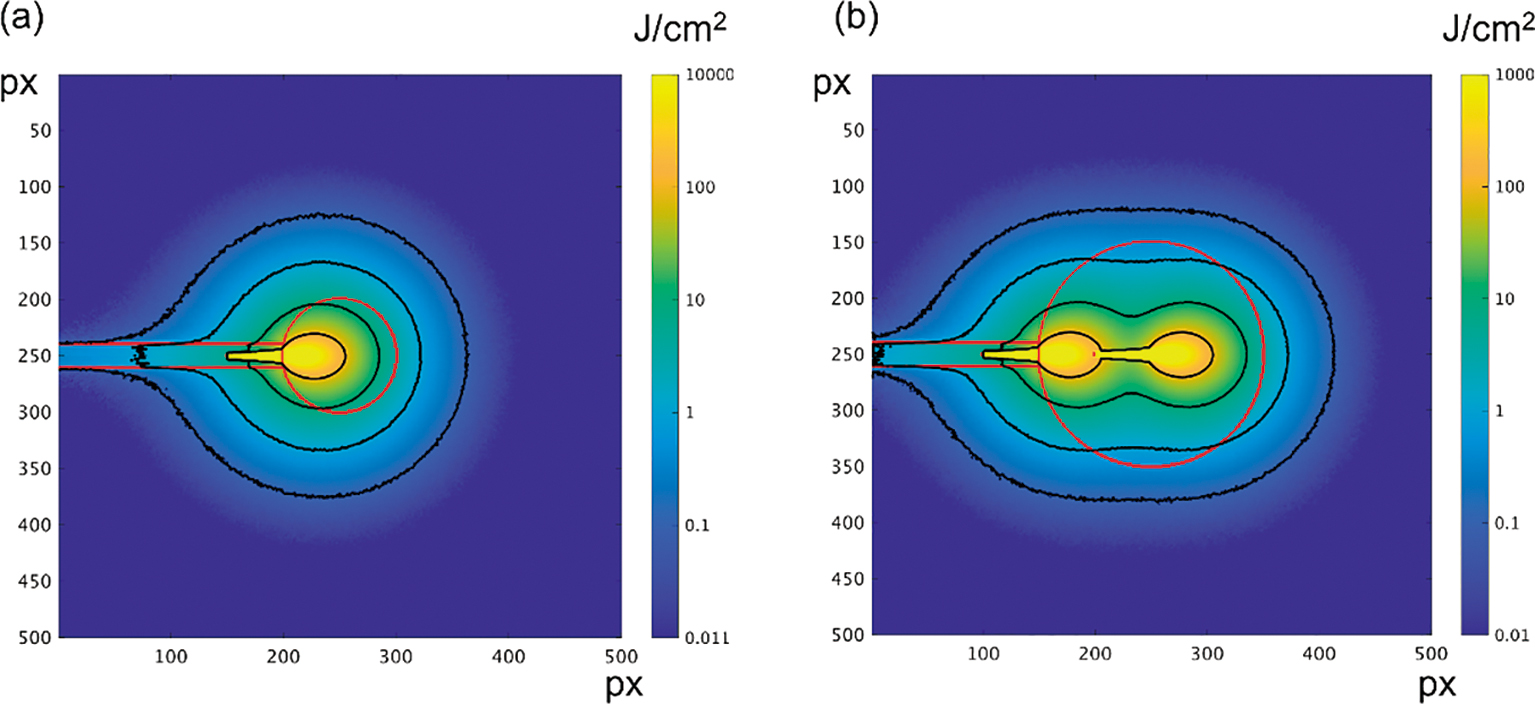
Spatial distribution of total fluence by irradiation with a direct transmission light irradiation probe. A tumor diameter is (a) 10 mm and (b) 20 mm. Red line indicates the border of each section shown in Fig.2. Black line indicates the point at 100, 10, 1, 0.1 J/cm2 from the side closer to the irradiation end.
Fig.5に側射プローブ照射時の条件3,4,5におけるトータルフルエンスの空間分布の中心断面を示す.側射プローブ照射により,10 mm径腫瘍に対して1 J/cm2以上の領域にてカバーされるのに対して(Fig.5(a)),20 mm径腫瘍に対しては二回照射した場合においても1 J/cm2以下になる領域があった(Fig.5(b), Fig.5(c)).Fig.5(b),Fig.5(c)を比較するとトータルフルエンス分布に大きな差はなく,照射位置の微量の重なりの変化は光照射領域には影響しないことが分かる.

Spatial distribution of total energy fluence by irradiation with a diffused light irradiation probe. A tumor diameter is (a) 10 mm and (b, c) 20 mm. Red line indicates the border of each section shown in Fig.3. Black line indicates the point at 100, 10, 1, 0.1 J/cm2 from the side closer to the irradiation end.
腫瘍サイズが同じ場合,Fig.4(a)とFig.5(a),Fig.4(b)とFig.5(b)を比較すると,側射プローブ照射時は直射プローブによる照射領域をカバーすることがわかる.また,Fig.5(b)と5(c)を比較すると,複数回照射による重なりによる組織内のトータルフルエンスの空間分布の変化は小さい.Fig.6,7に腫瘍サイズが10 mmと20 mmの両方の場合の直射と側射プローブ照射時における腫瘍領域内のエネルギーフルエンスと体積の関係を示す.腫瘍サイズが10 mmと20 mmの両方の場合において,直射プローブ照射時の方が最大エネルギー密度は大きいが,早期肺癌に対して定められている照射エネルギー密度2)100 J/cm2となる体積は側射プローブの方が大きい.

Relationship of total energy fluence with (a) volume ratio and (b) cumulative volume ratio in the tumor tissue for the 10-mm diameter of tumor. Blue line shows the result of irradiation by a direct transmission light irradiation probe. Red line shows the results of irradiation by a diffused light irradiation probe.
光伝搬シミュレーションによる腫瘍領域内のエネルギーフルエンスと体積割合の解析(Fig.6, Fig.7)から,本研究で対象としたプローブのうち,側射プローブによる照射の方が大きな腫瘍体積を光照射可能であることが明らかとなった.同量の光感受性薬剤が蓄積している腫瘍に対しては,側射プローブを用いたPDTの方が効率的に腫瘍細胞死を誘導できるといえる.これまでに,管腔臓器に対するPDTにおいて,本研究で対象とした側射プローブと同様のファイバー側面方向への光照射を行う照射プローブの開発,基礎研究が進められている10).肺末梢領域などの狭い領域においてファイバー軸垂直方向への照射が効率的と考えられてきているが,生体組織光学見地からの根拠は不明確であった.本稿では,気管支の周囲に腫瘍組織が発現した末梢肺癌に対するPDTを想定した各プローブの光照射性能を比較手法を示した.組織スケールの光伝搬は照射プローブの新規開発において,従来プローブとの比較を計算機シミュレーションで行うことにより定量比較が可能である.今後,医療機器開発の場面におけるPDTの治療対象に応じた適切なファイバー設計や,臨床現場における治療計画の際の照射方法の検討において,光伝搬シミュレーションの積極的な活用が期待される.

Relationship of total energy fluence with (a) volume ratio and (b) cumulative volume ratio in the tumor tissue for the 20-mm diameter of tumor. Blue line shows the result of irradiation by a direct transmission light irradiation probe. Red line shows the results of irradiation by a diffused light irradiation probe.
本稿では,光照射プローブの照射性能評価のため,光照射以外の条件やその応答は同様と仮定し,トータルフルーエンス分布により比較評価した.ただし,PDTの治療効果は光と光感受性薬剤との相互作用による細胞死誘導,バスキュラーシャットダウン,免疫賦活により得られる25).また,正常組織への光感受性薬剤の残留もあり,正常組織へのPDT効果も少なからず考慮する必要がある.これらPDT作用機序に基づいたシミュレーションによる評価により,照射プローブによるPDT作用の比較評価が期待できる.ただし,物理化学パラメータや細胞死誘導に関する生物学応答のパラメータについての検討が必要である.これらパラメータ決定・評価には,ヒトでの臨床データを用いた解析が必要不可欠である.
腫瘍の中心に気管支が通るように発現している末梢肺癌に対するPDTにおいて,直射プローブと比較して,側射プローブがより効率的に腫瘍組織へ光照射が可能であることを明らかにした.本研究における検討のように,単純な腫瘍形状かつ単純な照射方法におけるシミュレーションをあらかじめ行い,標準的な照射方法を定めておくことはPDTの有効性及び安全性を最大化するために有益と考える.一方で,必ずしも単純な腫瘍の形状や照射方法ばかりではない臨床現場において,今後PDTを普及させ,標準的な治療法としての地位を確立していくためには,患者の臨床画像情報に基づき,照射方法の適切性を施術前に確認できる治療計画プログラムの開発が望まれる.
本研究は,AMEDの研究開発課題20hk0102061h0002の支援を受けた.また筆頭著者は薬事アドバイザーとしての業務を受託しており,Meiji Seikaファルマ株式会社より報酬を受けている.