2022 Volume 43 Issue 2 Pages 59-64
2022 Volume 43 Issue 2 Pages 59-64
近年,本邦では非アルコール性脂肪肝炎(non-alcoholic steatohepatitis: NASH)が増加している.NASHは肝関連死や心血管イベント,さらに肝癌発生のリスクを上昇させる.その診断には肝生検が必要であるが,侵襲的な処置であり,新たな診断方法の開発が求められている.本稿では,光計測による脂肪肝組織診断の研究例についてまとめるとともに,当施設で取り組んでいるマウス生体肝臓に対する拡散反射スペクトル分光法の応用研究について紹介する.
Recently, the prevalence of non-alcoholic steatohepatitis (NASH) is increasing in Japan. NASH increases the risk of liver related death, cardiovascular event and liver cancer. Liver biopsy is needed to diagnose the disease, however, new diagnostic methods were required, because the biopsy is an invasive procedure. In this review, the author will discuss the studies of the optical diagnosis of fatty liver disease, and introduce our applied research of diffuse reflectance spectroscopy for in vivo mice liver.
1836年,英国のThomas Addisonによって脂肪肝(Fatty liver)が初めて報告された1).産業革命による食糧生産量の上昇を背景として栄養状態が向上したことが影響していたと考えられる.元々生物は飢餓に耐えるため,摂取した栄養を蓄積する能力を持っているが,過量に蓄積された栄養を体外に排出する機能は有していない.体内に蓄積された過量な栄養が人体で様々な不具合を引き起こす.1839年にドイツの病理医であるCarl von Rokitanskyによって,脂肪肝が肝硬変に進行することが指摘されており2),栄養過多による人体への障害が示唆されている.
1980年,米国のLudwigらによって非アルコール性脂肪肝炎(non-alcoholic steatohepatitis: NASH)の報告がなされたが3),当時はアルコールの過剰摂取が脂肪肝炎の主たる病因として堅く信じられており,非アルコール性脂肪肝炎は広く認知されなかった.その後,米国で肥満が深刻な社会問題となる中,1998年に至ってようやくNASHは新しい疾患概念として確立された.肥満,糖尿病,高脂血症などがNASHの危険因子であることから,高血圧や糖尿病,高脂血症,心血管系疾患と並ぶ代謝症候群の肝臓における表現型として注目された.実際に非アルコール性脂肪性肝疾患(non-alcoholic fatty liver disease: NAFLD)となると,肝関連死や心血管イベントによる死亡が高率になり,さらにがん発生との関連が報告されている4).NAFLDの有病率は欧米諸国で20~40%,本邦では9~30%と世界的に増加傾向にある.さらにNAFLDの中で特に重症型であるNASHの絞り込みが重要である.
元来,肝臓の脂肪沈着の評価法として,一般血液検査の他に超音波,CT,MRIによる画像診断法が用いられているが,従来の検査方法では中等度以上の脂肪沈着しか診断することができなかった.現在,超音波減衰による肝脂肪化の定量評価やMR-Proton Density Fat Fractionを用いた高精度な脂肪肝評価が行われ始めているが,十分な普及には至っていない5).
NASH診断には肝生検による組織診断が用いられるが,どのような症例に対し肝生検を行うべきかの判断はいまだ定まっていない.また肝生検を行っても,サンプリングエラーや合併症の発生,病理診断医間で診断が一致しないという問題が指摘されており,今後解決すべき課題である.本稿では,光計測を用いた肝組織診断の研究例について整理し,当施設で取り組んでいる研究を紹介する.
マウス肝臓に対して光計測を用いた先行研究として,Westerkampら6),Romeuら7)はそれぞれ近赤外領域,可視-近赤外領域における脂肪の光吸収特性を利用し,拡散反射光スペクトル分光法(diffuse reflectance spectroscopy: DRS)によるex vivoでの脂肪肝評価は有用であったと報告している.ヒトでは,Eversら8),Nilssonら9),Reistadら10)によって肝臓の脂肪沈着を評価するためにそれぞれin vivoとex vivo,ex vivo,in vivoで肝組織に対してDRSを用いたところ,病理診断と比較して遜色のない診断能力があることが示されている.2021年にMinamikawaら11)は,NAFLDモデルマウスの摘出肝組織切片にラマン分光を行い,細胞・細胞小器官レベルで脂質の分布や分子構造変化を検出できることを報告した.また,Sharminら12),Voulgarelisら13)は,可視領域のヘモグロビンの光吸収特性を利用し,DRSを用いてそれぞれラット・ブタ肝臓の組織内酸素飽和度をそれぞれin vivo,ex vivoとin vivoで評価を行った.このように様々な先行研究によって肝臓に対する光計測の有用性が示されているが,臨床診断として重要性の高い非アルコール性脂肪肝(non-alcoholic fatty liver: NAFL)とNASHの鑑別診断のための光計測の差異については,検討がなされていない.
今回我々は,NASH-HCC(肝細胞がん)モデルマウスの各病期における肝臓に対してDRSを用いて診断を行った14).同マウスは6週齢,8週齢,12週齢でそれぞれ脂肪肝,脂肪肝炎,肝線維化を来す(Fig.1).近赤外領域で脂質を評価するとともに,可視領域で肝組織内酸素飽和度を評価し(後述),炎症細胞の肝組織への浸潤が低酸素(炎症性低酸素症)を引き起こし,肝臓のヘモグロビン酸素飽和度を低下させうるとの仮説の下,炎症との相関を検討した.対照群として正常なC57BL/6Jマウス(オス)を用いた.

Overview of NASH-HCC model STAM mice clinical stage.
本研究で用いたマウス生体肝臓のDRS計測システムを示す(Fig.2a).同システムはタングステン-ハロゲンランプ(400~1,700 nm; BPS2.0; B&W Tek, Inc.),近赤外光分光器(900~1,700 nm; TG-NIR C9406GC; Hamamatsu Photonics, Inc.),可視光分光器(200~900 nm; USB4000; Ocean Optics, Inc.)と一対(照射用,検出用)の光ファイバー(コア径600 μm;ファイバー中心間隔1 mm)で構成した.ランプからのコリメート光は光量調整した上で照射ファイバーの片方端面に結合し,もう一方のファイバー端面を肝表面に接触させた.照射光量は可変減光フィルターを用い,近赤外DRSにおいては350 μW,可視光DRS(長波長吸収フィルターを用いて1,000 nm以上の波長を遮断)においては100 μWに調節した.検出ファイバーの片方を分光器に接続,他方を肝表面に接触させ,肝臓からの拡散反射光を分光計測した.拡散反射光計測の積分時間は近赤外光で1,000 ms,可視光で400 msとした.

(a) Diagram of the setup for diffuse reflectance spectroscopy (DRS) of the mouse liver. A long-wavelength-absorbing filter was used only when a VIS spectrometer was used. (b) Conceptual sketch of DRS. ND: neutral density; VIS: visible; NIR: near-infrared. Cited from Ref. 14.
マウスに対してペントバルビタールナトリウム(20 mg/kg animal weight)を腹腔内投与して麻酔した.保温マット(37°C)に仰臥位とし,開腹して肝臓を露出した.計測ファイバーの先端は,肝中葉の表面に接するように固定した(Fig.2b).拡散反射光スペクトルの計測値として2回計測した値の平均値を用いた.拡散反射光スペクトル計測後にマウスを犠牲死させ,肝切除を行い,計測部位の肝組織を採取した.
3.1.3 データ解析各グループのそれぞれマウス5例ずつを対象に拡散反射光スペクトルを計測した.測定された拡散反射スペクトルは下記の方程式を用いて相対反射率値へ変換した.
Rd(λ) = S(λ) − D(λ)/Sref(λ) − D(λ)
Rd(λ)は波長λでの相対反射光強度,波長S(λ)は波長λでの肝臓の拡散反射光強度,D(λ)は波長λでのダーク強度,Sref(λ)は波長λでの標準拡散板による基準信号強度を表している.相対的な脂肪含量と組織酸素飽和度を評価するために,それぞれ2次微分と1次微分の方程式に則って相対反射スペクトルの微分値を計算した.1次微分スペクトルを用いることで波長に依存しない背景の吸収や散乱による効果を除外することができる.近赤外スペクトル領域では,脂肪と水の吸収スペクトルは重複している.1,204 nmにおける脂肪の吸収ピークを検出するため,我々は脂肪成分による吸収よりもブロードな吸収特性をもつ水による吸収の影響(小さい波長に依存する吸収成分の効果)を減少させることができる2次微分スペクトルを用いた.可視光スペクトル領域では,酸素化・脱酸素化ヘモグロビンが優勢な発色団であり,その吸収係数は波長によって異なる.つまり,肝組織の1次微分スペクトルはヘモグロビン酸素飽和度を反映する.本研究では,570 nmと550 nmにおける1次微分値の相対的な差を用いて炎症性局所低酸素の推定を行った.
3.1.4 病理解析切除した肝臓を10%ホルマリン液で固定し,パラフィンに埋没させ,H&E染色を行った.当院の病理専門医1名が切除肝臓のH&E染色スライドをマウス用NAFLDスコアリングシステム15)に従って評価した.それぞれの肝組織におけるDRS計測部位の肝臓組織の代表的な3画像から大滴性脂肪変性(macro-vesicular steatosis),小滴性脂肪変性(micro-vesicular steatosis)と肝細胞肥大を評価し,0(<5%),1(5–33%),2(34–66%),3(>66%)点とスコアリングした.脂肪スコアは大滴性脂肪変性,小滴性脂肪変性と肝細胞肥大の合算とした.炎症スコアの評価は,炎症細胞の集簇数に応じて0(<0.5 focus),1(0.5 to 1.0),2(1.0 to 2.0),3(>2.0)点とした.肝臓の脂肪スコアが1以上かつ炎症スコアが1以上をNASHと診断した15).
3.1.5 統計解析各グループ間はウィルコクソン検定を用いて統計学的な有意差を検定した.スピアマンの相関検定を用いて1,204 nmの拡散反射光スペクトルの2次微分値と脂肪肝スコア,拡散反射スペクトルの1次微分値の差分(570–550 nm)と炎症スコアとの相関を検討した.p値が<0.05を統計学的な有意差と判定した.統計解析にはJMP 14 statistical software(SAS Institute Inc., USA)を用いた.
3.2 結果と考察 3.2.1 拡散反射スペクトル1,204 nmの2次微分値では,STAM全週齢において対照群より有意に高値となり,さらにSTAM 6週齢において最も高値を認め,他の3群と有意差を認めた(Fig.3).STAM 6週齢で最も脂肪含有が多いことが示唆された.
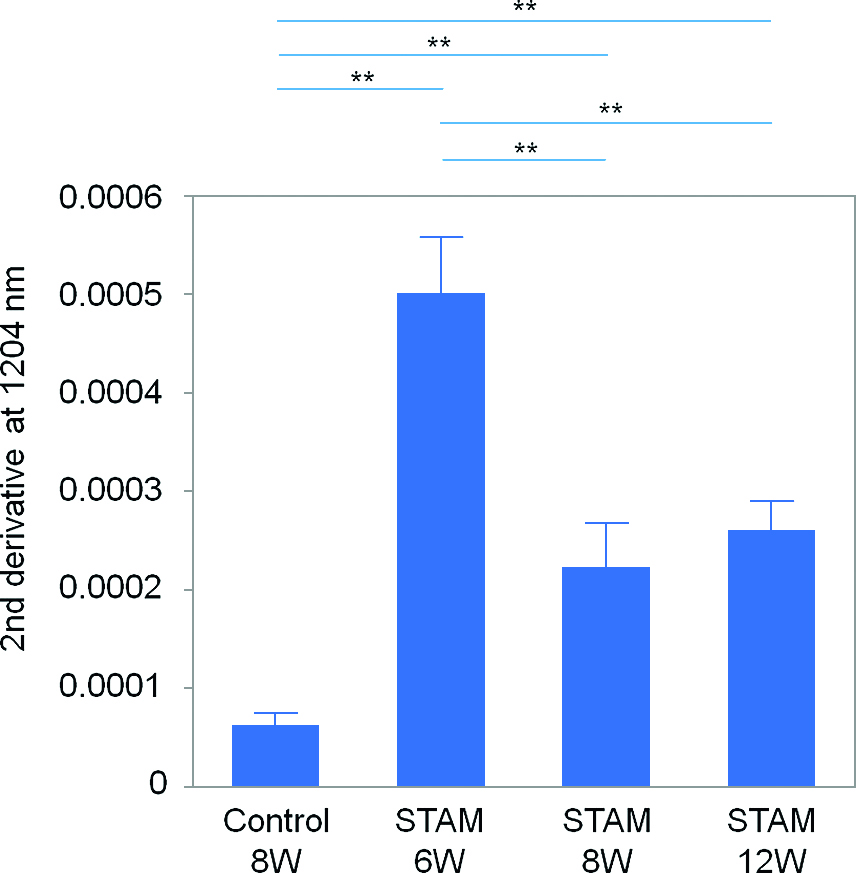
Second-derivative values at 1,204 nm for each group of mice. *p < .05, **p < .01. Cited from Ref. 14.
1次微分スペクトルの差分値(570–550 nm)では,STAM 8週齢で対照群との間に最も大きな差を認めた(Fig.4).STAM 8週齢において最も酸素化が乏しいという結果であり,脂肪肝炎による組織内の炎症性低酸素を捉えている可能性が示唆された.

Difference of the first-derivative values at 550 and at 570 nm (570–550 nm) for each group of mice. *p < .05, **p < .01. Cited from Ref. 14.
4群の代表的なHE染色標本を示す(Fig.5).STAM 6週齢(Fig.5b)で大滴性脂肪変性(破線矢印),小滴性脂肪変性(黒矢印),肝細胞の腫大(白矢印)が認められた.また炎症細胞の集簇が認められた.STAM 8週齢(Fig.5c)では炎症細胞の集簇を認めたが,STAM 6週齢と比較して脂肪滴が減少していた.STAM 12週齢(Fig.5d)では線維化を認め,脂肪滴や炎症は認めなかった.

Representative images of hematoxylin and eosin (H&E)–stained liver sections from each group of mice (original magnification ×200). (a) Control mice at 8weeks of age. STAM mice at (b) 6 weeks, (c) 8 weeks, and (d) 12 weeks of age. The black dashed line, solid line, and open arrows in panel b indicate a large lipid droplet (macrovesicular steatosis), a small lipid droplet (microvesicular steatosis), and hepatocellular hypertrophy, respectively. Black line circles in panels b and c indicate aggregation of inflammatory cells. Scale bar: 100 μm. Cited from Ref. 14.
Fig.6aとFig.6bはそれぞれマウスNAFLDスコアリングに準じた4群間の脂肪スコアと炎症スコアを示している.脂肪肝スコアはSTAM 6週齢で最も高く,STAM 8週齢と有意差を認めた.炎症スコアはControlと比較してSTAM 6週齢と8週齢で有意に高値であった.ただ,STAM 6週齢の段階では脂肪肝として炎症所見を認めないはずであったが,炎症を認めたことは想定外であった.

(a) Steatosis score and (b) inflammation score for each group of mice. *p < .05, **p < .01. Cited from Ref. 14.
拡散反射スペクトルと病理学的スコアとの相関を示す(Fig.7).Fig.7aは,今回計測した全マウスの近赤外光領域での1,204 nmにおける2次微分値と脂肪肝スコアの関連を示している.スピアマンの順位相関係数は0.9172と強い相関を示した(p < 0.0001).Fig.7bは,可視光領域での1次微分スペクトルの差分値(570–550 nm)と炎症スコアの関連を示している.スピアマンの順位相関係数は0.5260と中等度の相関を示した(p < 0.0172).可視光領域での1次微分スペクトルの差分値(570–550 nm)と脂肪肝スコア,近赤外光領域での1,204 nmにおける2次微分スペクトルと炎症スコアには有意な相関を認めなかった(データ提示なし).

(a) Correlation between the second-derivative values at 1,204 nm and steatosis scores. Spearman correlation = 0.9172 (p < .0001). (b) Correlation between the difference of the VIS first-derivative values (570–550 nm) and inflammation scores. Spearman correlation = 0.5260 (p = .0172). Cited from Ref. 14.
炎症に伴う局所の低酸素16)について好中球といった細胞の代謝量増加,血流障害,炎症誘発性サイトカインなどが影響していると考えられる.今後は肝臓組織内酸素飽和度の定量化,低酸素マーカーの病理評価を検討する予定である.
本検討によって拡散反射スペクトル分光法による肝臓の脂肪含有評価は,病理組織診断と同等であることが示された.また肝臓の組織酸素飽和度を評価することで炎症性低酸素を捉えることができる可能性が示された.すなわち本結果から,非アルコール性脂肪肝炎(NASH)の診断に拡散反射分光法が有用である可能性が示唆された.今後さらに光診断技術を医療へ応用することで新たな診断技術や治療法の開発につながることが期待される.
利益相反なし.