3. 手術への応用
3.1 肝臓領域
1981年にMakuuchiらは,超音波ガイド下にインジゴカルミンによる染色を行い,解剖学的肝切除の報告を行ったが2,3),インジゴカルミンは注入後数分で消失したり肝硬変や再肝切除症例では染色域を視認しにくいといった欠点があった.2008年にAokiらは,ICGの蛍光特性を利用し担癌門脈枝へICG投与する術中肝区域同定法ならびに系統的肝切除術の有用性を報告した4).ICG蛍光法は,ICG蛍光域と非蛍光域の境界を明瞭に描出し,簡便に肝表面の肝区域の視認を可能とする.また,Intersegmental planeのナビゲーションにも有用である.肝切除においては,1.肝区域染色,2.腫瘍同定,3.肝離断面とマージンの評価に応用されている.
3.1.1 肝区域染色
系統的肝切除は肝癌に対する標準術式であり,Couinaudの門脈支配領域により区別された領域を正確に切除する手法である.肝切除においては,複雑な解剖や多彩な解剖変位などを正しく理解することで,解剖誤認などから生じる致命的な合併症を回避することができる.そのため,術前画像評価による綿密な手術立案計画を行うことが必要不可欠である.近年,コンピュータ技術の急速な発展により,外科医自らが術前3-Dシミュレーションを作成することが可能となった.SYNAPSE VINCENT(富士フィルムメディカル)などのソフトウェアを用いた術前3-Dシミュレーションは,動静脈,門脈,胆管,腫瘍の位置関係を詳細に評価することができ,安全な肝切除遂行の一助となっている.
これまで系統的肝切除の手法として,Makuuchiらの報告したインジゴカルミンの色素を担癌門脈枝に注入し染色する色素法2)と,Takasakiらの報告した担癌領域に流入するGlisson鞘を確保し血流遮断による虚血域を認識するGlisson鞘処理法5)の2法が広く用いられてきた.いずれもデマーケーションラインを同定し,肝区域境界を視認しながら切離を進め肝内ランドマークである肝静脈を露出する方法であるが,再肝切除や高度肝硬変の症例ではしばしば色素や虚血域の認識が困難である症例が存在する.
ICG蛍光法を用いた肝区域染色法として,a.担癌門脈枝に直接ICGを注入し目的肝区域が蛍光を発するPositive staining法,b.担癌グリソン枝の血行遮断を行なった後にICGを経静脈投与を行うNegative staining法に大別される6,7).腫瘍局在,坦癌門脈の分枝形態などに応じて両者を選択する(Table 1).ICG蛍光法は,肝表面のデマーケーションのみならず,肝離断面のintersegmental planeもナビゲーション可能であることから,詳細に検討した術前立案計画を術中に正確に反映できる術中ナビゲーション法として有用であると考えられる.
Table 1
Comparison of Positive and Negative staining methods using ICG fluorescence
|
Advantages |
| Positive Staining Method |
All areas of the portal vein identifiable by ultrasound can be stained |
| Adjustable range and density |
| Additional staining is possible |
| Negative Staining Method |
Simple and clear area staining is possible when the Gleason sheath can be secured |
| Staining is possible even if the tumor-bearing portal vein branches are occluded. |
| Disadvantages |
Suitable areas |
| More difficult under laparoscopy |
Single segment, Cone unit resection |
| Fluorescence range may vary due to portal blood reflux or accidental puncture |
Superior segment |
| Injury to the Gleason sheath |
Hepatic lobe, More than 2 segments |
| Difficult to perform in cases of inflammation or adhesions |
Inferior segment |
a.Positive staining法
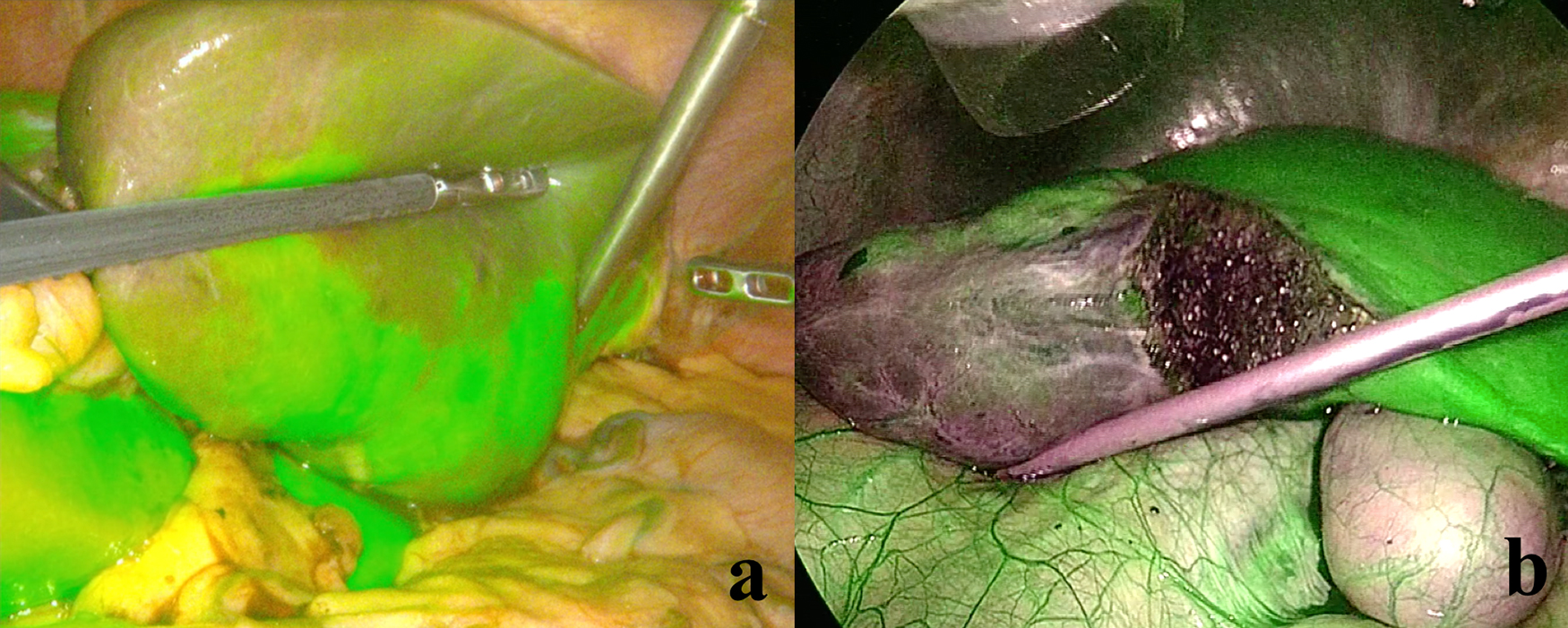
開腹手術,腹腔鏡手術でも同様に,術中超音波(Intraoperative ultrasound: IOUS)ガイド下に担癌門脈を直接穿刺しICGを局注する方法である(Fig.1, 2).我々はICG 0.025 mgを門脈枝へ投与している.Positive staining法のメリットとしてはIOUSでの担癌門脈枝が確認でき,ICGを同門脈枝に正確に局注できれば,明瞭な肝区域同定が可能となる.しかしながら,腹腔鏡下手術においてはIOUSの操作が困難なことから,門脈描出や穿刺に難渋する可能性がある.これらの問題点を解決するために,腹腔鏡下肝切除術において,Aokiらは手術直前に体外式超音波を用い0.025 mg/bodyのICGを門脈に局注する「術前陽性染色法」を報告した8).同法は簡便かつ安全に染色を行える方法であるが,細い門脈枝に対しては穿刺困難な場合があり,術中染色を選択せざるを得ないケースが存在する.手技の安定化のため今後も工夫が必要である.
肝内脈管の位置関係により担癌門脈枝の同定および穿刺が困難な場合は近接領域支配門脈を穿刺し染色するcounter-staining法を用いて区域境界を明瞭にし,陰性部分の目的肝区域を切除することも可能である(Fig.2).
b.Negative staining法
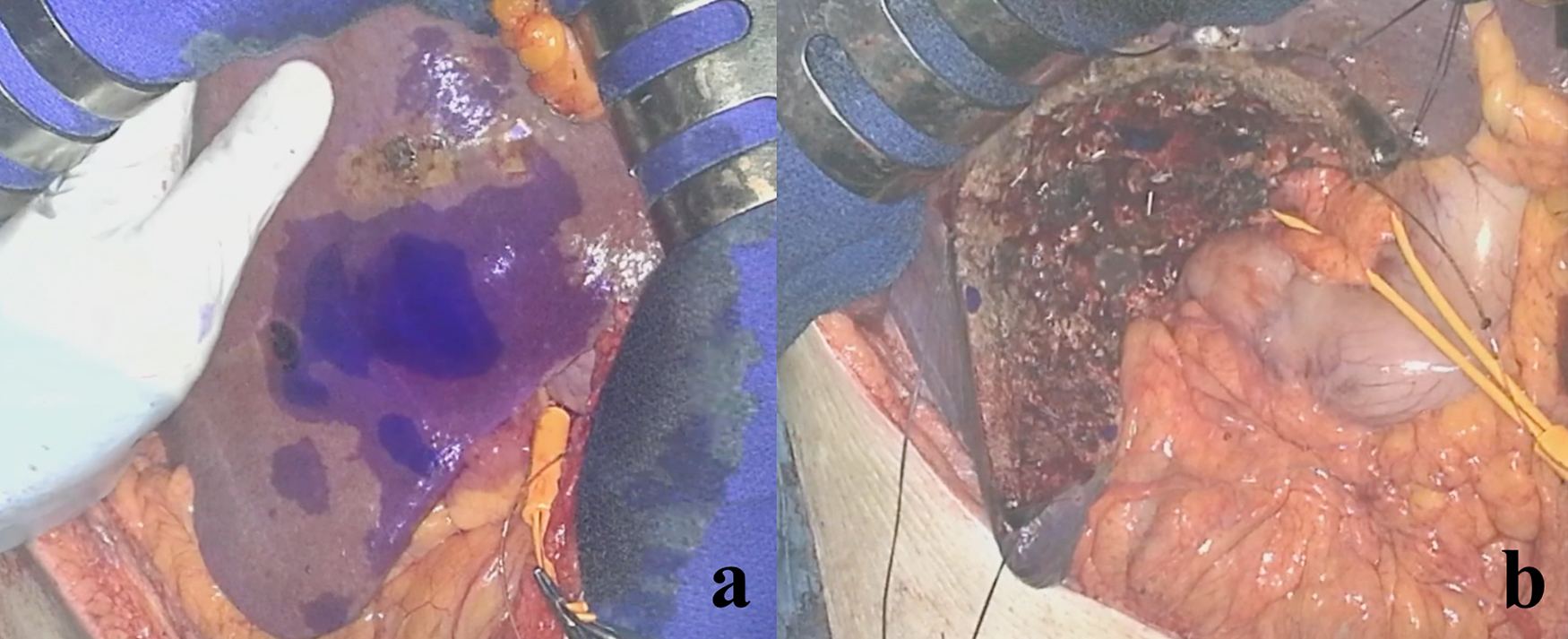
Negative staining法は,担癌門脈の血行遮断に伴う阻血を利用して肝区域を同定する方法である(Fig.3).担癌Glissonをクランプあるいは結紮した後,ICGを経静脈投与を行うことで蛍光陰性領域として切除予定区域の描出が可能となり,門脈閉塞や腫瘍浸潤がある場合でも施行可能な利点がある.一方で,Glisson先行処理を行う際に脈管や胆管を損傷するリスクがあることや,肝門部に炎症や癒着を認める場合あるいは高度肝硬変症例の場合には目標とするGlissonにアクセスが困難なことがある.
本法におけるICG投与量は,2.5 mg/bodyを選択している.ICG至適投与量に関してはいまだコンセンサスが得られていない状況であるが,今後ICG至適投与量についての統一見解が期待される9).
3.1.2 腫瘍同定
ICGは胆汁排泄性の色素であるが,肝細胞癌や転移性肝癌において腫瘍部位で明瞭なICG蛍光発色が観察される.2009年にIshizawaらは,術前投与したICGが肝腫瘍内部や腫瘍周囲に停滞し,近赤外線カメラで照射するとICG蛍光を腫瘍局在として認識できることを報告した.高分化肝細胞癌では癌組織の内部にICG蛍光発色を認め,低分化肝細胞癌では腫瘍周囲の非癌部肝実質にリング状にICG蛍光発色を認める傾向にあり,大腸癌肝転移と肝内胆管癌は腫瘍周囲にリング状の蛍光パターンを呈したと報告している10).肝細胞癌の分化度により細胞内の取り込みに関与するトランスポーター発現や胆汁排泄の異常,腫瘍周囲の細胞密度に起因する蛍光パターンが異なることでさまざまな蛍光パターンを呈することが示唆されている11).中~高分化の肝細胞癌では腫瘍に取り込まれたICGの排泄障害のため腫瘍内に滞り,低分化肝細胞癌や転移性肝腫瘍では腫瘍細胞内にはICGは取り込まれず,ICGを取り込んだ周囲の正常肝細胞が腫瘍に圧排され胆汁排泄が滞るため腫瘍周囲に停滞するとされている10).肝硬変や高度な肝障害の症例ではICG排泄が低下し肝臓全体が蛍光を発してしまうことや,ICGに蛍光染色される偽陽性腫瘍が38~50%程度で存在することがある6,10,11)ため,画像評価や術中超音波など他モダリティを併用し十分な腫瘍診断が肝要である.
本邦においては,術前肝機能評価ならびに肝切除許容量の判断根拠として外来受診時や手術計画の段階でICG 15分血中停滞率を測定することが多い.そのためICG投与量は術前肝機能評価量の0.5 mg/kgが多く使用され,また投与時期は術前48時間から14日以内に行われることが多い.Fig.4に,ICG蛍光法を用いて術前に把握できなかった新規病変を検出し得た症例を示す.本症例の様に術前CTやMRIで描出されなかった病変や,化学療法で縮小した病変などの検出にもICG蛍光法は有効である.肝硬変を伴う場合は,術直前のICG投与により肝全体が染色されていることがあり,ICG投与は少なくとも術前1週間以上空けることが望ましいと考えている.
3.1.3 肝離断面とマージンの評価
転移性肝癌に対する肝切除は,腫瘍部位や個数,脈管との位置関係によって部分切除か系統的切除を選択する.部分切除において切除マージンの確保が重要であり,特に腫瘍背側の切離時においては,腫瘍露出に注意を要する.開腹手術では触診をしながら切離が可能である一方,触覚に乏しい腹腔鏡手術においては触診の併用が困難であるため,常に切離面と腫瘍の位置関係をIOUSや術前シミュレーション画像などモダリティを用いながら把握する必要がある.また,ICG蛍光法は肝腫瘍を蛍光発色させるため,サージカルマージンを確保するための有用なモダリティであると考えられている.Aokiらは,術前ICG投与が行われた肝部分切除術において,腫瘍周囲に観察されるICG蛍光帯は,肝細胞癌に比較し転移性肝癌での蛍光帯が狭いことを報告した12).確実なサージカルマージン確保には,腫瘍周囲のICG蛍光帯を残肝側に残さないように切除することが望ましい.そのため,肝離断中の切離面蛍光が出現する場合は,腫瘍露出のリスクがあると考えている13).ICG蛍光法は,特に触覚の欠如や視野制限が伴う腹腔鏡下肝切除にて腫瘍学的に完全切除するための有用なナビゲーションツールと思われる.
3.1.4 新しいICGナビゲーション
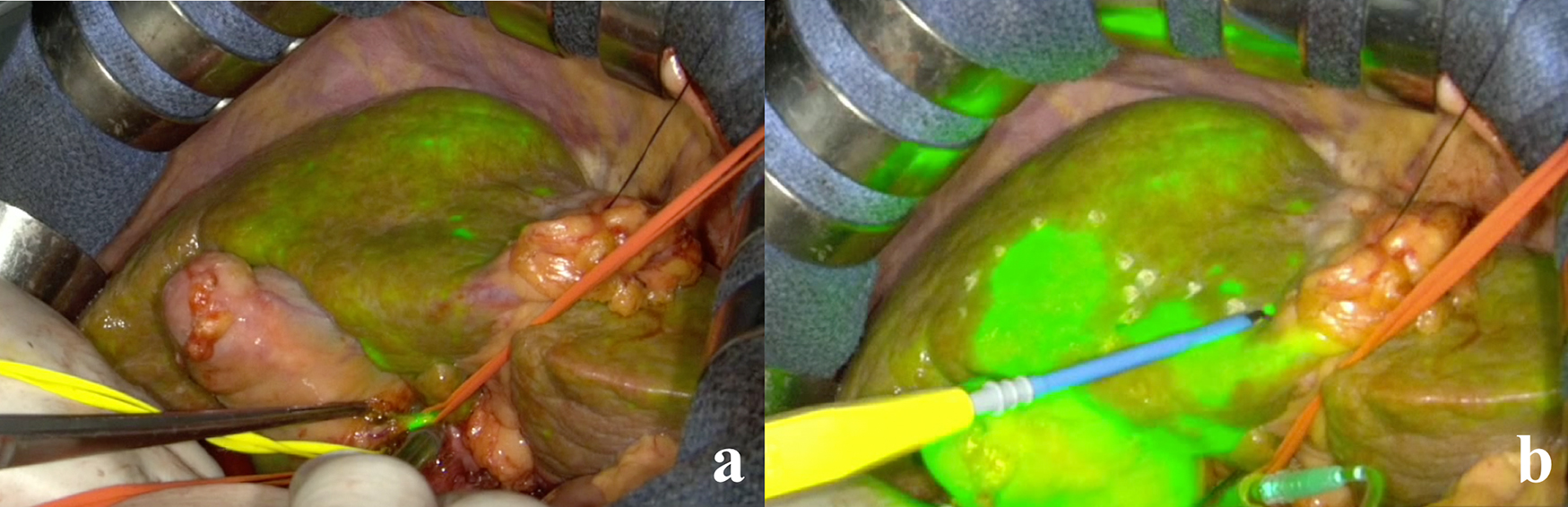
開腹手術における新たなICGナビゲーションシステムとして,プロジェクションマッピングを応用したMedical Imaging Projection System(MIPS)が2018年にNishinoらにより報告された14).これまでの開腹肝切除におけるICGカメラを利用したナビゲーションでは,術野とカメラ画像モニターとの視野の移動の煩雑性や,無影灯に含まれる白色光の干渉によりICG発光が減弱するといったデメリットが存在した.MIPSは,リアルタイムにICG蛍光情報を術野へ直接プロジェクションマッピングを行う手術支援装置である.そのため視野移動が不要となり,直感的なリアルタイムナビゲーションが行える.また,肝臓の移動や肝実質切離に伴う変形にリアルタイムに追従し,持続的に直接ICG蛍光発色をリアルタイムに投影する.適宜ICG蛍光の投影を中断したり様々な色調に変化させたりできるMIPS独自の利点も存在する.Fig.5に,術中超音波を用いて担癌門脈へのICG局注を行い,MIPSを用いて肝区域同定を行った症例を示す.リアルタイムに肝表面のデマーケーションラインを描出し,さらに切離面での蛍光・非蛍光領域を確認しながら切除を進めることができ正確な系統的肝切除を行った.MIPSは開腹肝切除術において未来のColor-coded surgeryを予見させるリアルタイムナビゲーションとして今後さらなる応用を期待される.
3.2 胆道領域
胆嚢摘出術が頻度の高い手術の一つであり,本邦では1990年代に腹腔鏡手術が導入されて以来,腹腔鏡下胆嚢摘出術(Lap-C)が標準手術となっている.腹腔鏡手術の最大のメリットは創部が小さく疼痛が少ないため早期離床・早期社会復帰が挙げられるが,一方で胆管損傷などの術中偶発症も少なくない.胆道疾患における腹腔鏡手術でのICG蛍光法の応用は,2008年にIshizawaらが報告したICG静注による術中蛍光胆道造影法15)を皮切りに,AokiらのICG蛍光法を用いた胆道造影16),VlekらによりICG蛍光法によるCalot三角部の胆管分岐の視認が可能であることが報告され17),Lap-CにおけるICG蛍光法の有用性が示された.術前MRCP画像で解剖学的胆管破格のある症例や胆管描出が不明瞭な症例,胆嚢の炎症が強くCalot三角周囲の炎症性変化や癒着に伴う偏位が疑われる症例,手術中にCritical view of safety18)の作成が困難な症例には,ICG蛍光法を用いた術中リアルタイムナビゲーションを行い,胆嚢,胆嚢管および総胆管を明瞭化することで,術中胆管損傷などのリスク軽減につながると考えられる.
胆嚢癌に対する至適肝切除の際もICG蛍光法を有効に用いることができる.胆嚢動脈を穿刺しICGを注入することで,胆嚢静脈還流領域の評価ならびに至適肝切除を施行することが可能である.
3.2.1 ICG蛍光法を用いた術中胆管評価
ICG蛍光胆道造影法は,間接的胆道造影法としてICGを全身投与する静脈注射法と,直接的胆道造影法としてICGを胆嚢内に注入する胆嚢穿刺法および胆管内に直接注入する胆管注入法がある.
a.間接造影法
静脈注射によるICG蛍光胆道造影法は,ICGが肝代謝を経由し胆汁排泄される特性を利用した方法である.ICG投与量およびタイミングについてはいまだ議論を要するが,ICGの胆汁排泄性を利用し手術開始30~60分前にICG 2.5 mgを静注する方法や16,19),執刀16時間前の投与により良好な胆管視認性が得られるといった報告もあるが20),いまだ統一したコンセンサスが得られていない.ICG至適投与量とタイミングの確立が今後の課題である.静注法の最大のメリットはその簡便さであるが,一方で,胆嚢管や胆嚢頚部で結石嵌頓している症例や高度炎症症例,肥満症例などでは胆嚢管や胆嚢の描出が不十分となることがあるため注意を要する.胆管走行破格が術前に把握できた症例に対し,ICG静注法を用いた症例を提示する(Fig.6).術前の画像評価で胆嚢管が右肝管から分岐しており,ICG蛍光法により術中に胆管走行を明瞭に描出し,確実に胆嚢管を処理し安全にLap-Cを施行し得た.
b.直接造影法
胆嚢穿刺あるいは経皮経肝胆嚢ドレナージ(PTGBD)チューブなどからICGを注入し,胆管造影を行う方法である.急性胆管炎・胆嚢炎診断ガイドライン2018(Tokyo Guideline 2018)の重症度判定基準で中等度以上の症例に関して,PTGBDを先行しチューブを留置したまま待機的外科手術を行うことも少なくない21).PTGBDカテーテルから投与する場合は,0.025 mg/mLのICGを注入する.炎症や胆石により胆嚢が緊満し把持困難となり手術進行が困難な症例では術中に穿刺針を用いて胆嚢を穿刺し胆汁吸引を行い,吸引した胆汁と0.025 mg/mlのICGをあらかじめ混和し胆嚢内へ注入する.直接法では注入直後よりICGは胆汁と混和され胆嚢は速やかに蛍光発光し,肝臓は造影されないため静注法よりもコントラストが強調され視認性は優れている.一方で,間接造影法と同様に,結石頸部嵌頓などで胆管閉塞・圧排された症例では胆嚢管や総胆管が造影されない欠点がある.
従来の放射性造影剤を用いた胆道造影法は,手術室内へX線撮影装置を搬入し操作する必要があり放射線被曝も伴う.それに比較し,ICG蛍光法は簡便に施行可能でありリアルタイムに胆管走行の評価が行える術中ナビゲーションである.
3.2.2 胆嚢癌に対する胆嚢静脈還流域の評価
根治的胆嚢癌手術において肝浸潤や肝内微小転移は注意すべきであり,至適肝切除を付加した術式が検討される.ICG蛍光法を応用した胆嚢静脈還流領域の評価は,至適肝切除領域を描出することが可能であり胆嚢癌のテーラーメイド外科手術に寄与できるとされている.Fig.7にICG蛍光法を用いた根治的胆嚢癌手術症例を示す.手術中に胆嚢動脈を同定し,カニュレーションを行なった後に0.25 mg/mLのICGを動注し,肝表面に観察される蛍光領域に基づき切除を行った.胆嚢癌が門脈域内へ侵入する経路は,肝実質直接浸潤や胆嚢静脈・リンパ管を介した経路や肝十二指腸間膜浸潤を介する経路の存在が明らかになりつつあり,胆管因子やリンパ節因子,再発形式,長期予後を含め今後更なる症例蓄積と検討を要する.