2024 年 23 巻 2 号 p. 50-63
2024 年 23 巻 2 号 p. 50-63
The selective separation of radioactive ions is essential for reducing and cleaning radioactive wastes. Among the radioisotopes to be removed, 90Sr poses a major threat to human health and the environment. However, the removal of 90Sr from environmental wastewater is still challenging owing to the difficulty in separating 90Sr2+ from Ca2+. Here, we developed a series of isostructural lanthanide–oxalate frameworks (LOFs) comprising oxalate and eight kinds of lanthanide (Ln) ions, i.e., from samarium (Sm) to thulium (Tm), for application to the selective removal of 90Sr from wastewater using its tuned porous structure. The LOFs had ion exchangeable anionic pores, in which the pore size changed in a stepwise manner depending on the host Ln species. When Tb was the host Ln of the LOFs, the LOFs showed extremely high Sr2+ selectivity and were able to distinguish the subtle difference in ionic radius (0.2 Å) between Sr2+ and Ca2+. The Sr2+ selectivity was higher than that of conventional adsorbents. The pore size tuning of the LOFs by selecting the constituent Ln species yielded a highly ion-selective adsorbent material. This novel strategy will be useful in developing custom porous materials that are easy to prepare and applicable across various fields.
原子力の分野では,放射性物質を適切に処分もしくは再利用するとともに,施設外への漏えいや拡散を防止するため,放射性物質を選択的に分離・回収する技術が開発されてきた1~4)。主要な核分裂生成物の一種であるストロンチウム90の半減期は28.8年であり,カルシウムイオン(Ca2+)との類似性により骨などに残留して内部被ばくを起こす可能性があるため,人の健康や環境にとって大きな脅威となることが知られている4,5)。福島第一原発の例にみられるように,放射性物質を含む汚染水に海水や地下水が混入してしまった場合,Ca2+,Mg2+,K+,Na+,また非放射性Sr2+等の競合イオンが多く含まれることになる6~9)。特に,Sr2+とCa2+は化学的性状やイオンの大きさが非常に似ており,両者を区別して分離することは非常に困難である。例として,福島第一原発における発電機施設内の2023年の滞留水における90Sr2+とCa2+の比率を考えると,Ca2+の化学濃度が数ppmであるのに対して,90Sr2+の化学濃度はその10−3以下程度であり,非常に多くのCa2+が存在する環境で90Sr2+を分離する必要があることがわかる7)。さらに,現状では90Srと非放射性Sr2+を区別できる吸着剤はなく,非放射性Sr2+の存在も考慮する必要がある8)。地下水や海水にはCa2+に比べて少ないがSr2+も存在する。福島県における地下水と一般的な海水におけるSr2+に対するCa2+の比率(Ca2+/Sr2+)はそれぞれ約47,100である8,9)。このように地下水や海水を含む廃水から90Sr2+を除去する場合,一般の吸着剤では非常に多くの競合イオンを同時に吸着して,膨大な吸着剤を消費することになる8,10)。使用済みの吸着剤は二次廃棄物となり,さらなる処理や保管を必要とする。これら点から,イオン選択性をもつ吸着剤の開発および利用は非常に重要である。もし吸着剤のSr2+に対するイオン選択性が二倍になれば,吸着剤使用量を半減できるため二次廃棄物の低減につながる。
現在までに,90Sr2+選択的吸着剤がいくつか開発されている。除染のために大量合成できる材料では,Sr2+の吸着には天然ゼオライト(クリノプチロライト)や合成ゼオライト(ゼオライトAやX)が利用されているが,ゼオライトAはCa2+よりもSr2+を優先的に吸着し,Sr2+はCa2+の約4倍の選択性を示すことが報告されている11,12)。ゼオライトはオングストロームスケールのカゴ型またはトンネル型の細孔をもつ結晶性無機化合物であり,細孔径とイオン選択性に相間があることを示す研究結果が報告されている13)。ナトリウム(Na+)よりSr2+を優先的に吸着する物質としてチタン酸Naが知られている。チタン酸Naは層状構造をもち,層間に存在するNaとSr2+がイオン交換することでSrが吸着する。層間距離と層内表面電荷が主に選択性に寄与していると考えられている14)。チタン酸Naを原料とするSr-treatと呼ばれるSr2+吸着剤があるが,Ca2+に対して1.4倍の選択性であることが報告されている8)。このような現状において,Sr2+に対して高い選択性をもつ材料はいまだ開発の余地がある。
ゼオライトやチタン酸Naにおいて細孔や層間サイズがSr2+選択性に関与している例からもみられるように,化学的性質が類似した金属イオンを選択的に分離するためには,精密なサイズ認識による分離が重要な概念の1つである15~17)。しかし,Sr2+をCa2+から分離するためには,両者のイオン半径の非常にわずかな差,約0.2 Åを精密に認識する必要がある18)。精密に細孔サイズを制御可能な材料として,クラウンエーテルやカリックスアレーンなどの大環状化合物が知られている15~17)。これらの細孔サイズは,環を形成するC,N,O等の原子数が変わるように設計して化学合成することで制御される。今までに,大環状化合物である4,4′(5′)-bis(t-butyl-cyclohexano)-18-crown-6を用いた分析用のSr2+分離材料が実用化されている19)。しかし,精密な大環状化合物の合成には高い技術力を必要とし,収率も低い場合が多い。そのために大量合成の困難性や高いコストが課題である。
本研究では,簡便かつ精密に孔径を制御する方法として,ホスト金属イオンと配位子の自己組織化によって形成される結晶性多孔質材料である配位高分子(Metal-Organic Framework : MOF)を用いる。MOFは,金属イオンと有機配位子の自己組織的な相互作用により形成するジャングルジムのような連続的な細孔構造(フレームワーク)をもつ材料である。金属イオンと配位子の選択により,様々なサイズ,形状,化学的性質をもつ多様な内部微細孔が得られるため,細孔の精密制御が可能な材料として近年注目されている材料である20~28)。さらに,有機物と無機金属イオンのハイブリッド材料であることに起因し,有機高分子のような柔軟性をもちながら,無機物のような硬い結晶構造をあわせもっている。そのため,ゼオライト等の結晶性無機化合物とは異なり,溶液等の条件に応じて敏感にその構造を変えることも多く知られている21)。一方,そのような柔軟性により,わずかな水蒸気や水に対して不安定なMOFも多い21)。我々は以前の研究で,シュウ酸とテルビウム(Tb)からなる水に安定なMOFの開発に成功し,水溶液中で鉛(Pb2+)イオンの選択的な分離を行うことに成功している22)。Pb2+とSr2+はイオン半径が近いことから18),このMOFの細孔サイズをサブオングストロームで微調整できれば,Sr2+とCa2+の分離に適した細孔サイズをみつけることができると着想した。そこで,サブオングストロームで段階的にサイズを調整した一連の多孔質材料の開発を目指した。
Tbはランタノイド群(Ln)の一種である。Lnは,物理的・化学的性質が似ているfブロック元素群であり,そのイオン半径は原子番号が上がるにつれ段階的にサブオングストロームオーダーで減少する(一般にランタノイド収縮と呼ばれる)18)。我々が開発した水に安定なMOFのホスト金属イオンとして一連のLnを用いることにより,サブオングストロームレベルで細孔を微細に調整できると着想した(Fig. 1)。本研究では,ホスト金属イオンとしてテルビウムを含む8種類のLn(サマリウム(Sm,原子番号(AN) = 62),ユーロピウム(Eu,AN = 63),ガドリニウム(Gd,AN = 64),テルビウム(Tb,AN = 65),ディスプロシウム(Dy,AN = 66),ホルミウム(Ho,AN = 67),エルビウム(Er,AN = 68)およびツリウム(Tm,AN = 69))からなる一連のMOF群を作成した(Fig. 1)本研究では,この一連のMOF群をLanthanoid oxalate frameworks(LOFs)と呼び,LOFを利用して90Srと海水や地下水が混在するような廃水から90Srを選択除去する吸着剤を開発した。本研究で用いるLOFは非常に簡易なワンポット水熱合成で高収率に得られる化合物である。Ln種を原料に用いるために,現時点において原材料コストは考慮すべき課題である。しかし,90Srなど放射性物質の分離・回収においては,吸着剤の製造コストだけではなく,二次廃棄物の処理,保管に関わるコストや,その後の取り扱いの安全性等も考慮する必要がある。本研究では,LOFの吸着性能に加え,吸着したSr2+の脱着性も評価し,LOF吸着剤の再利用性についても検討した。

Schematic illustration of sub-angstrom pore size tuning and selective Sr adsorption of LOFs
The pore sizes of the LOFs can be controlled at the most selective size for Sr adsorption by the lanthanide contraction of host metal ions.
塩化Ln六水和物(LnCl3·6H2O,Ln = Sm,Eu,Gd,Tb,Dy,Ho,Er,またはTm),塩化Sr六水和物(SrCl2·6H2O),塩化アンモニウム(NH4Cl),塩化Na(NaCl),塩化カリウム(KCl),塩化マグネシウム(MgCl2),塩化Ca二水和物(CaCl2·2H2O),Sr2+標準溶液(1 mg mL−1)およびCa2+,Mg2+,Na+,K+の混合金属標準(0.1 mg mL−1)溶液は富士フィルム和光純薬工業㈱より購入した。シュウ酸ジメチルは,東京化成工業㈱から購入し,ジクロロメタンから再結晶させて使用した。ゼオライトAおよびX(それぞれ,A-4およびF-9 14~20メッシュ)は,東ソー㈱から購入した。
2. LOF-Ln-NH4の合成LOF-Ln-NH4(NH4[Ln(ox)2]-H2O, ox = oxalate, Ln = Sm, Eu, Gd, Tb, Dy, Ho, Er, or Tm)は,水熱反応により合成された。すべてのLOF-Ln-NH4サンプルは以下に説明するように,同じ手順で合成された。シュウ酸ジメチル(3.0 g),LnCl3·6H2O(3.0 g),NH4Cl(6.0 g)および水(50 mL)の溶液を,50 mLのテフロンライニングのオートクレーブ反応容器に入れ,この溶液を130°Cで24時間加熱し,ブロック状の無色結晶を集めた。水(5 mL),エタノール(5 mL,3回),アセトン(5 mL)で3回洗浄し,その後60 °Cで18時間乾燥した。LOF-Ln-NH4の元素分析,収率,結晶学的パラメータをAppendix Table S1, S2にそれぞれ示す。
3. LOF–Ln–Srの合成LOF-Ln-Sr(Sr0.5[Ln(ox)2·6H2O], Ln = Sm, Eu, Gd, Tb, Dy, Ho, Er, or Tm)を得るために,LOF-Ln-NH4(200 mg)をSrCl2(50 mmol L−1,20 mL)の水溶液中で2週間撹拌した。試料をろ過し,水(5 mL),エタノール(5 mL,3回),アセトン(5 mL)で3回洗浄し,空気中で乾燥させた。LOF-Ln-Srの元素分析値をAppendix Table S3に示す。LOF-Ln-Srシリーズは同型構造であったため,LOF-Ln-Srの構造パラメータをRietveld解析した結果をAppendix Table S4, S5に示す。
4. LOF–Tb–Caの合成LOF-Tb-NH4(200 mg)をCaCl2(50 mmol L−1,20 mL)中に2週間入れた後ろ過し,水(5 mL),エタノール(5 mL,3回),アセトン(5 mL)で3回洗浄し,空気中で乾燥させてLOF-Tb-Ca(Tb基準で収率98%)を得た。LOF-Tb-Caの元素分析をAppendix Table S6に示す。
5. 吸着実験吸着測定は,濃度0.01から50 mmol L−1のSrCl2水溶液を用いて実施した。LOF-Ln-NH4(20 mg)をSrCl2水溶液(2 mL)に加え,pH制御を行わずに室温で撹拌した。上澄みを抜き取り,ICP-OESでSr2+の濃度を測定した。また,各サンプルにおいて,Sr2+の初期濃度を誘導結合プラズマ-光学発光分光分析(ICP-OES, 700Series ICP-OES, Agilent Technologies Ltd., USA)で測定した。
吸着容量Q(mg g−1)は,(1)式により算出した:
| \begin{equation} Q = \left((C_{i} - C_{e}) \times \frac{V}{1{,}000}\right) \times \frac{1}{M} \end{equation} | (1) |
ここで,V(mL)は溶液の体積,M(g)は試料の重量,CiとCe(mmol L−1)は水溶液中の初期と平衡に達した後のSr2+の濃度である。
除去効率値(Reff(%))は,吸着剤試料(20 mg)を0.01 mmol L−1 SrCl2水溶液(2 mL)に加えることで,以下の(2)式に従って算出した。
| \begin{equation} R_{\textit{eff}}\ (\%) = \frac{(C_{i} - C_{t})}{C_{i}} \times 100 \end{equation} | (2) |
ここで,Ct(mg L−1)は,それぞれ時間t(min) = 0,2,5,10,20,40および120分反応後の水溶液中のSr2+濃度である。
イオン選択性に加えて,分配係数(Kd)と最大吸着容量(Qmax)は吸着剤としての重要な特性である。LOF-Tb-NH4のKdは,競合イオンを含まない濃度0.1 mmol L−1のSrCl2水溶液を用いた吸着試験により,以下の(3)式に従って算出した。
| \begin{equation} K_{d} = \frac{(C_{i} - C_{e})}{C_{e}} \times \frac{V}{M} \end{equation} | (3) |
ここで,Na+,K+,Mg2+,Ca2+およびSr2+混合溶液における吸着物性は,LOF-Ln-NH4(20 mg)をNa+,K+,Mg2+,Ca2+およびSr2+の各イオンの濃度が0.1 mmol L−1の水溶液(2 ml)を使用して調べた。各種吸着剤のCa2+に対するSr2+イオン選択性試験では,LOF-Ln-NH4(20 mg)と海水と同程度の濃度のSr2+(0.1 mmol L−1)とCa2+(10 mmol L−1)の混合溶液(10 ml)を用いた吸着試験により試料中のSr2+とCa2+の濃度を測定し,以下の(1)式を用いてSr/Caの濃度比を求めた。
| \begin{equation} \textit{Sr}/\textit{Ca} = \frac{C_{\textit{Sr}}}{C_{\textit{Ca}}} \end{equation} | (4) |
ここで,CSrおよびCCa(mg L−1)は,反応後の吸着剤F中のSr2+およびCa2+の濃度を示す。
6. 構造解析およびその他の測定LOF-Ln-NH4の結晶構造は,X線発生器(MicroMax 007HFまたはVariMax,Rigaku)およびCCD(Saturn 724,リガク)を備えた回折計(AFC 10,リガク,日本)を使用した単結晶X線回折(XRD)によって決定されました。測定は143 KでMo-Kα線源(λ = 0.71073 Å)を使用した。すべての解析は,Yadokari-XG 2009ソフトウェア29)を使用し,構造は直接法によって解析した。最小二乗精密化は,SHELX-9730)を使用した。LOF-Tb-Srの結晶構造は,粉末X線回折装置(MiniFlex600,リガク,Cu-Kα線源(λ = 0.15418 nm))を使用した。回折データは,3°~60°の2θで0.02°の間隔で測定した。LOF-Tb-Srの構造は直接法で求めた構造パラメータをもとにリートベルト解析することで精密化した。本研究で用いた,すべての粉末X線データは,この測定と同じ装置(MiniFlex600,リガク)を利用して3°~60°の2θで0.02°刻みで測定した。フーリエ変換赤外スペクトルは拡散反射ユニット(DR-81,JASCO)を備えた分光反射率計(FT/IR-6600,JASCO,日本)を用いて室温で測定した。なお,LOFの構造解析結果については,参考データとしてJ-Stage Dataにcifファイルを公開している。
LOF-Ln-NH4のSr2+吸着は,SrCl2(0.1 mmol L−1)水溶液を用いた吸着試験により検討した。LOF-Ln-NH4は,ホストLn種によらず,すべて99%以上のSr2+を水溶液から高効率で吸着した(Fig. 2(a))。LOF-Ln-NH4では,Sr2+はNH4+とのイオン交換により吸着されると考えられる。例としてLOF-Tb-NH4中のNH4+をすべてSr2+に交換した場合,LOF-Tb-NH4の組成から,理論吸着容量は118 mg g−1である。吸着試験により,LOF-Tb-NH4のSr2+に対するQmaxは117 mg g−1(Fig. 2(b))と推定された。これは理論値(118 mg g−1)とほぼ一致しており,LOF-Tb-NH4中のすべてのNH4+カチオンは定量的にSr2+と交換できることが明らかとなった。Sr2+とNH4+の価数が異なるため,各Sr2+イオンは2つのNH4+イオンと置換されていることがわかる。その他8種類の希土類元素を用いた場合においても,Sr2+の吸着によりLOF-Ln-NH4に含まれていたNH4+イオンが置換しており,その構造はSr0.5[Ln(ox)2(H2O)6]となった。以下Sr2+に置換したLOFsをLOF-Ln-Srと呼ぶ。詳しいLOF-Ln-Srの構造や構造変化についてはセクション5-7で説明する。

(a) Reff for Sr2+ of LOF–Ln–NH4 obtained by using an aqueous solution of Sr2+ (0.1 mmol L−1). The Reff values were calculated from the ion concentration of the supernatant after the adsorption reaction for 120 min, (b) Adsorption isotherms of LOF–Tb–NH4 for Sr2+
0.1 mmol L−1のSr2+,Na+,K+,Mg2+,Ca2+を含む溶液を用いて,LOF-Tb-NH4のSr2+選択性を評価した(Fig. 3(a))。Sr2+,Ca2+の40分後のReffは99.9%,99.0%であり,K+,Mg2+,Na+のReff(14.8%,9.95%,8.21%)よりはるかに高かった。

(a) Sorption kinetics of LOF–Tb–NH4 in 0.1 mmol L−1 Na+, K+, Mg2+, Ca2+, and Sr2+ solution and (b) Removal efficiency Reff of LOF–Tb–NH4 for various ions at 40 min
吸着剤としての重要な特性としては,イオン選択性の他にKdとQmaxが挙げられる。LOF-Tb-NH4のSr2+に対するKdの値は5.6 × 105 mL g−1と算出され,他の従来の吸着剤(Table 1)と同等であった。一方,Ca2+に対するKdの値は3.6 × 104 mL g−1と算出され,Sr2+の場合に比べて一桁以上低い値を示した(Table 1)。これらの結果から,LOF-Tb-NH4はSr2+に対して十分な吸着容量をもち,さらに環境水中に一般的に示される他の競合するアルカリイオンやアルカリ土類イオンが存在しても高いSr2+選択性を示す吸着剤であることが示唆された。
緒言で述べたようにCaとSrの選択的分離が重要な課題である。そこで,一連のLOF-Ln-NH4を用いて海水と同程度の濃度のCa2+(10 mmol L−1)中で,Sr2+(0.1 mmol L−1)イオンへの選択性を評価した。この溶液での吸着試験開始から24時間後にLOF-Ln-NH4に含まれるSrとCaの濃度比から,Sr/Caを算出した。初期溶液中のSr/Caの値は0.01である。したがってSr/Caの値が0.01以上であれば,試料はSr2+を優先的に吸着しているといえる。ホストLnの原子番号の増加とともにSr/Caの値は,LOF-Sm-NH4(AN of Sm = 62)の0.023からLOF-Tb-NH4(AN of Tb = 65)の0.102へと増加し,その後LOF-Tm-NH4(AN of Tm = 69)では0.01まで減少した(Fig. 4)。このように,LnがTbの場合(LOF-Tb-NH4)最も高いSr/Ca値を示し,その値はLnの原子番号に従って段階的に変化することがわかった。

Dependence of Sr2+ selectivity on the host Ln species of LOF-Ln-NH4
Sr2+ selectivity of zeolites A, X, and clinoptilolite are shown for comparison.
LOF-Tb-NH4のSr/Ca値は0.102であり,Ca2+がSr2+に比べて十分に存在する条件で,LOF-Tb-NH4がSr2+をCa2+の約10倍優先的に吸着することを意味する。また,比較のために同じ条件でゼオライトAやX,クリノプチロライトなど,現在広く大量に用いられている90Sr吸着剤のSr/Ca値も測定し,Sr/Ca = 0.032(ゼオライトA),0.021(ゼオライトX),0.017(クリノプチロライト)であることがわかった。このように,LOF-Tb-NH4は大量に用いられている比較的安価な吸着剤と比較して高いSr2+選択性を示していることが明らかとなった。
4. LOF-Ln-SrからのSr脱着再利用性も吸着剤の重要な特性である。吸着剤から放射性核種を濃縮液として簡便に脱着できれば,その後の固化処理が容易となり,さらに吸着剤も再利用可能となるために廃棄物処理のコスト削減にもつながる。LOF-Tb-Srの再利用性を調べるため,NH4Clの水溶液を用いてSr2+脱離反応を調べた。Sr2+(20 mmol L−1)の水溶液にLOF-Tb-NH4を攪拌してSrを吸着させ,NH4Cl(2 mol L−1)の水溶液で攪拌したところ,20時間以内に吸着したSr2+がほぼ定量的にLOF-Tb-Srから放出された(Fig. 5(a))。さらに吸着および脱離を4サイクル繰り返したところ,少なくとも4サイクルに渡ってそのイオン吸着性(Reff > 96%)を維持した(Fig. 5(c))。LOFは,有機,無機ハイブリッド材料であることに起因して後述するように柔軟な構造をもつためにこのような高いイオン脱着性と構造再生の特性を示したと考えられる。ゼオライトでも再利用が検討されている34)。しかし,無機物であるゼオライトは非常に頑強な構造をもっており,酸や高濃度のアンモニウム塩で反応させてもSr2+脱離が困難である33)。本研究ではNH4Clの利用により,吸着したSr2+をLOFから脱着させて,かつLOFを再利用可能であることを確認した。NH4Clは食品添加物としても用いられる安全性をもち,かつ工業的に多く用いられている化学物質であり,取り扱いの容易さからも実用可能性が高いと考えられる。今回新しく見い出したLOF-Tb-NH4はSr2+に対して非常に高い選択性をもつだけでなく,再利用が可能であり,Srだけを分離して廃棄物の減容に寄与可能な,優れた吸着剤であることが示された(Fig. 5(d))。

(a) Desorption of Sr2+ from LOF-Tb-NH4, (c) Removal efficiency (Reff) of LOF-Tb-NH4 at varied adsorption and desorption cycles, (d) Schematic illustration of Sr2+ desorption
優れたSr2+選択性を発現する機構を明らかにするため,詳細な構造解析を行った。LOF-Ln-NH4は単斜晶構造(P2/n)であり(Appendix Table S2),各Lnは4つのシュウ酸配位子と1つの水分子からなる9個の酸素原子と配位している(Fig. 6(左))。Lnとシュウ酸塩は2次元(2D)正方格子シートを形成し,水分子はシートの上部または下部から交互にLn中心に配位している。NH4+イオンはゲストカチオンと交換可能な層間スペースに位置していた。このようなLnとシュウ酸塩からなる(2D)骨格をもつMOFはこれまでにいくつか報告されている22,35~39)。本研究では,100 °C以上で金属と反応させるとシュウ酸を生成するシュウ酸ジメチルを用いた新しい合成経路を採用することで,低温での反応によるLn2(ox)3·10H2Oの生成を抑制し34),高純度のLOFを得ることに成功した。

Crystal structure of 2D square grid sheets of LOF–Tb–NH4 (left) and 3-D structure of LOF–Tb–Sr (right)
Sr2+の吸着により,LOF-Ln-NH4の全体の構造が変化する。一例として,20 mmol L−1で0.25,0.5,1,12時間のSr2+の吸着前後のLOF-Tb-NH4の粉末X線回折(Powder X-ray diffraction : PXRD)パターンをFig. 7(a)に示す。反応時間に応じてパターンは徐々に変化し,12時間後にはLOF-Ln-NH4からのピークが消失した。吸着したSr2+の濃度から,12時間後にはLOF-Tb-NH4のNH4+の約95%がSr2+に交換していることがわかる(Fig. 7(b))。この結果は,LOF-Ln-NH4におけるNH4+とSr2+のイオン交換反応の結果として,新しい結晶相が形成されたことを示す。PXRDのリートベルト解析結果からもLOF-Tb-NH4のほぼ100%が24時間以内にLOF-Tb-Srに変換され,これはSrの吸着曲線とほぼ同じ変化を示した(Fig. 7(c))。これはSr2+の吸着と同時に構造変化が起こっていることを示唆している。同様の構造変化がSr2+の吸着後のすべてのLOF-Ln-NH4生成物について観察された(Fig. 7(d),Appendix Table S3)。

(a) Variation in the PXRD patterns of LOF-Tb-NH4 before and after adsorption of Sr2+ at 20 mmol L−1 for 0.25, 0.5, 1, and 12 h, (b) Ion exchange rate of Sr2+ and NH4+ in LOF–Tb–NH4 during reaction with Sr2+, (c) Structural conversion rate from LOF–Tb–NH4 to LOF–Tb–Sr, (d) PXRD patterns of LOF–Ln–Sr (Ln = Sm, Eu, Gd, Tb, Dy, Ho, Er, or Tm), (e) PXRD patterns of the pristine LOF-Tb-NH4 (top) and that after one cycle of adsorption and desorption (bottom)
詳細なリートベルト解析の結果,LOF-Tb-Srは空間群C2/mの3次元(3D)ネットワーク構造を示すことがわかった(Fig. 6(右),Appendix Table S4)。LOF-Tb-Srの構造では,LOF-Tb-NH4と同様に,各Tbは1つの水と4つの二座シュウ酸によって9配位されていた。LOF-Tb-NH4にSr2+が吸着すると,Tbに配位した4つのシュウ酸のうちの1つがLOF-Tb-NH4の別の2Dシート中の別のTbに結合し,四角形だったシート構造が六角形に変化しながら細孔が大きくなり,LOF-Tb-Srの3D構造へと変化すると考えられる(Fig. 8(a))。この例は,イオン交換反応によるホスト金属と配位子の再結合によって,MOFが2Dから3Dネットワークへと構造変化することを示す初めての報告である。この構造変化は可逆的であり,3D構造を有するLOF-Tb-SrにNH4Clを加えてSr2+を脱着した場合,2D構造のLOF-Tb-NH4へと変化していることがPXRDパターンおよび元素分析からわかった(Fig. 7(e), Table 2)。構造解析により,LOF-Tb-Srの構造において,Sr2+はフレームワーク内に位置し,Sr-O間の距離から2つのシュウ酸の酸素と6つ水分子の酸素と結合を形成していることが示された。これは,Sr2+が水和した状態でLOF-Tb-Srに存在することを意味する。構造解析および元素分析の結果より,Sr2+はLOF-Ln-NH4におけるNH4+とのイオン交換によってLOF-Tb-Srを形成することが示されている。LOFはフレキシブルな構造を有することから,Sr2+の吸着により2D構造から3D構造への変化を伴い安定に構造化したと考えられる。
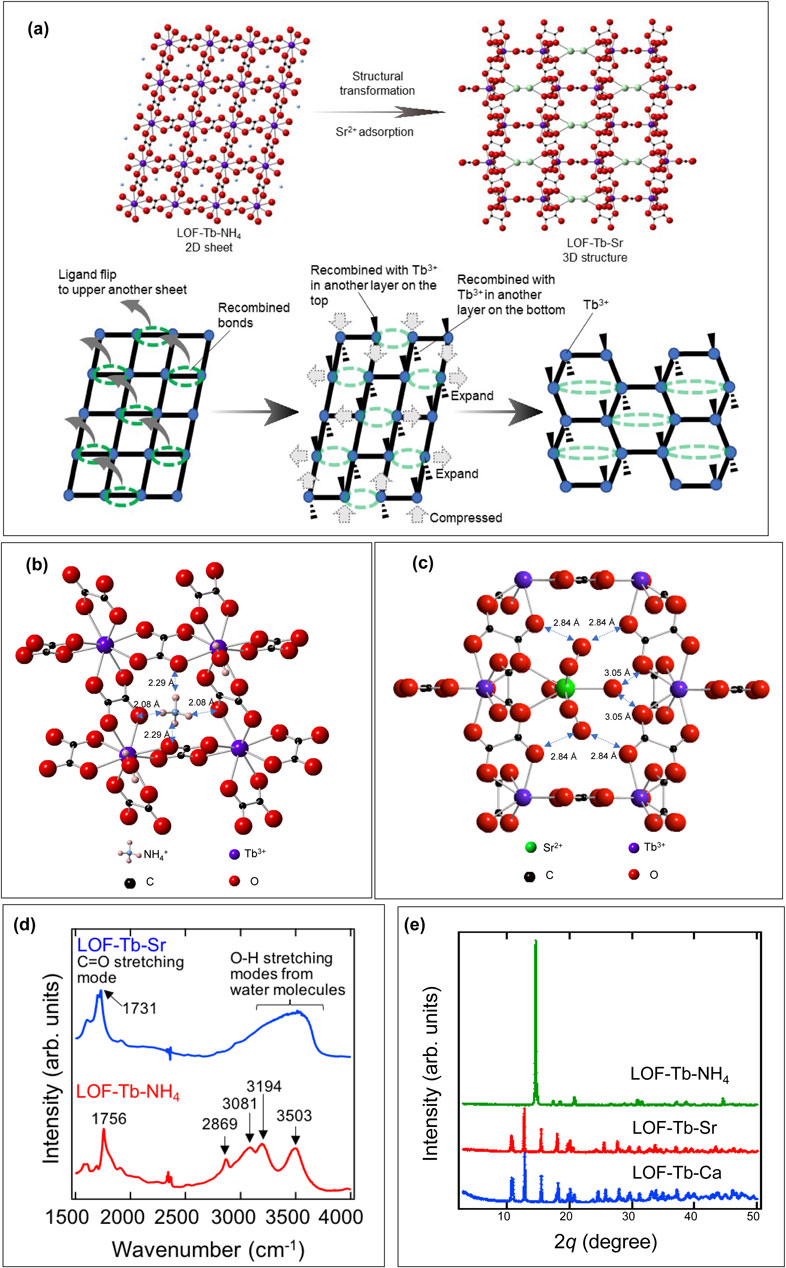
(a) Schematic illustration of the structural conversion from LOF–Tb–NH4 to LOF–Tb–Sr. crystal structures of LOF-Tb-NH4 (b) and LOF-Tb-Sr (c), (d) IR spectra of LOF–Tb–Sr (blue line) and LOF–Tb–NH4 (red line) in the wavenumber range 1,100~4,000 cm−1, (e) PXRD patterns of LOF–Tb–NH4, LOF–Tb–Sr, and LOF–Tb–Ca
| MOF | Reused LOF-Tb-NH4a) | |
|---|---|---|
| Formula | C4H6NO9Tb | |
| Element | C | 12.90 (12.78) |
| H | 1.63 (1.70) | |
| N | 3.78 (3.52) | |
| Tb | 42.83 (41.7) | |
a)The LOF–Tb–NH4 was recovered by adding NH4Cl.
構造解析結果よりLOF-Tb-SrにおいてSr2+は水和した状態で存在することが示された。サイズ認識による吸着において,対象イオンが吸着時に水和または脱水和状態であるかは重要なサイズ決定因子となる。LOF-Tb-NH4の構造において,NH4+の水素原子とシュウ酸塩の酸素原子との距離は,Fig. 8(b)に示すように2.08または2.29 Åである。この距離の値は,LOF-Tb-NH4においてNH4+とシュウ酸塩の間に強い水素結合が形成されていることを示している35)。NH4+の対称性は,2Dシートの正方形グリッドの対称性と一致するため,水素結合が形成しやすい。Sr2+がNH4+と交換すると,吸着したSr2+は,2つのシュウ酸と6つの水分子の酸素原子に配位して,水和した状態(Sr2+(H2O)6)で孔内に存在する(Fig. 8(c))。フレームワーク内でイオンが水和するかどうかは,金属イオンのフレームワークとの相互作用や酸素との配位力など様々な要因が考えられるが,相対的に2価のSr2+は1価のNH4+よりも水和しやすい性質がこの要因の1つと考えられる40,41)。Sr2+(H2O)6の水和水の酸素原子とシュウ酸塩の酸素原子の間の距離は,Fig. 8(c)に示すように2.84 Åまたは3.05 Åである。この酸素原子間距離は,LOF-Tb-Srにおいて,水和水やシュウ酸塩の間に数多くの水素結合が形成されていることを示唆している42,43)。
フーリエ変換赤外法は水素結合の生成を確認するために適した手法である。そのためLOF-Tb-NH4とLOF-Tb-Srのフーリエ変換赤外スペクトルを測定した(Fig. 8(d))。LOF-Tb-NH4で観測された1,756 cm−1の鋭いピークは,シュウ酸塩のC=O伸縮モードに帰属される34)。LOF-Tb-NH4のC=O伸縮は,LOF-Tb-Srへの構造変換により短波長側にシフトしており,C=O部位が配位結合していることが示唆される。さらに,3,500 cm−1付近のピークは,強い水素結合をもつ水のOH伸縮と考えられ,Sr2+(H2O)6が,Sr2+とシュウ酸の2つの配位結合だけでなく,Sr2+に配位した6つの水分子を介してLOF-Tb-Srのフレームワーク内で強い水素結合を形成していることがわかる44)。このようなシュウ酸塩に対する大きさや結合力の異なるNH4+と水和Sr2+のイオン交換により,2D構造から安定な3D構造への構造転換が起こったと考えられる。
またLOF-Ln-NH4にCa2+を反応させても,Ca2+を反応させたLOF-Tb-NH4(LOF-Tb-Ca)は,LOF-Tb-Srと同じPXRD回折パターンを示した(Fig. 8(e))。生成物の元素分析からもLOF-Tb-CaはLOF-Tb-SrのSr2+をCa2+に置換した構造をもつと考えられる。
7. LOF構造のLn依存性LOF-Ln-NH4およびLOF-Ln-Srにおいて,Ln(Ln = Sm,Eu,Gd,Tb,Dy,Ho,Er,Tm)の原子番号がSm(AN = 62)からTm(AN = 69)まで変化しても,PXRDパターンそのものに変化はなかった。しかし,Ln種の違いに応じてピーク位置に変化がみられた。構造解析により,各LOFの結晶格子定数が段階的に変化していることが示された。ランタノイド収縮により,a軸の格子定数がLOF-Sm-NH4の9.7 ÅからLOF-Tm-NH4の9.0 ÅへとホストのLnの原子番号の増加に伴って段階的に減少した(Fig. 9(a))。それに対し,c軸の格子定数はLnの原子番号の増加に伴ってLOF-Sm-NH4の7.7 ÅからLOF-Tm-NH4の8.0 Åまでわずかながら増加した。Lnが関与しない層間距離(b軸)は,ホストLn種によらずほぼ変化しなかった。

The lattice constants of a (red line), b (blue line), c-axis (green line) depending on the host Ln species in the case of (a) LOF-Ln-NH4 and (b) LOF-Ln-Sr, (c) Structural image of LOF–Tb–Sr adsorbing hydrated Sr2+
一方でLOF-Ln-Srは3D骨格構造を有しており,その格子定数は,原子番号の増加に伴いa,b,c軸ともに階段状に徐々に小さくなる(Fig. 9(b))。ホストLnの原子番号の増加に伴うa,b,c軸の格子定数の減少は,原子番号1つ当たりそれぞれa軸で0.0361 Å(R2 = 0.940),b軸で0.0397 Å(R2 = 0.994),c軸で0.0271 Å(R2 = 0.979)の傾きの直線で表され,LOF-Ln-Srの結晶構造は,ホストLn種によってサブオングストロームの範囲で変化していることが明らとなった。これに伴って,結晶格子体積は,LOF-Sm-Srの1,401 Å3からLOF-Tm-Srの1,325 Å3へと減少し(Table S5),希土類元素の体積変化(1.1 Å3程度)以上に体積が変化した。このことは,イオン半径の減少により,セルの体積や細孔の容量が変化していることを示唆している。
8. LOFのSr2+選択性のメカニズム本研究では,LOF-Ln-NH4のSr2+に対する選択性がLn種に依存して段階的に変化する結果を得た。また,Sr2+吸着前後のLOF-Ln-NH4とLOF-Ln-Srでは各々異なる結晶構造をもつが,Ln種を変化させても結晶構造種に変化はみられないことを観察した。通常の化合物は化学組成の変化に伴い結晶構造の種類も大きく変化する場合が多い。しかし本結果は,物理的・化学的性質が似ているLn種を用いて化学組成を変化させることで同様の結晶構造種をもつ,非常に構造が似ている一連の材料ができたことを意味する。Ln種の変化に伴う詳細な構造変化を解析したところ,Ln種の変化に伴い格子定数が段階的に変化する結果を得た。この結果は,本研究で計画していたLn種を変えることで細孔サイズが微細に調整された一連のMOF材料を得たことを意味する。そして,Ln種の変化に伴うSr2+に対する選択性と格子定数の変化はそれぞれ段階的に変化したことから,細孔サイズの変化がSr2+選択性に寄与していることが示唆された。
最も高いSr2+選択性を示した組成であるLOF-Tb-Srにおいて,吸着サイトの直径は約4.65 Åと推定された。なぜこの細孔サイズが高いSr2+選択性を示したかを以下に考察する。4.65 Åの直径サイズはSr2+のイオン半径(1.3 Å)より大きかった。しかし,一般的にイオンの吸着には水和構造,配位状態,反応性などの要因が複雑に関係している。実際にX線結晶構造解析結果から,LOF-Tb-SrにおいてSr2+は水和しており,細孔内で水和したSr2+はシュウ酸塩に囲まれていることが示唆された。Sr2+周囲の水分子とシュウ酸が水素結合していると仮定して,Sr2+のイオン半径(1.3 Å)18),Sr2+と水分子との間のSr-O結合長(2.57~2.76 Å)45),水素結合した水分子のO-H(1.0~1.2 Å)46)を合計すると,約5 Åと算出され(Fig. 9(c)),吸着サイトの直径約4.65 Åと近い値を示した。本研究で開発したLOFはCa2+と比べてもSr2+に高い選択性を示した。Ca2+が吸着した場合もLOF-Tb-Srと同様の結晶構造をもつLOF-Tb-Caが形成する。水和したCa2+がLOFの細孔内に吸着する場合,水和したSr2+と比較して0.4 Åの大きさの差が生じる。これは,Sr2+とCa2+のイオン半径差が0.2 Åであり,Ca-O結合長も考慮したサイズの差である。本研究結果は,このようなわずかなサイズの差が大きいイオン選択効果をもたらしたことを示している。
以上の結果は,細孔サイズのサブオングストロームの変化でイオンサイズが認識されることを示している。単純にSr2+のイオン半径と合致する細孔が高い選択性を示すことにはならないものの,水和や水素結合を考慮することでSr2+を選択的に吸着する細孔構造が実現することが示された。実際にゼオライトでも直径4.1 Å程度の空洞をもつLTA型がSr2+をよく吸着することが知られており,吸着剤の化学組成や電荷状態によって最適なサイズは変化する可能性があるが,この付近の空孔の大きさがSr2+イオン吸着に有効な細孔サイズであると考えられる13)。吸着における水和等の複雑な反応機構のためにいまだ最適なサイズを事前に計算などで予測することは困難であるが,サブオングストロームで段階的にイオンサイズや化学性質がわずかに異なる一連の材料を用いて最適なイオン選択的材料を見い出す戦略は1つの有用な手法であると考えられる。今後,計算科学および材料に関する知見の蓄積により,イオン選択性をもつ材料開発はますます発展すると考えている。
我々は,シュウ酸ジメチルとLnCl3·6H2O,NH4Clとの水熱合成により,8種類の同型構造をもつ2Dシート構造からなるLOF-Ln-NH4を合成した。これらのLOFは,すべて同型の結晶構造をもつが,Lnの原子番号が大きくなるほど,小さな格子定数を有することが明らかになった。この一連のLOF-Ln-NH4をSr2+に反応させたところ,NH4+とのイオン交換でSrを吸着し,LOF-Ln-Srが得られた。2Dシート型の構造をもつLOF-Ln-NH4から特異な構造変化により,3D構造のLOF-Ln-Srが生成していることが明らかになった。この一連のLOF-Ln-NH4はSr2+選択性をもつが,その選択性はLOF-Tb-NH4において最大となり,Lnの原子番号が離れるほど小さくなることを見い出した。最も選択性の高いLOF-Tb-NH4においては,Caに対してSrの選択性が10倍以上あり,現在広く大量に用いられているゼオライトやチタンなどの吸着剤を上回る選択性を示した。またこのLOFのKdとQmaxはそれぞれ5.6 × 105 mL g−1および117 mg g−1であり,吸着剤としても非常に高い性能を示した。
またLOF-Tb-NH4は,NH4Clと反応することで吸着したSr2+をほぼ100%の効率で放出し,3D構造から2D構造に戻った。この可逆的なSr2+の吸着・除去は,少なくとも4サイクルに渡って,高い効率で行うことができることが明らかとなった。選択的吸脱着サイクル全体を通して高い効率が得られたことから,LOFが複雑な系から標的イオンだけを可逆的に分離・回収することが示された。同様の材料を用いた選択的吸脱着サイクルの利点は,有用金属の回収,廃水回収や有害物センシングなど,他の分野での大幅な技術進歩につながると考えられる。また,MOFはホスト金属イオンと配位子の組み合わせで様々なものが合成可能であるため,今後はこの結果をもとに,原料費の安価なMOF吸着剤の開発も目指す。
本研究はJSPS科研費(課題番号「21K04949」,「21H01151」,「20H02671」,「18K05004」)の助成を受けたものである。また元素分析は,東京大学有機元素分析室を利用させて頂いたことに感謝する。
| LOF | LOF-Sm-NH4 | LOF-Eu-NH4 | LOF-Gd-NH4 | LOF-Tb-NH4 | |
|---|---|---|---|---|---|
| Formula | C4H6NO9Sm | C4H6NO9Eu | C4H6NO9Gd | C4H6NO9Tb | |
| Element | C | 13.48 (13.52) | 13.20 (13.15) | 13.01 (12.98) | 12.95 (12.78) |
| H | 1.70 (1.82) | 1.66 (1.71) | 1.64 (1.66) | 1.63 (1.70) | |
| N | 3.93 (3.88) | 3.85 (3.82) | 3.79 (3.81) | 3.78 (3.52) | |
| Ln | 41.48 (42.1) | 41.74 (41.5) | 42.58 (42.8) | 42.83 (41.7) | |
| Yeild (%) | 88 | 85 | 89 | 87 | |
| LOF | LOF-Dy-NH4 | LOF-Ho-NH4 | LOF-Er-NH4 | LOF-Tm-NH4 | |
|---|---|---|---|---|---|
| Formula | C4H6NO9Dy | C4H6NO9Ho | C4H6NO9Er | C4H6NO9Tm | |
| Element | C | 12.83 (12.79) | 12.74 (12.72) | 12.66 (12.70) | 12.61 (12.55) |
| H | 1.61 (1.58) | 1.60 (1.59) | 1.59 (1.55) | 1.59 (1.57) | |
| N | 3.74 (3.70) | 3.72 (3.67) | 3.69 (3.69) | 3.68 (3.74) | |
| Ln | 43.38 (42.6) | 43.75 (44.1) | 44.09 (44.2) | 44.34 (43.9) | |
| Yeild (%) | 80 | 72 | 75 | 77 | |
| LOF | LOF-Sm-NH4 | LOF-Eu-NH4 | LOF-Gd-NH4 | LOF-Tb-NH4 |
|---|---|---|---|---|
| Formula | C4H6NO9Sm | C4H6NO9Eu | C4H6NO9Gd | C4H6NO9Tb |
| Crystal system | Monoclinic | Monoclinic | Monoclinic | Monoclinic |
| Space group | P2/n | P2/n | P2/n | P2/n |
| a (Å) | 9.669(5) | 9.584(5) | 9.43(2) | 9.380(5) |
| b (Å) | 6.133(4) | 6.108(3) | 6.057(14) | 6.130(4) |
| c (Å) | 7.721(4) | 7.727(4) | 7.672(17) | 7.851(5) |
| β (°) | 90.498(6) | 89.517(6) | 90.50(3) | 90 |
| V (Å3) | 457.8(4) | 452.3(4) | 438.4(17) | 451.4(4) |
| Z | 2 | 2 | 2 | 2 |
| Rw | 0.1995 | 0.118 | 0.2447 | 0.0885 |
| LOF | LOF-Dy-NH4 | LOF-Ho-NH4 | LOF-Er-NH4 | LOF-Tm-NH4 |
|---|---|---|---|---|
| Formula | C4H6NO9Dy | C4H6NO9Ho | C4H6NO9Er | C4H6NO9Tm |
| Crystal system | Monoclinic | Monoclinic | Monoclinic | Monoclinic |
| Space group | P2/n | P2/n | P2/n | P2/n |
| a (Å) | 9.584(5) | 9.094(3) | 9.037(6) | 9.060(7) |
| b (Å) | 6.108(3) | 6.095(2) | 6.107(4) | 6.127(4) |
| c (Å) | 7.727(4) | 7.949(3) | 7.971(5) | 8.020(6) |
| β (°) | 89.517(6) | 89.707(3) | 90.055(6) | 90.353(10) |
| V (Å3) | 452.3(4) | 440.6(3) | 440.0(5) | 445.2(6) |
| Z | 2 | 2 | 2 | 2 |
| Rw | 0.2552 | 0.1802 | 0.0809 | 0.0951 |
| MOF | LOF-Sm-Sr | LOF-Eu-Sr | LOF-Gd-Sr | LOF-Tb-Sr | |
|---|---|---|---|---|---|
| Formula | C4H12O14SmSr0.5 | C4H12O14EuSr0.5 | C4H12O14GdSr0.5 | C14H12O14TbSr0.5 | |
| Element | C | 10.31 (10.04) | 10.03 (10.01) | 9.99 (9.90) | 9.98 (9.87) |
| H | 2.57 (2.53) | 2.88 (2.52) | 2.87 (2.49) | 2.81 (2.48) | |
| N | 0 (0) | 0 (0) | 0 (0) | 0 (0) | |
| Ln | 30.25 (31.44) | 31.05 (31.67) | 32.87 (32.41) | 31.57 (32.64) | |
| Sr | 9.20 (9.13) | 9.01 (9.13) | 8.89 (9.03) | 8.78 (9.00) | |
| MOF | LOF-Dy-Sr | LOF-Ho-Sr | LOF-Er-Sr | LOF-Tm-Sr | |
|---|---|---|---|---|---|
| Formula | C4H12O14DySr0.5 | C4H12O14HoSr0.5 | C4H12O14ErSr0.5 | C4H12O14TmSr0.5 | |
| Element | C | 9.88 (9.80) | 9.89 (9.75) | 9.97 (9.70) | 9.87 (9.67) |
| H | 2.82 (2.47) | 2.78 (2.45) | 2.43 (2.44) | 2.38 (2.43) | |
| N | 0 (0) | 0 (0) | 0 (0) | 0 (0) | |
| Ln | 32.93 (33.13) | 33.03 (33.46) | 33.95 (33.78) | 33.98 (34.00) | |
| Sr | 8.87 (8.93) | 8.87 (8.89) | 8.72 (8.85) | 8.67 (8.82) | |
| LOF | LOF-Tb-Sr |
|---|---|
| Formula | C14H12O14TbSr0.5 |
| Crystal system | Monoclinic |
| Space group | C2/m |
| a (Å) | 14.18250(9) |
| b (Å) | 11.54692(7) |
| c (Å) | 10.17891(8) |
| β (°) | 124.771(5) |
| V (Å3) | 1369.28(2) |
| Z | 4 |
| Rwp | 0.04637 |
| LOF | LOF-Sm-Sr | LOF-Eu-Sr | LOF-Gd-Sr | LOF-Tb-Sr |
|---|---|---|---|---|
| a (Å) | 14.255(8) | 14.247(4) | 14.233(3) | 14.1825(1) |
| b (Å) | 11.676(8) | 11.617(4) | 11.591(3) | 11.5469(1) |
| c (Å) | 10.242(4) | 10.227(4) | 10.204(2) | 10.1789(1) |
| β (°) | 124.71(2) | 124.83(1) | 124.779(8) | 124.773(1) |
| V (Å3) | 1401.37 | 1389.48 | 1382.86 | 1369.34 |
| LOF | LOF-Dy-Sr | LOF-Ho-Sr | LOF-Er-Sr | LOF-Tm-Sr |
|---|---|---|---|---|
| a (Å) | 14.1614(1) | 14.127(4) | 14.029(5) | 14.029(7) |
| b (Å) | 11.5046(1) | 11.461(3) | 11.420(8) | 11.398(6) |
| c (Å) | 10.1557(1) | 10.108(3) | 10.074(6) | 10.063(3) |
| β (°) | 124.773(1) | 124.59(1) | 124.74(3) | 124.56(2) |
| V (Å3) | 1359.14 | 1347.33 | 1326.31 | 1325.23 |
| LOF | LOF-Tb-Ca |
|---|---|
| a (Å) | 14.086(3) |
| b (Å) | 11.530(3) |
| c (Å) | 10.123(2) |
| β (°) | 124.774(8) |
| V (Å3) | 1350.51 |
| MOF | LOF-Tb-Ca | |
|---|---|---|
| Formula | C4H12O14TbCa0.5 | |
| Element | C | 10.37 (10.47) |
| H | 2.61 (2.67) | |
| N | 0 (0) | |
| Tb | 34.32 (32.70) | |
| Ca | 4.33 (4.15) | |