2021 Volume 24 Issue 2 Pages 76-90
2021 Volume 24 Issue 2 Pages 76-90
成人T細胞白血病・リンパ腫(adult T-cell leukemia/lymphoma; ATLL)は,human T-lymphotropic virus type I(HTLV-1)感染を基盤として発症する末梢性T細胞腫瘍である1.Japan Clinical Oncology Group/Lymphoma Study Group(JCOG/LSG)が1998年から実施したアグレッシブATLL(急性型,リンパ腫型,予後不良因子を有する慢性型ATLL)を対象としたVCAP-AMP-VECP療法(modified LSG15:ビンクリスチン,サイクロフォスファミド,ドキソルビシン,プレドニゾロン;ドキソルビシン,ラニムスチン,プレドニゾロン;ビンデシン,エトポシド,カルボプラチン,プレドニゾロン)とCHOP-14 療法(サイクロフォスファミド,ドキソルビシン,ビンクリスチン,プレドニゾロン)の比較試験では,前者が後者と比較して完全奏効(CR)割合と全生存(OS)割合に優れていたことから,現時点ではVCAP-AMP-VECP療法がアグレッシブATLLの標準治療として受け入れられている2.しかし,本治療による1年無増悪生存(PFS)割合は28%,3年OS割合は24%にとどまる2.一方,ATLL症例に対して同種造血幹細胞移植を実施すると一部の症例で長期生存が認められるが,多施設後方視的解析の結果,3年OS割合は33%と報告されている3.
CCケモカイン受容体4(CC chemokine receptor 4; CCR4)はATLLの90%以上の症例で発現しており,CCR4の発現は独立した予後不良因子である4.モガムリズマブはわが国で開発されたヒト化抗CCR4モノクローナル抗体で,ATLLに対する治療効果が期待される.再発ATLLに対するモガムリズマブ単剤の治療成績は,全奏効割合50%,PFSとOSの中央値はそれぞれ5.2か月と13.7か月であった5.次いで実施された初発アグレッシブATLLを対象としたVCAP-AMP-VECPとモガムリズマブの併用療法とVCAP-AMP-VECP 単独療法のランダム化第2相比較試験では,前者が後者と比較してCR割合に優れていることが証明され6,モガムリズマブは初発ATLLにも適応拡大された.
ATLLではCCR4分子のC末端の細胞内ドメインにCCR4遺伝子変異による機能獲得型変異が認められる7-10.驚くべきことに,同種造血幹細胞移植を実施しなかった患者では,CCR4遺伝子変異陽性患者の方がモガムリズマブを含む治療に対する成績が良好であることが示された9.この理由は,C末端の細胞内ドメインに変異があると,リガンドが結合したCCR4分子の細胞内への内在化が阻害されるため,N末端側のエピトープを標的とするモガムリズマブの効果が増強されるためであると理解されている7-9.逆に,モガムリズマブを同種造血幹細胞移植に先立って投与すると,CCR4陽性の制御性T細胞が枯渇するため,重症GVHD,非再発死亡,全死亡のリスクが高くなる11.従って,CCR4遺伝子の変異解析はATLLの治療戦略を立てる上で極めて重要である.
今回我々は,当院で診療したATLL症例を対象として, polymerase chain reaction(PCR)とダイレクトシークエンシングを用いてCCR4遺伝子変異を解析し,CCR4の部分欠失を認めた症例ではフラグメント解析を実施した.次いで,より簡便な遺伝子変異解析法であるヘテロ2本鎖移動度解析(heteroduplex mobility assay)の変異検出能力を検討した.最後に,CCR4遺伝子変異と,各症例の臨床病態やマルチカラー・フローサイトメトリー(M-FCM)によって解析した異常細胞分画(unusual cell population; UCP)の免疫形質との関連を検討した.
末梢血と骨髄血検体では比重遠心分離法(Lymphocyte Separation Solution; Nacalai Tesque, Kyoto, Japan)で単核球を回収した.リンパ節生検検体は,リン酸緩衝食塩水中でハサミとピンセットで細切し,浮遊細胞を回収した.赤血球は塩化アンモニウム溶血液で除去し,リン酸緩衝食塩水で1 × 107/mL の濃度になるように細胞浮遊液を調整した.凍結保存細胞は定法に従って解凍し,10%ウシ胎児血清加RPMI 1640培養液にて遠心洗浄後, 細胞浮遊液を調整した.
M-FCMに用いた抗体は,eFluor450標識CD2抗体(clone: RPA-2.10),FITC標識CD3抗体(clone: UCHT1),APC標識CD3抗体(clone: UCHT1),PE標識CD4抗体(clone: 13B8.2),PE-Cy5.5標識CD4抗体(clone: 13B8.2),FITC標識CD5抗体(clone: UCHT2),APC-AlexaFluor700標識CD5抗体(clone: BL1a),FITC標識CD7抗体(clone: CD7-6B7),PE-Texas Red標識CD7抗体(clone: 8H8.1),FITC標識CD8抗体(clone: RPA-T8),Krome Orange標識CD8抗体(clone: B9.11),APC-AlexaFluor750標識CD16抗体(clone: 3G8),PE標識CD25抗体(clone: B1.49.9),PE標識CD26抗体(clone: 4EL-1C7),Krome Orange標識CD45抗体(clone: J33),FITC標識CD45RO抗体(clone: UCHL1),PE-Cy7標識CD45RO抗体(clone: UCHL1),PE標識CD56抗体(clone: MY31),PE-Cy7標識CD56抗体(clone: N901),PE-Cy7標識PD-1(CD279)抗体(clone: PD1.3),Krome Orange標識HLA-DR抗体(clone: Immu-357),AlexaFluor647標識CADM1抗体(clone: 3E1),PE標識CCR4抗体(clone: 1G1)の23種類から10色を選択した.
細胞表面に結合した抗体の蛍光は10カラー解析対応のフローサイトメーター NAVIOS 3L(Beckman Coulter; BC)で検出し,Kaluza Flow Cytometry Analysis Software(BC)で解析した.発現レベルは, −(陰性),dim(弱陽性),+(陽性),++(強陽性) の4段階で表記した.10%以上の亜集団を認めた場合はスラッシュ(/)のあとに追記し,単一集団で発現レベルが広範囲に分布する場合には ++ to dimなどと記載した.なお, CD2,CD3,CD4,CD5,CD7,CD8では正常細胞と比較して発現レベルが明らかに減弱している場合に,CCR4, CADM1,CD25,CD26,CD45RO,CD279 では細胞集団が分割線をまたぐ場合にdimと判定した.
M-FCMの結果,正常T細胞と比較して,T細胞系統抗原(CD2,CD3,CD5,CD7)の減弱や欠失または強発現などの発現異常に加えて,CD25,CADM1,CCR4のうち1つ以上が陽性(弱陽性含む)の細胞分画をUCPとした.
症例の選択1993年から2021年の間に天理よろづ相談所病院で診療したATLL症例のうち,当施設に腫瘍細胞の高分子DNAが保存され,M-FCMで解析細胞中のUCPが40%以上であった症例を選択した.各症例の,現症,身体所見,臨床検査値,画像所見,治療,治療転帰などの診療情報は診療録から取得した.本研究は当院の倫理委員会の承認を得て実施した(承認番号1291).
PCR・ダイレクトシークエンシング,フラグメント解析,ヘテロ2本鎖移動度解析,HTLV-1 pX PCRM-FCMで解析した臨床検体からproteinase K-phenol/chloroform/isoamyl alcohol抽出とエタノール沈殿法,または,シリカメンブレンスピンカラム法(NucleoSpin™ Tissue Column; Machrey-Nagel)でゲノムDNAを抽出した.CCR4遺伝子のPCRプライマーは,遺伝子変異のホットスポットを跨ぐようにforwardプライマーとreverseプライマーをそれぞれ2種類デザインし(Figure 1)7-9,12,これらのプライマーを組み合わせた4種類のセット(F1/R1,F1/R2,F2/R1,F2/R2)で増幅産物を確認した.ダイレクトシークエンシングはF1/R1プライマーセットによって得られたPCR産物を用いた.PCR反応は,高正確性PCR酵素KOD-Plus-Neo(Toyobo)を用いた.反応条件は,初回DNA変性94℃ 2分,DNA変性98℃ 10秒・アニーリング 65℃ 30秒・伸長反応 68℃ 30秒を35サイクル,最終伸長68℃ 10分を付加した(VeritiTM Thermal Cycler; ThermoFisher Scientific).PCR増幅産物は,2%アガロースゲルにて電気泳動し,エチジウムブロマイド(EtBr)染色後に写真を撮影した.ダイレクトシークエンシングは,PCR増幅産物のサイクルシークエンス反応(BigDye® Direct Cycle Sequencing Kit; ThermoFisher Scientific)後,SeqStudioTM Genetic Analyzer(ThermoFisher Scientific)で塩基配列を解析した.変異の判定にはCCR4遺伝子のリファレンスシークエンスGRCh38/hg38を用いた.

Nucleotide (top) and amino acid (bottom, depicted by the single-letter code) sequences representing the carboxy terminal of CCR4 and the positions of primers for PCR. To avoid decreased annealing efficacy due to potential single nucleotide polymorphisms, we designed two sets of forward (F) and reverse (R) primers. The sequences of the primers were: F1, 5′-CTGCACCTTTGAAAGATACTTGGAC-3′; F2, 5′- AGATACTTGGACTATGCCATCCAGG-3′; R1, 5′- AAGTTCATTGACTCTGCATTTCACC-3′; and R2, 5′-TTTCTACAGAGCATCATGGAGATCA-3′.
フラグメント解析では,PCR・ダイレクトシークエンシングと同様にF1/R1のプライマーを使用し,forwardプライマーの5′末端を6-FAMで蛍光標識した.反応条件は,初回DNA変性94℃ 2分,DNA変性98℃ 10秒・アニーリング62℃ 30秒・伸長反応 68℃ 30秒を25サイクル,最終伸長68℃ 15分を付加した.キャピラリー電気泳動は,PCR増幅産物とGeneScanTM600 LIZTMdye Size Standard v2.0(ThermoFisher Scientific)をHi-DiTM Formamide(ThermoFisher Scientific)に添加し,95℃ 3分,10℃ 5分間反応させ,SeqStudioTM Genetic Analyzerで蛍光を検出した後,GeneMapperTM Software(ThermoFisher Scientific)で解析した.
ヘテロ2本鎖移動度解析は,PCR増幅産物を95℃で 5分間変性させた後4℃で60分冷却し,ヘテロ2本鎖(heteroduplex)を形成させた.処理したPCR増幅産物を5–20%グラジエントポリアクリルアミドゲル(e-PAGEL; ATTO)で電気泳動した後にEtBr染色し,移動度の異なるバンドの有無を判定した.
HTLV-1ウイルスpX領域のPCR増幅は既報の方法に従った13.
解析した20例の年齢は46–84歳(中央値61歳),男性10例,女性10例,臨床病型は,急性型11例(慢性型から急性型への転化を含む),リンパ腫型5例,慢性型3例,くすぶり型1例であった(Table 1).検体採取日の白血球数中央値は19.60 × 103/μ L,リンパ球数(腫瘍性リンパ球を含む)中央値は8.98 × 103/μ Lであった.LDは9例で正常値上限の2倍以上,高カルシウム血症は8例で認められた.可溶性IL-2受容体は17例中11例で10,000 U/mL以上の高値を示した(Table 1).全例ATLA抗体陽性で,8例でウェスタンブロットによる確認検査が実施された.末梢血単核球1,000個あたりのHTLV-1プロウイルスのコピー数は1.4から2,398.0であった(Table 1).
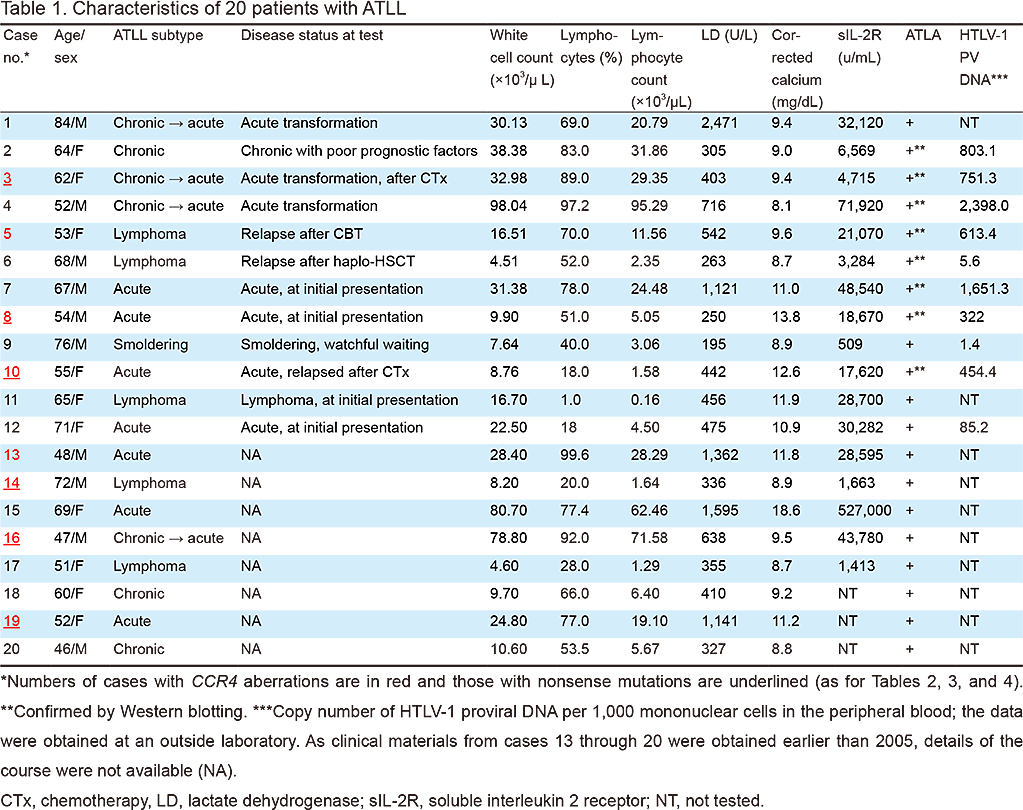
CCR4遺伝子変異検査に用いた臨床検体は,末梢血12例,骨髄血2例,リンパ節5例,腹水1例であった(Table 2).HTLV-1ウイルスpX-PCRは19例で陽性であったが,症例9では増幅産物は微量であった(Table 2).20例全例で,F1/R1, F1/R2, F2/R1, F2/R2の4種類のプライマーセットでPCR産物が得られた(Figure 2).症例5は複数のPCR産物が認められたため別個に解析した.


Electrophoresis of PCR products on 2% agarose gel. DNA was visualized by ethidium bromide (EtBr) staining after electrophoresis. Primer combinations and expected size of PCR products in each lane are: A, F1/R1 (295 bp); B, F1/R2 (262 bp); C, F2/R1 (282 bp); and D, F2/R2 (269 bp). In case 5, multiple-size PCR products were generated. M, 100-bp ladder marker. Numbers of cases with CCR4 aberrations are in red and those with nonsense mutations are underlined (as for Figures 4 and 5).
リファレンス配列と異なる塩基配列を8例(40%)で認めた(Table 2).うち6例は1塩基置換によるナンセンス変異(Q330*,2例;Y331*,4例)で,フレームシフト変異は認めなかった.症例13のc.1014C > T は,アミノ酸置換を伴わない(Y338Y)1塩基多型(single nucleotide polymorphism; SNP)と考えられた(Reference SNP Cluster Report: rs2228428)が,electropherogram上はバリアント型が野生型よりも高いピークを示した(Figure 3A). 本症例では,G-バンディングでCCR4(3p22.3)が位置する3番染色体のトリソミーを認め,BCL6(3q27)プローブを用いたFISHで,%UCPに合致する80%の核に3個のハイブリダイゼーションシグナルが認められたことから(データ示さず),バリアントアリルのコピー数が2個に増加していると考えられた(バリアントアリルのコピー数増加;Table 2).
症例5では,PCR産物を95℃で 5分間変性させた後4℃で60分冷却し4%アガロースゲルで展開すると3本のバンドに分離した.それぞれのバンドをゲルから切り出し塩基配列を調べたところ,移動距離の短いものから長いものの順に,野生型と変異型のheteroduplex,野生型のhomoduplex,変異型のhomoduplexであった.変異型ではQ336–T342の18塩基が欠失しQ336Hに置換されていた(欠失を伴うミスセンス変異;Table 2, Figure 3B).欠失を確認するためにフラグメント解析を行ったところ,野生型のピークより18塩基短い変異型のピークが認められた(Figure 4).
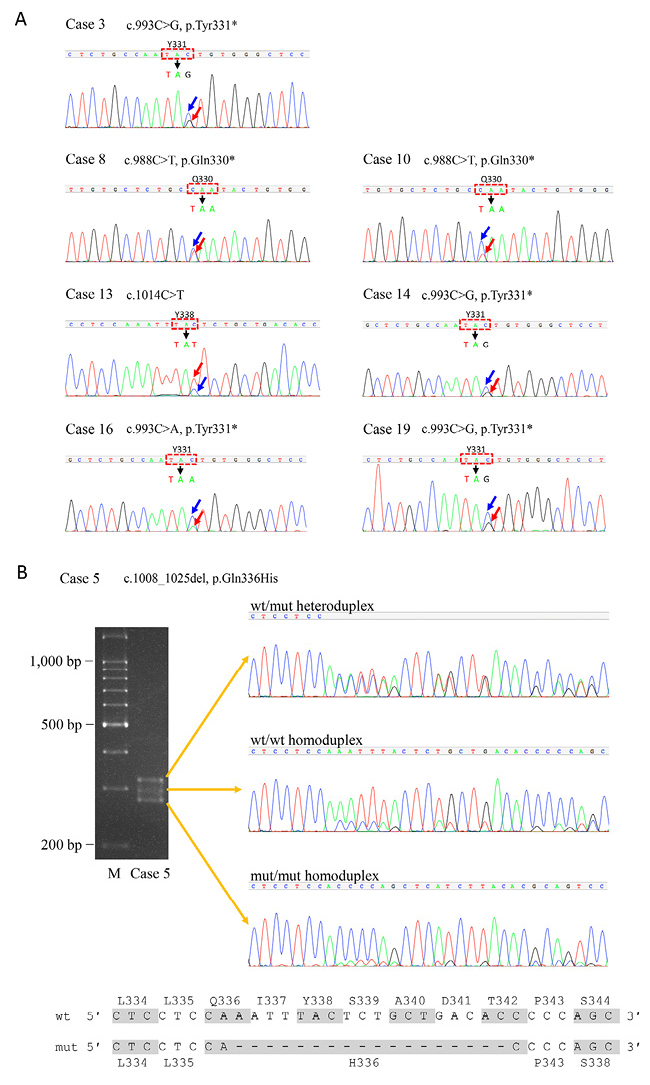
(A) Electropherograms of direct sequencing of F1/R1 PCR products from cases 3, 8, 10, 13, 14, 16, and 19, carrying single nucleotide substitutions within the CCR4 gene. Heterogenous peaks representing the wild-type (wt) and mutated (mut) or SNP variant nucleotides are indicated by blue and red arrows, respectively. In case 13, neoplastic cells carried trisomy of chromosome 3, where the CCR4 gene is localized, resulting in two copies of SNP variant alleles and one copy of the wt allele, thereby accounting for the higher SNP variant (thymidine) peak than the wt (cytosine) peak.
(B) Electrophoresis of F1/R1 PCR products from case 5 on EtBr-stained 4% agarose gel, separating 3 DNA fragments (top left). DNA was eluted from gel slices containing each fragment and subjected to sequencing analysis, revealing two independent sequences overlapped from the adenine residues at nucleotide position 1,008; each DNA fragment represented the wt/mut heteroduplex, wt/wt homoduplex, and mut/mut homoduplex in the order of low to high electrophoretic mobility. (top right). Bottom, nucleotide and amino acid sequences showing deletion of 18 nucleotides (c.1008_1025del) corresponding to Q336–T342 and substitution of H336 for Q336.
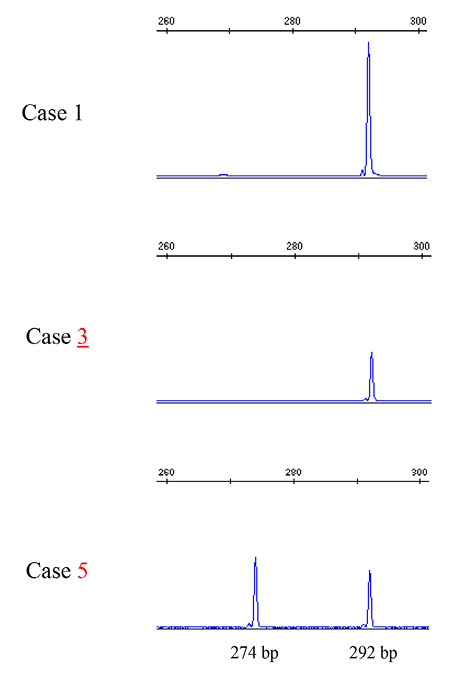
Fragment analysis of F1/R1 PCR products from cases 1, 3, and 5 using the GeneMapper software. Case 1, homozygous for the wt allele; case 2, heterozygous for the wt and c.993C>G mut allele; and case 5, heterozygous for the wt and c.1008_1025del mut allele. Software-calculated sizes of the fragments were 292 bp and 274 bp, respectively.
ヘテロ2本鎖移動度解析ではPCR・ダイレクトシークエンシングでCCR4遺伝子変異を認めた8例中6例でheteroduplexバンドを認め,変異陰性の12例ではバンドを認めなかった(Table 2,Figure 5).3例(症例3,14,19)では野生型DNAのhomoduplexバンドより移動距離の短い位置に明瞭なheteroduplexバンドを認めたが,2例(症例13,16)では両者の分離が不十分であった.症例5では,移動距離の著しく短い位置にheteroduplexバンドを認めた.Q330*変異を認めた2例(症例8,10)ではheteroduplexバンドを認めなかった.
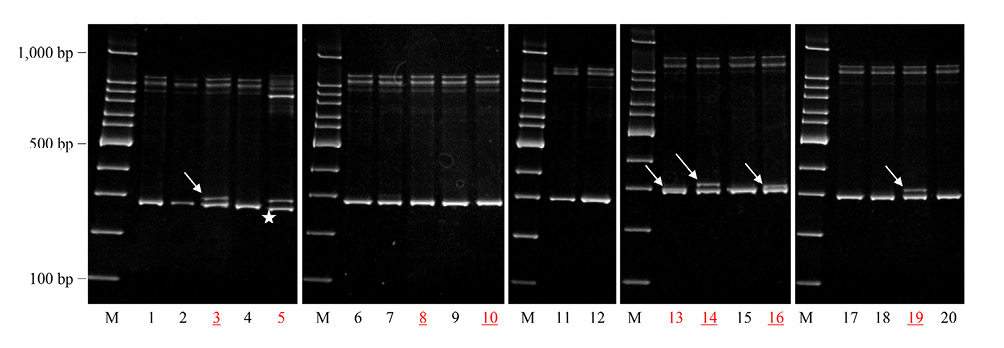
EtBr-stained acrylamide gel electrophoresis of DNA materials after heteroduplex preparation. In cases 3, 13, 14, 16, and 19, low-mobility heteroduplex bands were identified (arrows). In case 5, the heteroduplex DNA demonstrated markedly low electrophoretic mobility within the gel (arrow) and the mut/mut homoduplex DNA (asterisk) migrated faster than the wt/wt homoduplex DNA.
Table 3に20例のUCPの免疫形質をまとめた. T細胞抗原では,19例中15例(79%)でCD3の発現が減弱していた.CD5は8例で発現が減弱または増強,CD7は12例で陰性,CD25の発現レベルは−から++まで種々であった.CADM1は18例で検討し,発現強度やパターンは種々であった.CCR4は全例で検討し,HLAハプロタイプ半合致移植後にリンパ節病変で再発した1例(症例6)を除く19例(95%)にdimから++の発現が認められた.代表例として,症例15(Figure 6A)と症例9(Figure 6B)のM-FCMを示す. M-FCM解析した検体中に占めるUCPの割合は40–95%(中央値66%)であった(Table 3).
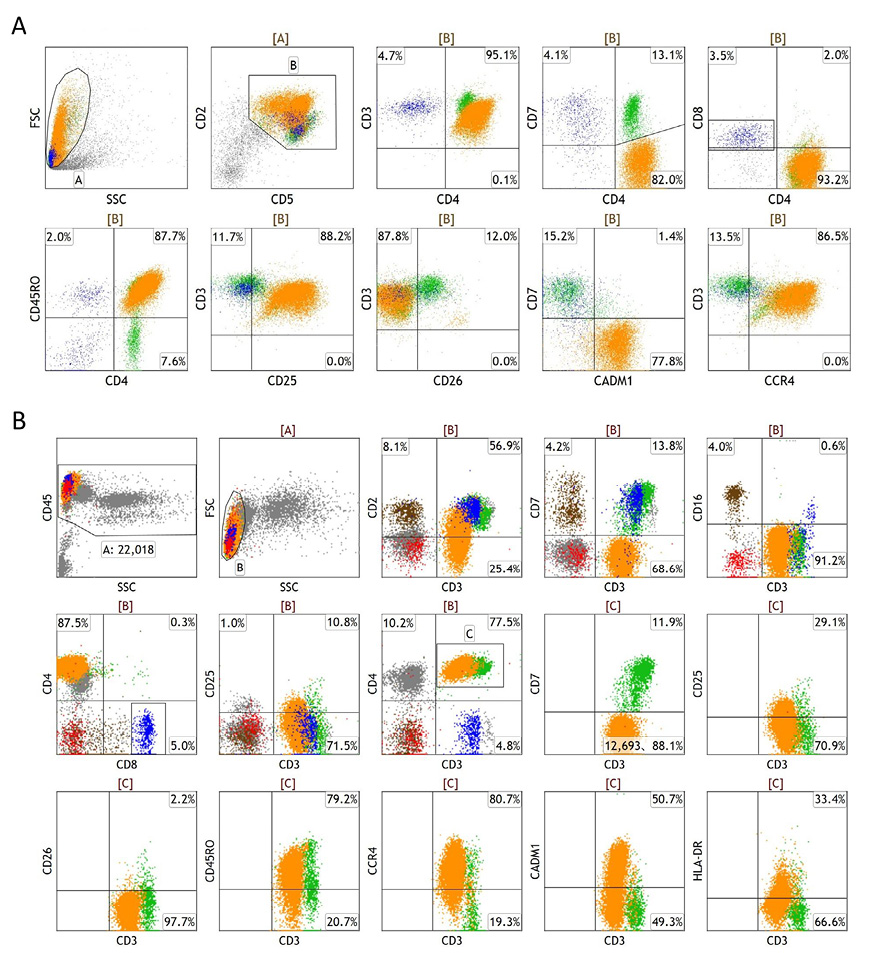
(A) Case 15. UCP cells selected (orange) were CD2++, CD3dim, CD4+, CD5+/dim, CD7–, CD26–, and CD45RO+. The cells expressed CD25, CCR4, and CADM1 at the levels of ++ to +, ++, and +, respectively, indicating UCP cells represented neoplastic cells in the material.
(B) Case 9. UCP cells (orange) were selected through a multiple gating strategy: gate A, entire leukocytes; gate B, mononuclear cells; and gate C, CD4+ T-cells. UCP cells were CD2dim, CD3dim, CD4+, and CD7– (12,693 events), accounting for 58% of CD45/SSC-gated leukocytes (22,018 events). As the cells included those lacking expression of CD25, CCR4, or CADM1, the UCP may have contained non-neoplastic T-cells. Other cell fractions included: green, non-neoplastic CD4+ T-cells; blue, CD8+ T-cells; brown, natural killer cells; and red, B-cells.

CCR4遺伝子変異とATLLの臨床病型との関連をみると,急性型11例のうち6例(55%)とリンパ腫型5例のうち2例(40%)が変異陽性であったのに対し,慢性型・くすぶり型の4例には変異を認めなかった( Table1,2).CCR4遺伝子変異とUCPの免疫形質との関連では,CCR4の発現レベルが++(強陽性)であった8例(症例8,10,13,14,15,16,17,20) のうち4例(50%)がナンセンス変異陽性であった.逆にナンセンス変異陽性6例中4例(67%)がCCR4の発現レベルが++(強陽性)であった(Table 2,3;Figure 7).また,CD5強陽性の4例(症例8,16,19,20)のうち3例にナンセンス変異が認められた(Table 2,3).
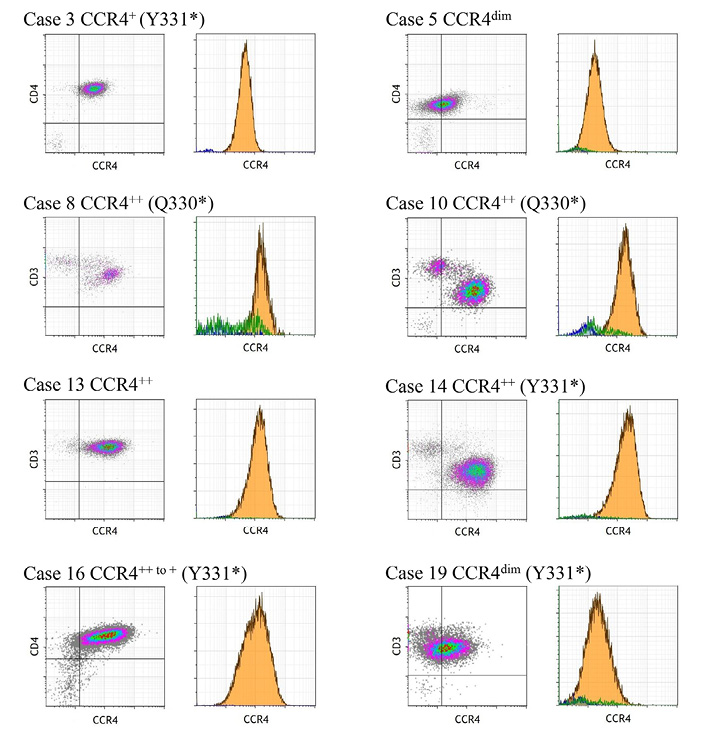
Bivariate density plot (left) and univariate histogram (right) of CCR4 expression in 8 cases with CCR4 aberrations. The levels of CCR4 expression were graded as – (negative), dim, + (positive), and ++ (bright). Cases 3, 8, 10, 14, 16, and 19 carried the indicated nonsense mutation.
Table 4に症例1から12の治療経過と転帰を示した.9例で寛解導入療法が実施され,CRが2例,部分奏効(PR)が4例であった.4例で同種造血幹細胞移植が実施された.モガムリズマブは5例で投与された.症例2ではCHOPと併用した初回寛解導入療法として,CCR4遺伝子変異陽性であった症例8では再発に対するサルベージ治療として投与され,PRの効果が得られた.症例3と臍帯血移植後の再発に対して投与された症例5はinfusion reactionのため投与が中止された.症例11の最良効果はstable diseaseであった.12例の生存期間中央値は582日で,2例が生存している.

今回我々はATLL症例20例を解析し,8例(40%)にCCR4遺伝子変異を見出した.症例選択では,PCR・ダイレクトシークエンシングの感度を考慮してUCP 40%以上を基準としたが,臨床病型は,急性型11例(55%),リンパ腫型5例(25%),慢性型3例(15%),くすぶり型1例(5%)であったので,各臨床病型の相対頻度に合致する14.従って,特定の病型が濃縮されたわけではないと考えられる.
症例9では,末梢血中のプロウイルス量が低値で,HTLV-1 pX PCRの増幅産物も微量であった(Table 1, 2).一方,末梢血のM-FCMではCD2dim, CD3dim, CD4+, CD7−の単一なUCP分画が58%を占めた(Table 3).UCPにはCD25やCADM1陰性の細胞分画が含まれていたので(Figure 6B),非腫瘍性T細胞が混入していた可能性もあるが,逆に,PCRプライマーのアニーリング領域に変異や欠失が生じ,PCRの増幅効率が低下した可能性もある.検体中にHTLV-1感染細胞またはATLL細胞がどの程度含まれているかは,M-FCMやPCRの結果を総合して判定する必要がある.
CCR4遺伝子変異はナンセンス変異が最も多く,フレームシフト変異がそれに次ぐ9,10,12,15.今回の検討でもQ330*変異とY331*変異が高頻度であった.1塩基の挿入によるフレームシフト変異は認めなかったが,同変異の頻度は7–14%であるので 8-10,12,15,解析症例数が少ないことに起因する偏差の範囲内であると考えられる.症例5のc.1008_1025del, p.Q336Hは我々の調べた範囲では新規の変異である.Q336–T342をコードする18塩基が欠失しQ336Hにミスセンス変異していたが,P337(野生型ではP343)よりC末端は変異しない配列であった.類似の領域の欠失変異はMizutaらが報告している(c.996_1018del, p.C332Cfs*)が,我々の症例とは異なり,C332–A340の欠失とアミノ酸変異を伴わないフレームシフト変異に続いてストップコドンが生じる配列である15.症例5の変異が通常のナンセンス変異やフレームシフト変異と類似の機能獲得型変異かどうかはわからないが,本症例のCCR4の発現レベルはdimであった.一方,症例13では,CCR4遺伝子のコピー数の増加によるCCR4の発現亢進が予想される.実際,M-FCMによるCCR4の発現レベルは++であった(Table 3,Figure 7).
ヘテロ2本鎖移動度解析は,野生型と変異型のheteroduplex DNAのミスマッチ部分の立体構造が変化し(bulge型,bubble型),電気泳動上の移動度が野生型同士または変異型同士のhomoduplex DNAに比べ低下することを利用した解析法である16.
本法は,嚢胞性線維症におけるCFTR遺伝子変異や神経線維腫症I型におけるNF1遺伝子変異の検出,human immunodeficiency virus type-I(HIV-1)のサブタイプの同定におけるenv遺伝子やgag遺伝子の検索などに応用されている17-20.今回の変異陽性症例のheteroduplex DNAの変異部分の塩基対は,症例3と19がTAC→TAGによるC-C/G-G,症例8,10がCAA→TAAによるC-A/T-G,症例13がTAC→TATによるC-A/T-G,症例16がTAC→TAAによるC-T/A-Gで,CAA→TAAの症例8と10ではheteroduplexバンドが認められなかった(Table 2).本法は簡便であるが,変異塩基前後の塩基配列,変異の種類,PCR産物の長さ,泳動条件などの影響を受けるので,PCR・ダイレクトシークエンシングの代替法としては不十分である.
C末端が変異したCCR4分子は,リガンドが結合しても細胞内への内在化が阻害されるとすると,CCR4遺伝子変異陽性例ではCCR4の発現レベルが増強する可能性がある.実際,免疫組織染色でCCR4の発現レベルをスコア化した研究では,ナンセンス変異例でCCR4の発現レベルが高いことが証明されている10.一方,ATLLで高頻度にC末端が変異するPD-L1では,N末端とC末端に対する2種類の抗体で免疫染色を行うと,C末端変異例ではC末端に対する抗体の反応性が低下するため,変異陽性例と陰性例を免疫染色で鑑別することが可能である21.CCR4でも,N末端とC末端の抗体で免疫染色すると,CCR4遺伝子変異陽性例ではC末端の抗体による染色性が低下していることが明らかになった22.本研究では,CCR4の発現レベルを−(陰性)から++(強陽性)の4段階に分類したところ,CCR4の発現レベルとCCR4ナンセンス変異が相関する可能性が示唆された.両者の相関関係を統計学的に証明するためには蛍光強度や抗原密度を数値化する必要があるが,そのためには,CCR4抗体の蛍光色素であるPEの検出器FL2の検出感度の設定や,細胞サイズの指標である前方散乱光(FSC)の感度などを一定にすることが求められる.今後,これらの技術的な問題を解決し,免疫組織染色に比して迅速性・定量性に勝るM-FCMを用いたCCR4の発現レベルの評価が,CCR4遺伝子のナンセンス変異の予測につながるかどうかを検討したい.なお,フレームシフト変異とCCR4の発現レベルとの関連は今回検討することができなかったので,併せて今後の課題としたい.
CCR4遺伝子変異とATLLの治療予後を解析した論文は3編報告されている9,10,12.Yoshidaらは113例のATLL症例を解析し,30例にCCR4遺伝子変異を認めた10.遺伝子変異陰性例(75例)と陽性例(27例)のOSには差を認めなかったが,フレームシフト変異陽性例(8例)のOSはナンセンス変異例(19例)と変異陰性例と比較して有意に不良であった10.一方,Sakamotoらのシリーズでは,同種造血幹細胞移植非実施でモガムリズマブの投与をうけた42例のうち,変異陽性例(11例)のPFSとOSは変異陰性例(31例)と比較して有意に良好で,有意差はアグレッシブATLL(38例)でより顕著であった9.しかし,Kawanoらのシリーズでは,モガムリズマブ治療に対する変異陽性例の優位は認めていない12.今回の検討では,モガムリズマブ投与例はわずか5例であるので,CCR4遺伝子変異との相関を議論することはできないが,ナンセンス変異陽性であった症例8はモガムリズマブ単独治療によってPRの効果が得られた.CCR4遺伝子変異との関係を明らかにするためには,M-FCMによるCCR4の発現レベルや%UCPの評価を含めた前向きの臨床試験が必要である.
本研究に関し,開示すべきC.O.I関係にある企業などはありません.