2022 Volume 25 Issue 1 Pages 1-13
2022 Volume 25 Issue 1 Pages 1-13
“セラノスティックスtheranostics”は,“治療therapy”と“診断diagnosis”を組み合わせた造語である.PubMedで“theranostics”を入力すると論文数は急上昇している.2021年はあと2か月を残した時点ですでに9,075報の論文が発行されているので,医学研究ではトレンディなキーワードの一つといってよいであろう.本講演では,セラノスティックスに至る画像診断の進歩を概説し,腫瘍核医学の領域で現在行われているセラノスティックスの実例を紹介する.
画像診断学とは「生体における評価したい情報を,科学技術の力で可視化し,それを臨床に役立つ情報へと昇華させる学問」と定義できるであろう.画像診断学はレントゲン博士がドイツのWürzburg大学でX線を発見したことに端を発する.当時は図1に示した手のX線写真のような画像であったが,その後の医用工学の進歩に伴って画像は変化し,同時にエビデンス・常識も常に変化してきた.しかし画像診断学の目的は,治る異常をみつけて生命予後を延長させることと,治らない異常であってもQOLを考慮した治療につなげること,という画像診断の目的はかわらない(図1).

現在臨床で用いられている画像診断法として,1)単純X線写真,2)上部・下部消化管透視・注腸検査,血管造影,胆道造影,尿路造影,3)超音波,4)CT,5)MRI,6)核医学検査などがあげられる.このなかで,4)CTでは検出器の多列化,5)MRIでは高磁場化・高速撮像が図られ著しく進歩している.CT/MRIは実施件数も多く,今日なくてはならない医用画像である.一方,医用画像は形態画像と代謝画像の二つにわけることができるが,代謝画像は核医学検査が得意とするところである(図2).つまり生体内で何が起きているのかという情報を画像化することが可能である.さらに,今世紀に入りPET/CT,SPECT/CT,PET/MRIといった複合機が登場し,形態の情報と代謝の情報を同時に評価できるようになった.代謝情報は予後に関する情報も有する例を示す.図3は肝細胞癌の症例であるが,上段の症例はFDGの集積が高く,組織型は低分化であるが,下段の症例はFDGの集積が低く,組織型は高分化である.京都大学肝胆膵・移植外科の波多野教授は,腫瘍と正常肝のSUV比が2以下と2以上の2群に分けると2以上の群が有意に予後不良であることを報告されている 1 .


セラノスティックスは,広義には「各種治療法の選択を最適化するためにふさわしい診断的方法を併用する」という意味に使われることもあるが,狭義の「ひとつの担体に診断的機能と治療的機能をもたせる」技術として狭義で使われていることが多い概念である.診断技術と治療の融合という観点からみると,放射線科で以前から行われてきたinterventional radiology(IVR)も含むことになるが,セラノスティックスはIVRとは異なり,薬剤を体内に投与し,生体内の情報を画像としたうえで,主に腫瘍に対する個別化治療を行うところに特徴がある.
実はこのような診断と治療は核医学領域では古くから行われてきた.例えば,転移性甲状腺癌やバセドウ病に対する131I(ヨウ素)内服治療では,少量の131Iを投与して診断を行った後,131Iカプセルを投与してβ線による内部照射を実施し,治療後にどこに131Iが集積したかを確認するイメージングを行う.また再発・治療抵抗性の低悪性度リンパ腫に投与するイブリツモマブ・チウキセタン(ゼヴァリン®)は,まず111In(インジウム)標識抗CD20抗体を投与し,シンチグラフィで骨髄などに集積がないことを確認したうえで,治療薬である90Y(イットリウム)標識抗CD20抗体を投与し内部照射を行う.つまり,セラノスティックスという言葉は新しいが,核医学では新しい概念ではない.
さて,セラノスティックスはすでに医療現場に登場し普及が進んでいる.核医学領域における実例として,まず,ソマトスタチン受容体を標的とした神経内分泌腫瘍の診断と治療を概説し,次に現在ブームといってよいほど世界中で行われているprostate-specific membrane antigen(PSMA)を標的とした前立腺癌の診断と治療を紹介しよう.最後にこれから発展が期待される標的についても簡単に触れる.
神経内分泌腫瘍(neuroendocrine tumor; NET)は,その名前の通り神経内分泌細胞に由来する腫瘍で,膵臓,消化管,肺などの臓器に発症する.NETは緩徐に進行することが多く,以前はカルチノイドともよばれていたが,悪性度には幅があり,転移することがある.グレードの低いNETはFDGの集積が低いために18F-FDG-PETでは原発巣だけでなく転移巣も見逃してしまう.そこで,ソマトスタチン受容体を標的とする検査薬を投与し,その集積状態を評価することで病巣の検出が効率的に行える.
ソマトスタチンは14個のアミノ酸からなる環状ペプチドで,膵臓・消化管・脳などに分布し,神経伝達物質としてホルモン分泌抑制や細胞増殖抑制などの役割を果たしている.NETは腫瘍細胞の細胞膜上にソマトスタチン受容体を強く発現しているのでセラノスティックスの絶好の標的となる.ソマトスタチンは短時間で分解され薬剤としての利用が困難なため,血中で安定性の高いソマトスタチン類似体のオクトレオチドにキレート剤を介して放射性同位体を結合させた薬剤が開発されている(図4).

ソマトスタチンは14個のアミノ酸からなる環状ペプチドで,生体内では短時間で分解される.生物活性に重要な4個のアミノ酸(Phe-Trp-Lys-Thr)を含む8個のアミノ酸からなる合成類似体オクトレオチドは生体内で安定である.
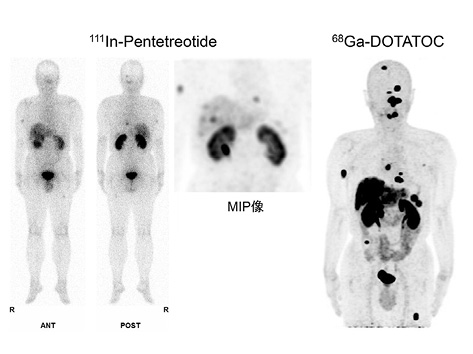
現在,日本では111Inで標識したオクトレオチドのペンテトレオチド(オクトレオスキャン®)が保険承認されているが,欧米では68Ga(ガリウム)で標識したオクトレオチドのDOTATOCまたはDOTATATEや64Cu(銅)で標識したものが用いられている.いずれもソマトスタチン受容体に結合する薬剤であるが,111Inはγ線を,68Gaと64Cuはポジトロンを放出するので,後2者ではPETを撮像することができる(図5).図6は,膵臓に発症したNETの患者で,まずオクトレオスキャン®で画像を撮ったあと,4時間後にDOTATOCでPET画像を撮ったものである.前者によるSPECTから作成したMIP画像でも,胸骨,右上腕骨,左大腿骨の骨転移や肝転移を指摘することができるが,後者ではPETならではの高解像度画像が得られ,多発性の骨転移が明瞭になり,肝転移もびまん性であることがわかる.68Ga標識オクトレオチドによるNETの診断成績のメタ解析がすでに10年近く前に発表されているが,感度・特異度とも90%を超え,ROC曲線のAUCも0.96または0.98であるので,高精度の画像診断が可能であることがわかる2, 3.

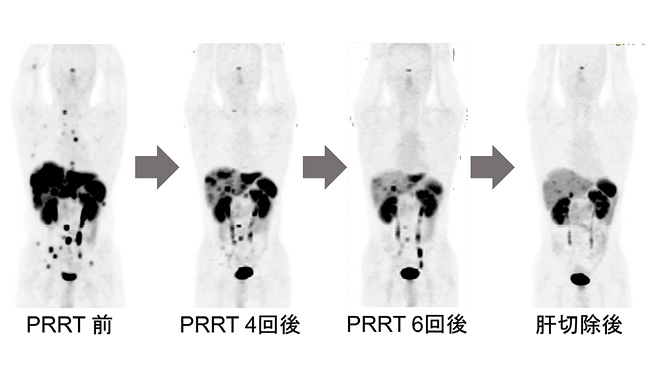
次に,核種をβ線を放出する90Yや177Lu(ルテチウム),α線を放出する213Bi(ビスマス)や225Ac(アクチニウム)に変更すると,粒子線を用いた内照射が可能になる.このような治療をペプチド受容体放射性核種治療法(Peptide Receptor Radionuclide Therapy; PRRT)とよぶが,核種をかえることによって診断から治療に直結する(図5).図7は膵臓原発のNETに対してPRRTを実施した症例の経過である.治療前には,原発巣の膵臓病変と,多発肝転移,リンパ節転移,骨転移が認められる.PRRTを4回実施後にはこれらの病変が退縮し,さらに2回追加すると肝左葉外側域に病変を残すだけになったので,この病変は外科切除された.
中腸由来ソマトスタチン受容体陽性NETに対する177Lu標識DOTATATE(Lutathera)の多施設共同ランダム化比較第3相試験(Netter-1試験)が実施された 4 .本試験では,高分化NETで転移を有する患者229例を,オクトレオチド徐放性製剤(サンドスタチンLAR)単独治療のコントロール群と,サンドスタチンLARに7.4ギガベクレルのLutathera(8週ごとに4回投与)を追加したPRRT群に振り分けた.その結果,主要評価項目のPFSは20か月の時点でコントール群が10.8%であったのに対しPRRT群が65.2%,PFS中央値はコントロール群が8.4か月,PRRT群は未到達,奏効割合はコントロール群が3%,PRRT群が18%であった(表1) 4 .欧米では中腸(空腸と回腸および結腸の一部)由来の頻度が高いのに対して,わが国では直腸と膵臓の頻度が高く,直腸原発NETの予後が悪いので,本試験の結果をそのまま日本人にあてはめてもよいかどうかの問題はあるにしても有効性は期待できそうである.ただし,メタ解析では,奏効割合(完全奏効[CR]+部分奏効[PR])が30%,病勢コントロール割合(CR+PR+安定[SD])が70–80%であるので 5 ,本剤でもNETを根治することは困難かもしれない.

図8にヨーロッパのNET診療ガイドラインを示す 6 .NETは,まず神経内分泌癌(neuroendocrine cancer; NEC)を区別し,核分裂像の数とKi67指数によってNET G1, G2, G3に分類される.ソマトスタチン受容体陰性のものとNECはそもそもPRRTの適応にはならないが,NET G1/G2 に対する全身治療として,PRRTは通常の薬物療法に続く治療法に位置づけられており,特にKi-67 indexが10%未満の小腸NETでは,エベロリムスに先行することも考慮されている.現在,Netter-2試験が進行中であるので,結果によってはPRRTが早期に実施されるようになる可能性がある.
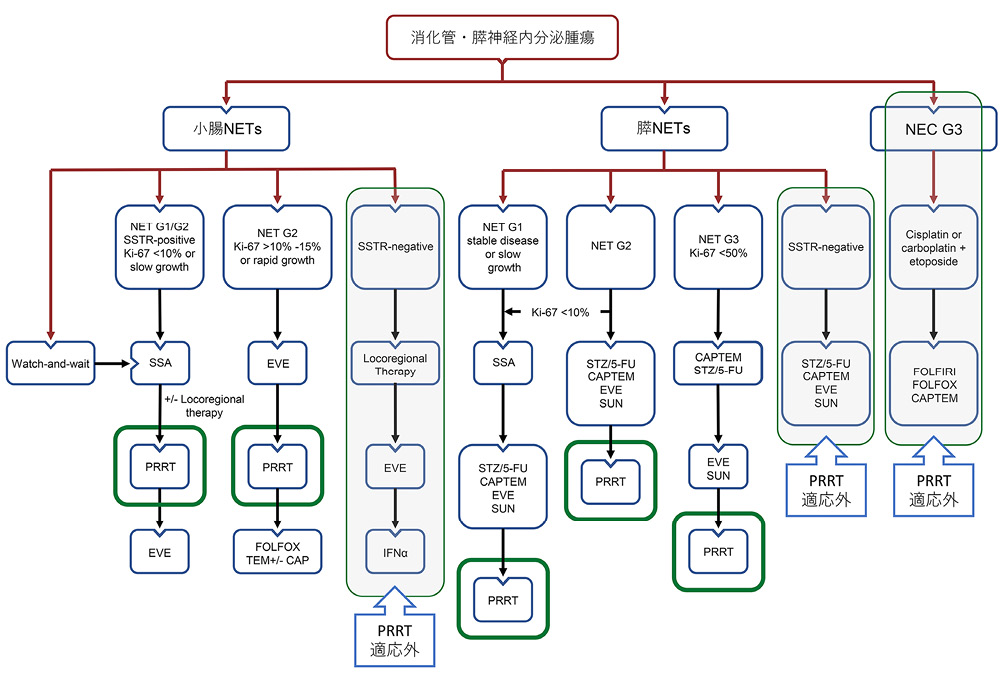
略語:NET,神経内分泌腫瘍;NEC,神経内分泌癌;SSTR,ソマトスタチン受容体;SSA,ソマトスタチンアナログ;EVE,エベロリムス;PRRT,ペプチド受容体放射性核種治療法;CAP,カペシタビン;TEM,テモゾロミド;SUN,スニチニブ
(文献6から引用)
ルテチウムオキソドトレオチド(177Lu)は,ルタテラ®静注の商品名で2021年9月に日本でも承認された(https://www.pdradiopharma.com/_assets/docs/pdf/hcw/products/therapeutic10.pdf).有害事象は,多くが重篤なものではないが,骨髄抑制と腎機能障害がある.晩期毒性として,海外での試験で骨髄異形成症候群・急性骨髄性白血病が報告されている.なお,PRRTに用いる核種は,まだ承認には至っていないが,α線放出核種への展開も進んでいる.α線によるDNA二重らせん構造の破壊がもたらす殺細胞効果はβ線のそれに比べると,言ってみれば,大砲と拳銃ほどの違いがある.文献上ではルタテラ®に不応であった肝転移巣が213Biで標識したDOTATOCによって消失したとの報告も出ている 7 .今後は病態に応じて核種を選択する時代に向かうであろう.
次に,前立腺癌の画像診断と治療に進もう.前立腺癌の細胞表面に発現している分子を標的とした多くの放射性検査薬が開発されてきた(図9).日常的に用いられる18F(フッ素)-FDG-PETでは,前立腺癌は必ずしも陽性描画されない.前立腺癌用のPET製剤として11C/18F標識コリンが2012年に,18F標識FACBC(フルシクロビン)が2016年にFDAに承認された(図10).


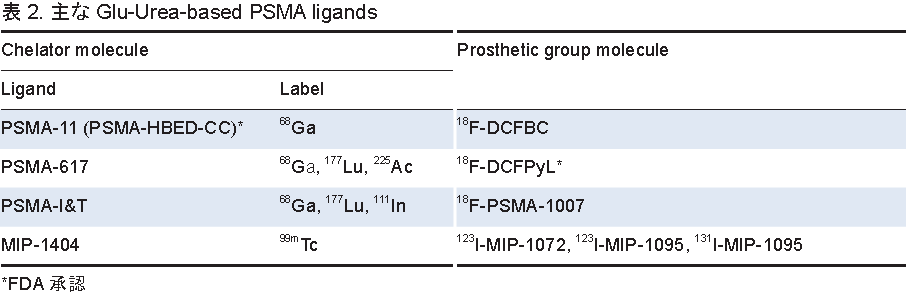
さて,現在最も注目されているのが前立腺特異的膜抗原(prostate-specific membrane antigen; PSMA)を標的とした診断と治療である.PSMAは膜貫通型糖タンパク質で(図9),前立腺癌では悪性度や病期に比例して発現が亢進する.PSMAはグルタミン酸加水分解活性を有するので,PSMAに結合性を有するグルタミン酸含有非対称ウレア型化合物(Glu-Urea-based PSMA ligands)を骨格とした製剤が開発されている.PSMA製剤は,金属核種をキレート結合した製剤と,化合物のなかに放射性同位体が組み込まれた製剤に分けられる(表2).これらの製剤のうち,68Ga-PSMA-11と18F-DCFPyLは,それぞれ,2020年と2021年にFDAに承認されている(図10).
ところで,68Gaと18Fはどちらもポジトロン放出核種であるのでPETが撮像可能であるが,両者には表3に示すような違いがある.68Gaの長所は,大がかりなサイクロトロンがなくてもジェネレーターがあれば入手できることである.サイクロトロンは数億円を要するがジェネレーターであれば1,000万円程度である.ただし,ジェネレーターの寿命は1年である.68Gaのもう一つの長所として,同一の被標識体をβ線を放出する177Luやα線を放出する225Acで標識することによって治療薬として用いることができる.一方,18Fはサイクロトロンを必要とするが,すでに初期投資が終わっていればジェネレーターを必要としない分,かえって有利かもしれない.18Fは68Gaにくらべてエネルギーが低いので飛程距離が短く,直ちに近傍のマイナス電子と衝突してγ線を出すのでPET画像が鮮明になる利点がある.

Domachevskyらの論文では,MRIなどでは指摘できなかった前立腺癌の外腸骨領域リンパ節転移が,68Ga-PSMA-11をトレーサーとしたPET/CTやPET/MRIで明瞭に陽性描画できた症例が提示されている 8 .前立腺癌の骨転移は,現在では骨シンチグラフィーで評価することが多いが,Pykaらの論文では68Ga-PSMA-PETを用いると126人中75人が骨転移陽性であった9.68Ga-PSMA-PETは骨シンチグラフィーと比較して,感度・特異度とも優れている 9 .
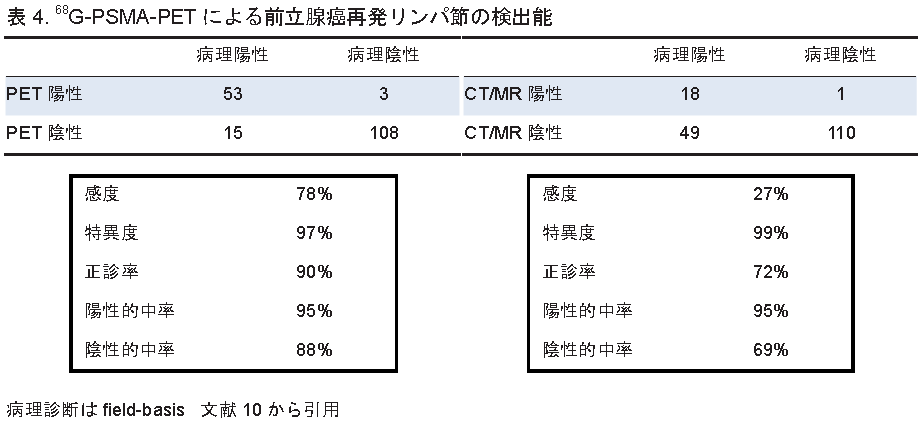
Rauscherらは生化学的再発をきたした前立腺癌患者48人の179領域のリンパ節を生検したところ,68領域が病理学的に再発病変であった.これらのリンパ節転移が生検前に68Ga-PSMA-PETで検出できたかどうかを後方視的に検討し,CT/MRIによる形態診断の結果と比較した.その結果, 68Ga-PSMA-PETは感度78%,特異度97%,正診率90%で,CT/MRIより明らかに優れていた(表4) 10 .偽陽性があったため特異度がやや低くなっている.このように68Ga-PSMA-PETには前立腺癌の再発病変を検出することに期待が大きいが,PSA値が高くなるほど有所見率も高くなるとされており 11 ,PSAが2 ng/mLをこえると,約9割の患者で再発病巣が陽性描画される.
メタ解析の結果もすでに報告されており,16文献1,308症例で,68Ga-PSMA-PETの前立腺癌の診断精度は,感度・特異度とも86%,AUCは0.9である.世界的にみれば,68Ga-PSMA-PETはすでに「前立腺癌用のFDG-PET」というような位置づけである.別のメタ解析では,病期診断の精度を検討している.この解析では前立腺摘出術の際に採取したリンパ節の病理診断を最終診断としているので,68Ga-PSMA-PETといえども偽陰性が避けがたいが,それでも感度74%,特異度96%である 12 .生化学的再発では,PSA < 2 ng/mLで検出率63%,PSA > 2 ng/mLでは検出率94%で再発病巣が陽性描画された 12 .
では68Gaで画像診断したあと,β線を放出する177Luを使えば前立腺癌の治療ができるであろうか.去勢抵抗性前立腺癌63例に177Lu-PSMA-617を少なくとも2サイクル投与した試験では,PSA値で判定したPRは23.7%,68Ga-PSMA-PETで判定したPRは52.6%で,生存期間中央値は22.5か月であった 13 .さらにα線を放出する225Acに置換した225Ac-PSMA-617の成績も発表されており,177Lu-PSMA-617抵抗性の病変が消失した症例が提示されている 14 .
さて,京都大学の薬学研究科では,上述のグルタミン酸含有非対称ウレア型化合物骨格にスクシンイミジル基を導入するとPSMAに対する親和性が6倍向上することを見出し,これを18Fで標識したPET診断薬18F-FSU-880を合成した(図11) 15 .我々は本剤を人にはじめて(first-in-human)投与する第1相試験を実施し(「PSMAを標的とするPETプローブ18F-FSU-880の初期臨床評価:安全性,体内動態,被ばく線量,前立腺がん病巣への集積性の検討」UMIN000029343),本剤の安全性,体内動態,被ばく線量評価を行うとともに,前立腺がん病巣への集積性を評価・確認した.ついで前立腺がんの根治治療後の再発診断における18F-FSU-880 PET/CTの臨床的有用性を評価することを目的に第2相試験を実施した(特定臨床研究「前立腺がん再発診断における18F-FSU-880 PET/CTの臨床的有用性の検討」臨床研究実施計画番号 jRCTs051180037).この試験では,骨シンチグラフィーでは異常を認めなかったが,18F-FSU-880 PET/CTで胸椎に孤立性の転移巣を認め,放射線照射でPSAが低下した症例,膀胱の近傍にわずかな陽性像を認め,同じく放射線照射でPSAが低下した症例,18F-FDG-PET/CTで肺転移を認めたが,18F-FSU-880 PET/CTでは頭頂骨にも孤立性の転移を認めた症例などを経験した.本試験は2021年3月に終了したが,前立腺癌は上述のNETに比べると患者数がはるかに多いので,PSMAを標的としたセラノスティックス研究が世界中で行われている.

3番目はケモカイン受容体を標的としたセラノスティックスである.ケモカインは,白血球やリンパ球の体内移動や組織内局在を制御する一群のサイトカインで,二次構造の形成に重要なシステイン残基の配列によって,Cケモカイン,CCケモカイン,CXCケモカイン,CX3Cケモカインの4種類に分類される(図12).一方,ケモカイン受容体は7回膜貫通型受容体で,現在までに19種類の機能的受容体が同定されている.膜貫通部分は相同性が高いが,N末端の多様な構造が固有のリガンドを識別していると考えられている.成人T細胞白血病・リンパ腫ではCCR4(CCケモカイン受容体タイプ4)が発現し,抗CCR4抗体薬がすでに日常診療で使われている.

CXCR4(CXCケモカイン受容体タイプ4)のナチュラルリガンドはCXCL12で,CXCL12-CXCR4シグナル伝達は,細胞増殖,血管新生,がんの転移などに加えて,造血幹細胞やがん細胞と微小環境との相互作用に関与する 16 .CXCR4阻害薬は造血幹細胞の末梢血への動員やがん細胞の抗腫瘍剤や放射線治療に対する感受性亢進に用いられている 16 .放射線標識の分野では,ドイツの研究グループがCXCR4に結合性を示す68Ga標識化合物68Ga-Pentixaforを合成し,主として多発性骨髄腫の診断に用いている 17 .上述のオクトレオチドやPSMA製剤と同様に,68Gaをβ線またはα線放出核種と入れ替えれば治療への応用も可能になる.
68Ga-Pentixafor-PETと18F-FDG-PETを対比すると両者は相補的な関係にある.すなわち,68Ga-Pentixafor陽性の病変が18F-FDG陰性であったり,68Ga-Pentixafor陰性の病変が18F-FDG陽性であったりする 17 .従って,両者を併用すれば骨髄腫病変の検出感度が向上するであろう.また68Ga-Pentixafor陽性であれば,β線やα線放出核種による治療が可能であるが,陰性であればそのような治療は意味をなさないことになる.予後曲線をみると,68Ga-Pentixafor陽性群は陰性群と比較して予後不良,四肢骨や髄外に68Ga-Pentixafor陽性病変があれば予後不良である 17 .従って,68Ga-Pentixafor/18F-FDG-PET検査には,骨髄腫病変を描出することだけでなく,放射性同位体治療に向けた情報や予後予測の情報を提供することが期待される.
治療では,68Ga-Pentixafor/18F-FDG陽性の骨髄腫に対して68Gaをβ線放出核種の117Luで置き換えた117Lu-Pentixather(Pentixaforと少し構造が異なる)を投与したところ,骨病変と髄外病変が消失したとの結果が報告された 18 .117Luはγ線も放出するので,治療後にSPECTを撮像すると,薬剤がどこに集積したかを確認することができる.68Ga-Pentixafor-PETは,骨髄腫だけでなく,びまん性大細胞型B細胞リンパ腫,T細胞前リンパ球性白血病,副腎皮質癌,小細胞肺癌の原発巣や転移巣・浸潤組織を陽性描画することができる 16 .この結果はケモカイン受容体を標的としたセラノスティックスが多様な癌腫に応用可能であることを示唆している.
抗HER2(human epidermal growth factor receptor type 2)モノクローナル抗体のトラスツズマブは乳癌だけでなく胃癌にも用いられる.癌細胞がHER2を発現しているかどうかを調べるために,トラスツズマブを放射性同位体で標識したプローブが作製されている.高分子はクリアランスが遅いのでコントラスト得るために時間がかかることを考慮し,半減期が78.4時間の89Zr(ジルコニウム)を用いた報告がある 19 .また,理化学研究所と国立がん研究センターのグループは,半減期12.7時間の64Cuで標識した64Cu-DOTA-trastuzumabをHER2陽性乳癌患者に投与し,48時間後にPET検査を実施したところ,原発巣や脳転移巣に一致した集積を確認した 20 .近年では,トラスツズマブとは結合部位が異なる新規HER2抗体のペルツズマブを標識した研究も発表されている 21 .
癌細胞がHER2陽性かどうかだけで抗HER2抗体薬の有効性を完全に予測できるわけではないが,標的の発現の評価は治療前に重要であり,さらに治療用の核種で標識すれば治療にもつながる可能性がある.
最後に,セラノスティックスの領域でブレイクスルーをきたす可能性のあるfibroblast activation protein inhibitor(FAPI)を紹介しよう.がん組織は,がん細胞自体はむしろ少数で,がん細胞に随伴した線維芽細胞や線維組織から構成される間質が多くを占めている.腫瘍組織の間質では,正常の線維芽細胞は発現しないセリンプロテアーゼfibroblast activation protein(FAP)を高発現しているので,当初は抗腫瘍薬としてFAPの阻害薬(FAPI)が開発されたが,今日ではFAPIをセラノスティックスに用いようとする動きが加速している 22 .
68Gaで標識したFAPIをプローブとしてPETを撮像すると,肉腫,食道癌,乳癌,胆管細胞癌,肺癌,大腸癌など癌腫を問わず集積が認められる 22 .18F-FDG-PETでは集積の弱い上述のNET G1/G2や前立腺癌も陽性描画することができる.さらにFDGと異なり,脳・心臓・肝臓などの生理的集積が少ないという利点もある.がんの診断では,糖代謝の亢進をみるよりFAPをみたほうがよいかもしれない.ただ治療の立場からみると,FAPはがん細胞自体に発現しているわけではないので,α線ではがん細胞のDNAに到達しない可能性も議論されており,今後の推移をみている状況である.
抗腫瘍薬はきわめて高価である.従って,あらかじめ効果を予測し,効果が期待される最適の薬剤を選択して投与すべきである.効果予測のひとつの方法はがん関連遺伝子に生じている遺伝子変異検査である.2019年に多数の遺伝子変異を同時に調べるがん遺伝子パネル検査が保険収載され,がんゲノム医療中核拠点病院・拠点病院・連携病院で検査を受けることができる.遺伝子変異が見つかり,その遺伝子変異に対して効果が期待できる薬がある場合には,臨床試験などを含めてその薬の使用を検討することになる.画像検査では,マクロな視点で治療効果が見込める群と見込めない群に非侵襲的に層別化することが求められる.つまり画像診断には病変を見つけるということだけではなく,病変を評価することが期待されている.
核医学は,本来,1)放射性同位体を投与することによって生体の働き(機能・代謝)を定量化するものであったが,2)FDG-PETや骨シンチグラフィーが登場したことによって標的を認識して病変を同定することができるようになった.今日の腫瘍核医学は,3)受容体イメージングで,その病変が,たとえばソマトスタチン受容体を発現しているのか,PSMAが発現しているのかを評価し,4)核種を置き換えることによって内部照射療法につなげ,最後にもう一度イメージングして治療薬の生体や病変への集積具合を確認することを目指している(図13).本講演で,セラノスティックスは,3)と4)を基盤とした新たながん治療であることを理解していただければ幸いである.

1991年 京都大学医学部卒
1991-1992年 京都大学医学部附属病院 放射線科・核医学科 勤務
1992-1995年 北野病院 放射線科 勤務
1996-2000年 京都大学大学院医学研究科(京大医博)
2000-2002年 ミシガン大・ジョンズホプキンス大 リサーチフェロー
2002-2005年 先端医療センター 映像医療研究部 主任研究員
2005-2009年 京都大学大学院医学研究科先端領域
融合医学研究機構 助手( 特任)・助教
2009-2016年 京都大学大学院医学研究科放射線医学講座 講師
2016-2020年 京都大学医学部附属病院放射線部 准教授
2020- 年 京都大学大学院医学研究科放射線医学講座 教授
Award2005年 第44 回日本核医学会賞
2016年 久田賞(Annals of Nuclear Medicine 論文賞) 銀賞
2016年 臨放表紙賞
2017年 Asian Nuclear Medicine Academic Forum ポスター賞
2017年 第15 回産学官連携功労者表彰 厚生労働大臣賞
2020年 久田賞(Annals of Nuclear Medicine 論文賞) 銅賞
これは,2021年11月12日天理よろづ相談所学術講演会(座長:天理よろづ相談所病院 放射線科核医学(RI部門)御前 隆部長)で,主として非専門家を対象に行われた中本教授の講演を当研究所で編集したものである.