Abstract
症例は69歳女性. X年3月に咳嗽が出現,近医で撮像された胸部X線で右上肺野腫瘤影を認めた.肺化膿症が疑われ,抗菌薬投与されるも改善せず,同年7月に間欠的な血痰を呈し,胸部X線で指摘されていた陰影の増大を指摘され当科紹介となった.悪性腫瘍を念頭に経気管支肺生検,CTガイド下肺生検を施行も確定診断に到らなかった.その後一時腫瘤は縮小したが同年11月に再増大し,確定診断目的で胸腔鏡下肺部分切除を施行した.病理学的には気道を中心とした壊死性肉芽腫を認め,気管支中心性肉芽腫を示唆する所見であった.後に組織培養から Parvimonas micraが検出され,また病理組織内にグラム陽性球菌の集隗を認めたことから,本菌により気管支中心性肉芽腫の病理像を呈したと推測された.
Translated Abstract
A 69-year-old woman first presented to another hospital 2 months earlier with a cough for 2 months. Chest X-ray revealed a tumor in the right upper lobe and computed tomography (CT) of the chest suggested lung abscess. Antibiotics were administered orally for 3 weeks, but her condition did not improve. She developed hemoptysis intermittently and the lung tumor increased in size. She was referred to our department. Although transbronchial lung biopsy and CT-guided lung biopsy were performed, a definitive diagnosis could not be made. The tumor temporarily shrunk but increased again in size. Five months after referral, she underwent thoracoscopic resection of the right S2 segment. Pathological specimens revealed bronchocentric necrotizing granulomatous lesions and marked lymphatic follicles with germinal centers. Conventional bacterial culture detected no bacteria, acid-fast bacilli, or fungi, but anaerobic culture detected Parvimonas micra and re-examination of the pathological specimens revealed clusters of gram-positive cocci. We thus concluded that in this case P. micra, a gram-positive anaerobic coccus, was the causative pathogen of bronchocentric necrotizing granulomatosis.
緒言
気管支中心性肉芽腫(bronchocentric granulomatosis,以下BCG)は気管支・細気管支を中心に分布する壊死性肉芽腫を形成する疾患であり,1973年にLiebowが気管支・細気管支周囲に壊死性肉芽腫を認めた9例の症例報告をもとに提唱した病理組織学的概念である
1
.元々は, 原因の特定できない非特異的なものを指す病理学的用語だったが,その後の報告により,約半数が気管支喘息・アレルギー性気管支肺Aspergillus症と関連しており,また抗酸菌・真菌・寄生虫などの感染症,関節リウマチ,多発血管炎性肉芽腫症などでも同様の病理像を呈することが報告されている
2
.そのためBCGの診断には二次的に生じた病変であることを否定するために背景疾患の検索が重要である.
今回,口腔内グラム陽性嫌気性球菌のParvimonas micraにより,BCGの病理像を呈した1例を経験したので報告する.
症例
患者:69歳女性
既往歴:高血圧症
家族歴:肺結核(父),アレルギー・肺疾患・悪性腫瘍の家族歴なし
職業歴:主婦
粉塵曝露歴:なし
生活歴:園芸が趣味
喫煙歴:なし
現病歴:X年3月より咳嗽が続くため,5月上旬に近医を受診した.胸部CTで右肺上葉に45 mm大の肺腫瘤を認め,肺化膿症が疑われた.3週間の内服抗菌薬治療では改善しなかったものの,患者の希望により近医で経過観察されていた.7月上旬に血痰が出現し,胸部単純X線写真で腫瘤影が増大ししたため精査加療目的で当科を紹介受診した.8月上旬に経気管支肺生検を実施した際には,上皮下にリンパ球や形質細胞主体の炎症細胞浸潤を認め,免疫染色でCD20およびCD79a陽性細胞の増生を認めリンパ増殖性疾患を疑う所見であった.確定診断のために更にCTガイド下肺生検を行った所,経気管支肺生検同様にリンパ球,形質細胞主体の細胞浸潤を気道上皮下に認め,免疫染色を行うとCD79a, CD138, immunoglobulin G (IgG) が陽性の形質細胞が大部分を占め,リンパ球はCD3陽性細胞と濾胞状に集簇するCD20陽性細胞が混在していた.軽鎖制限はなく,IgG4/IgG比は10%未満であったが,IgG4陽性細胞が30個/high power fieldを占める領域を一部認め,IgG4関連疾患を含めリンパ増殖性疾患の可能性が考えられた.画像上は腫瘤内部を貫くように検体採取ができていることが確認されたが,生検の有効性については定かではなく,悪性疾患の否定も難しく確定診断には至らなかった.また,気管支洗浄液,気管支擦過洗浄液の培養を提出したが,一般培養,抗酸菌培養,真菌培養のいずれでも有意菌の発育を認めなかった.診断目的に,胸腔鏡下肺腫瘤切除を予定していたが気管支鏡検査直後にクラブラン酸カリウム375 mg,アモキシシリン水和物750 mgを3日間使用した後に腫瘤影がやや縮小していたため,経過観察の方針とした.同年10月下旬に血痰が再燃し,胸部単純X線写真で腫瘤影が再増大しており,精査加療目的で同年12月に入院となった.
現症:身長155.3 cm,体重51.1 kg,体温36.7℃,血圧136/86 mmHg,脈拍数77 回/分・整,呼吸数18 回/分,SpO2 98%(室内気),眼瞼結膜蒼白・眼球結膜黄染なし.口腔内はやや乾燥し,全歯牙に齲蝕もしくは歯石の付着を認める.表在リンパ節の腫脹,圧痛なし.心音,呼吸音は正常.撥指,皮疹なし.関節症状なし.
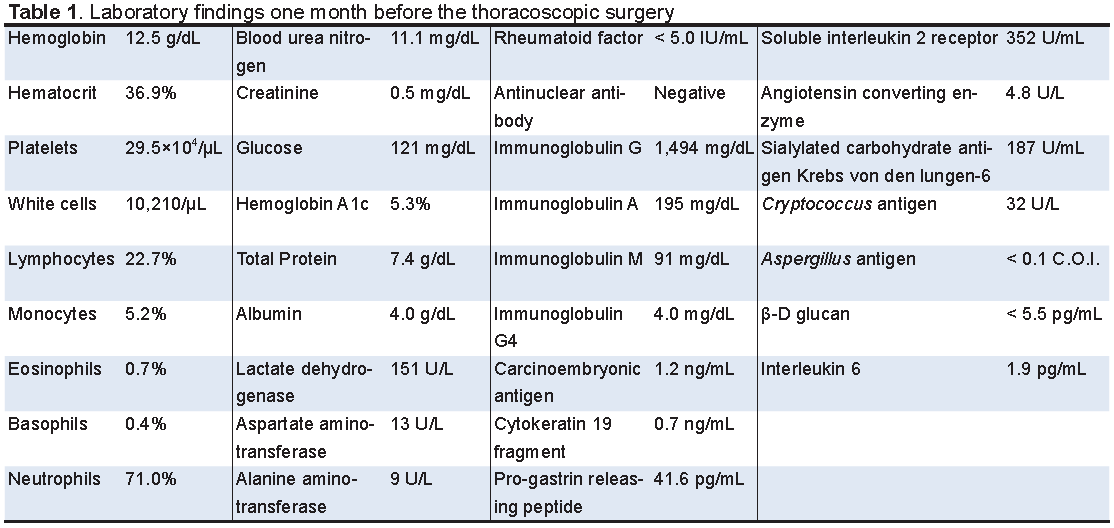
検査所見(Table 1):白血球,CRP値の軽度上昇を認めた.真菌抗原,可溶性IL-2受容体,ACE,腫瘍マーカーは正常範囲内であった.
画像所見:胸部単純X線写真をFigure 1に示す.当科初診時(Figure 1A),手術直前(Figure 1B)の胸部X線で右上肺野に腫瘤影を認める.当科初診時に撮像した胸部CT(Figure 2A, B)では,右S2胸膜下に長径62 mmの分葉状腫瘤を認め,腫瘤内部に低濃度域を有していた.腫瘤に流入するB2a気管支管支血管束に不整な肥厚を認めた.Fluorodeoxyglucose-positron emission tomography (FDG-PET) では,腫瘤内部にmaximum standardized uptake value (SUVmax) 6.7の有意集積を認め,同側肺門部・縦隔リンパ節にも有意集積を認めた.胸腔鏡下肺生検直前に再検した胸部CT, FDG-PETでも同様の所見を認めた(Figure 2C, D).
入院後経過:術前歯科対診では,全歯縁下に歯石と多量の歯垢の沈着を認め口腔内衛生状態不良が確認されたため,歯石除去及びブラッシングとブラッシング指導を行った.右上葉腫瘤については画像所見上も悪性腫瘍の否定が難しかったため,診断目的に胸腔鏡下右S2区域切除を実施した.迅速細胞診で悪性所見を認めず区域切除に留め,リンパ節は術前のFDG-PETで集積の見られた右11番リンパ節と12番リンパ節を切除した.感染症の関与も念頭に,切除肺を清潔操作で切断し内腔の壊死物を含む長径1 cm程度の組織片を組織培養として,一般培養,抗酸菌培養,真菌培養,嫌気培養に提出した.
病理組織所見:切除肺(Figure 3)には細気管支を中心とした気道上皮傷害,壊死性病変を認めた.Figure 4 に示す通り,壊死周囲には組織球の索状の増生を認め,壊死性肉芽腫を示唆する病変であった.壊死や細気管支周囲には著明な形質細胞浸潤を認めるものの, κ鎖,λ鎖の比は2未満を示し,Table 2の通り免疫グロブリン遺伝子再構成,T細胞受容体遺伝子再構成を認めなかった.また,壊死を認めない細気管支には胚中心を伴うリンパ濾胞が形成されていた.組織学的に真菌,抗酸菌も指摘できず切除肺の病理像はBCGに矛盾しなかった.壊死を認める気道の内腔には,Gram positive cocci (GPC) の集塊を認めた(Figure 5).組織培養検査では真菌,抗酸菌は検出されなかったが,嫌気培養よりP. micraが検出された. 同時に切除した右11番リンパ節,12番リンパ節に悪性所見を認めなかった.病変部の切除後は,画像上再発なく経過している.
考察
咳嗽,血痰で発症し増大と縮小を呈した肺腫瘤影に対して胸腔鏡下切除を行い,BCGの病理像を呈し,P. micraの関与が示唆された一例である.
BCGは,病理組織学的概念が先行する病態で,気管支,細気管支上皮における非特異的な壊死性肉芽腫とされる
1
.詳細な病理学的機序については解明されていないが,慢性的な気道粘膜への刺激とそれによって引き起こされる気道上皮傷害,滲出物や壊死物による細気管支の閉塞,虚脱が本態と考えられており
1, 3
,同様の病理像を呈しうる感染症の除外が必要とされる.BCGの病理像を呈する感染症としては,Echinococcus症
4
,Blastomyces症
2
,Histoplasma症
2
,influenza A型感染症
5
,結核
6
,非定型抗酸菌症
7
,Mycoplasma肺炎
8
やAspergillus属以外の真菌感染症の報告
9
がある.特に真菌感染症の中には,肺組織培養検査で確定診断できず,後に出現した骨病変で確定診断された症例もあり,診断が難しい例がある.検索し得た範囲内で,気管支中心性肉芽腫を呈する感染症,もしくは気管支中心性肉芽腫症の診断における組織培養検査において,嫌気培養の提出に言及した報告は確認できなかった.
P. micraは,口腔内や気管支,消化管に常在するグラム陽性嫌気性球菌の一種であり,慢性根尖性歯周炎の原因菌
10
としても知られる.感染性心内膜炎,化膿性脊椎炎など血流感染症
10
の他,膿胸や肺化膿症の報告例
11-13
がある.膿胸や肺化膿症の症例においては気管支洗浄液,CTガイド下生検検体の培養検査で確定診断されていた.P. micraによる感染症は,糖尿病,心臓弁置換術後,腹部手術後,消化管穿孔,婦人科疾患を背景とし
10
,血流感染症を呈する例においては院内死亡率が3–4%程度を呈する
10
.penicillin系,cephem系抗菌薬の感受性が良好であり,他のグラム陽性嫌気性球菌による血流感染症の院内死亡率が25%とされるのと比較すれば,適切な治療を行うことができれば本菌による感染症は比較的予後良好である
10
.本症例では術前口腔ケアを要するほどの歯石,歯周病を認めていたことから,口腔内細菌が肺の腫瘤性病変と関連していると推測された.検索し得た範囲では,P. micraによりBCGの病像を呈した報告はなかった.P. micraによる感染性大動脈瘤の切除例で,病変部に壊死性肉芽腫を認めたと報告されており
14
,同菌により壊死性肉芽腫を生じる可能性がある.本症例においては,組織学的な検査において,傷害された気道内腔にP. micraに矛盾しないGPCの集隗を認めた点,短期間の抗菌薬治療により腫瘤が縮小し炎症所見も改善した点,口腔内感染症が存在した点から,肺に感染したP. micraによってBCGが生じた結果,肺腫瘤影を呈した症例と考えられる.本例の確定診断においては,病理組織学的評価に細菌学的評価の裏付けを要しており,詳細な病理像の把握と細菌学的な評価を目的とした肺生検,及び,嫌気培養も含めた組織培養検査が有効であったと考えられた.
結語
悪性腫瘍との鑑別を要する腫瘤影を呈し, 経気管支肺生検,CTガイド下肺生検で確定診断できず,胸腔鏡下肺生検にてP. micraの関与が示唆されるBCGの病理像を呈した一例を経験した.特発性とされるBCG症例の中にも,嫌気性菌が関与している症例が存在する可能性もあり,詳細な細菌学的な検査が必要である.
著者のCOI (conflicts of interest) 開示
本論文発表内容に関して特に申告なし.
付記
本例は,第97回日本呼吸器学会近畿地方会(2021年7月10日)において発表した.
参考文献
- 1. Liebow AA. The J. Burns Amberson lecture–Pulmonary angiitis and granulomatosis. Am Rev Respir Dis 1973;108:1-18.
- 2. Myers JL, Katzenstein AL. Granulomatous infection mimicking bronchocentric granulomatosis. Am J Surg Pathol 1986;10:317-322.
- 3. Mourad WA, Vallieres E, Power RF, et al. Fine-needle aspiration cytology of bronchocentric granulomatosis: A potential diagnostic pitfall. Diagn Cytopathol 1996;14:263-267.
- 4. Den Hertog RW, Wagenaar SS, Wastermann CJ. Bronchocentric granulomatosis and pulmonary echinococcosis. Am Rev Respir Dis 1982;126:344-347.
- 5. van der Klooster JM, Nurmohamed LA, van Kaam NA. >Bronchocentric granulomatosis associated with influenza-A virus infection. Respiration 2004;71:412-416.
- 6. Maguire GP, Lee M, Rosen Y, et al. Pulmonary tuberculosis and bronchocentric granulomatosis. Chest 1986;89:606-608.
- 7. 大嶋 智子, 土屋 一夫, 山田 孝, 他. 気管支中心性肉芽腫像を呈した肺Mycobacterium avium症の1例. 日本呼吸器学会誌 2016;5:106-109.
- 8. Keijzer A, Daniels JM, Slieker WA, et al. [Bronchocentric granulomatosis and mycoplasmal pneumonia]. Ned Tijdschr Geneeskd 2004;148:332-336.
- 9. Mukhopadhyay S. Granulomatous lung disease. In: Non-Neoplastic Pulmonary Pathology: An Algorithmic Approach to Histologic Findings in the Lung. Cambridge: Cambridge University Press;2016:35-121.
- 10. Watanabe T, Hara Y, Yoshimi Y, et al. Clinical characteristics of bloodstream infection by Parvimonas micra: Retrospective case series and literature review. BMC Infect Dis 2020;20:578.
- 11. Yun SS, Cho HS, Heo M, et al. Lung abscess by Actinomyces odontolyticus and Parvimonas micra co-infection presenting as acute respiratory failure: A case report. Medicine (Baltimore) 2019;98:e16911.
- 12. 大利 亮太, 山川 英晃, 萩原 恵里, 他. Parvimonas micraによる膿胸の1例. 感染症学雑誌 2018;92:891-896.
- 13. Gorospe L, Bermudez-Coronel-Prats I, Gomez-Barbosa CF, et al. Parvimonas micra chest wall abscess following transthoracic lung needle biopsy. Korean J Intern Med 2014;29:834-837.
- 14. Takigawa T, Baba H, Hisahara M, et al. Use of computed tomography-guided biopsy to detect Peptostreptococcus micros-induced mycotic abdominal aortic aneurysm after endovascular repair. J Vasc Surg Cases Innov Tech 2019;5:477-480.