2023 Volume 26 Issue 1 Pages 1-13
2023 Volume 26 Issue 1 Pages 1-13
昭和40年から昭和52年まで京都大学医学部第一外科教授を務められた本庄一夫先生は,直腸癌の術後2年目に発見された転移性肝癌の22歳男性に対して,昭和24年に,腰椎麻酔下で肝門部脈管処理を行った世界初の系統的肝右葉切除術を実施された(図1) 1 .本庄先生の次は,戸部隆吉先生,日笠頼則先生,小澤和恵先生の時代になり,国内第2例目の生体肝移植は小澤先生のリーダーシップのもとに実施された.次いで,今村正之先生,山岡義生先生,田中紘一先生の時代が続き,肝移植は田中先生がレシピエントを,山岡先生がドナーを担当された.山岡先生には「肝臓癌は必ず再発する.再発したらまた治療する.癌と仲良くして長生きする.絶対に諦めない.」こと,2006年に着任された上本伸二先生には「自分で限界を作ったらいけない.」ことを教えていただいた.

京都大学外科には限界を打破してこうというチャレンジ精神がある.1990年に開始された肝移植は,肝臓癌に適応が広がり 2 ,血液型不適合でもリツキシマブを導入することによって通常の移植と遜色のない成績が出るようになった 3 .バッドキアリ症候群 4 ,広範囲門脈血栓 5 ,small-for-size 6 などの難題にも取り組んできた.私も「できるものを簡単にあきらめていないか?勝手に限界を作っていないか?」と教室員を鼓舞している.京都大学には全国各地から患者さんが来られるので,我々が手術できないと匙を投げるわけにはいかない,自分たちは最後の砦だというプライドを持って診療にあたっている.
2017年のがんの統計によると 7 ,肝臓癌の罹患者数は男性では5位,女性では7位,膵臓癌は男性では7位,女性では6位,胆嚢・胆管癌は男性では13位,女性では11位である.一方,死亡数をみると膵臓癌,肝臓癌,胆嚢・胆管癌がそれぞれ4位,5位,6位を占め,肝胆膵を合計すると1位の肺癌を上回る.5年生存率では,胃癌が63.3%,結腸癌・直腸癌が70.1%と67.5%であるのに対して,肝臓癌は27.9%,胆道癌は21.1%,膵臓癌は7%である.10年生存率でも,前立腺癌,甲状腺癌,乳癌が80%以上に達しているのに対し,胆嚢・胆道癌16.2%,肝臓癌14.6%,膵臓癌は5.4%とワースト3を占めている.肝胆膵癌の治療成績が悪い原因として,早期発見が困難であること,肝臓癌では背景肝の問題があることや5年以降も再発することなどが挙げられている.今後は,ますますすすむ高齢化社会において体への負担の少ない治療で進行癌を治すことが要求される.
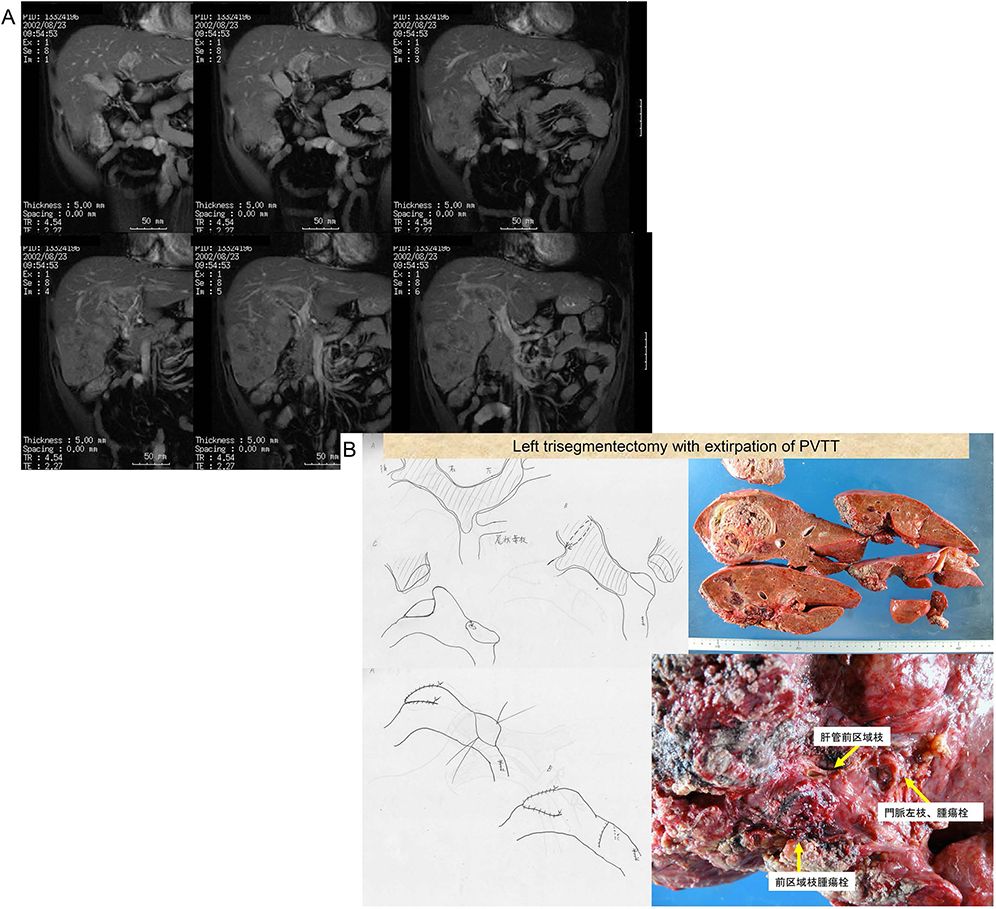
肝臓癌(肝細胞癌)の特徴は,門脈内に腫瘍が浸潤し,門脈にそって腫瘍栓を形成することである.その結果,門脈血流が遮断され,肝不全に陥ったり食道静脈瘤破裂をきたしたりするため(図2),生存期間中央値はわずか2.7か月にすぎないとされていた 8 .熊田馨先生は,世界初となった門脈腫瘍栓手術の成績を報告した 9 .その結果によると,肝切除術を受けた398例のうち13例で遺残門脈腫瘍栓を摘出し,報告時点で7例が生存し平均生存期間は16か月であった 9 .図3に示す症例は肝右葉に大きな腫瘍があり,門脈腫瘍栓が対側にまで進展している.我々はまず門脈左枝,次いで前区域枝を切除して腫瘍栓を摘出した後,開口部を縫縮した.術後は種々の合併症をきたしたが,患者さんには大変感謝していただいた.

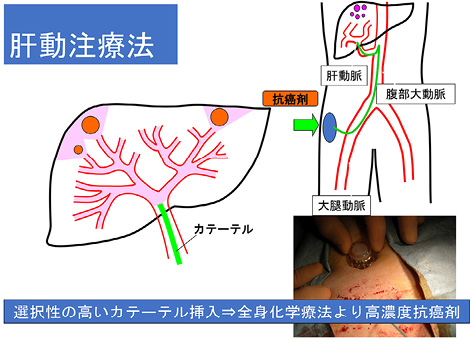
残念ながら,門脈腫瘍栓を摘出しても速やかに再発する.そこで我々は門脈本幹または第一分枝に腫瘍栓を認める肝細胞癌を対象として,肝切除術2週間後に肝動脈にカテーテルを留置し,シスプラチンと5-FUを選択的に動脈内投与するプロトコールを開発した(図4) 10 .その結果,手術+動注群の全生存期間中央値は手術単独群と比較して21.5か月から33.2か月に延長した 10 .次いで,日本肝胆膵外科学会プロジェクト研究として全国の22施設から高度門脈腫瘍栓を伴う肝細胞癌症例535例を集積した 11 .これらの症例を解析した結果,無病生存期間中央値は手術単独群が5.4か月,手術+動注群が9.3か月,全生存期間中央値は手術単独群が18.7か月,手術+動注群が28.1か月,5年生存割合は手術単独群が22.1%,手術+動注群が32.6%であった 11 .この結果から,高度門脈腫瘍栓を伴う肝細胞癌に対しても積極的に肝切除術を実施し,かつ術後早期に抗腫瘍剤を肝動脈内に投与するという我々の治療ストラテジーが正しいことが証明された.
転移性肝癌の外科治療
冒頭で胃癌と大腸癌の治療成績は良好であると述べたが,それは3期までであって,4期になると成績が著しく悪くなる.いうまでもなく,4期は他臓器転移を指し,転移臓器は肝臓が圧倒的に多い 12 .大腸癌では8割近くが肝臓である 12 .従って,4期の大腸癌の治療成績の向上は,肝転移をいかに治療するかにかかっている.転移性肝癌のガイドラインでは,大腸癌は神経内分泌腫瘍と並んで肝切除術が推奨されている.生存曲線をみても,切除症例の生存は化学療法などと比較して良好である 13 .しかし,大腸癌患者では同時性肝転移が20%,異時性肝転移が20%に認められるが,切除可能な症例は10–20%に過ぎない.ところで,肝切除術の適応基準は,1)耐術可能,2)原発巣が制御されているか制御可能,3)肝転移巣を残遺なく切除可能,4)肝外転移がないか制御可能,5)十分な残肝機能(正常肝で残肝容量30%以上,障害肝で残肝容量50%)の5項目である.これらの条件を満たすために外科医は様々な工夫をしている.たとえば,3)や5)のために切除術が実施できない場合は,conversion療法,門脈塞栓術,二期的肝切除術,術中・術後の焼灼療法などを組み合わせる.図5は,まず第一期手術として残肝側の腫瘍を切除し,ついで門脈塞栓術によって残肝容量を増大させ,最後に大肝を切除する二期的肝切除術の経過を示したものである 14 .また,病変が深部にあり,切除すると残肝容量が不足する場合は焼灼療法を併用している.

Conversionとは,切除不能な状態から切除可能な状態に転換することを意味している.大腸癌肝転移のconversionを最初に報告したのはフランスのAdamである 15 .彼らのシリーズでは,大腸癌肝転移1,439例のうち335例(23%)が切除可能,1,104例(77%)が切除不能であったが,切除不能例に化学療法を実施した結果,138例(全体の10%,切除不能例の13%)が切除可能となった 15 .Conversion症例の治療成績は初回切除可能症例と比較すると劣るが,それでも5年生存割合は33%,10年生存割合は23%であった 15 .
我々は,関連病院13施設で多施設共同第Ⅱ相試験「肝転移を有する治癒切除不能な結腸・直腸癌患者(初回治療患者)に対するベバシズマブまたはセツキシマブ併用mFOLFOX6療法の検討(BECK試験)(UMIN試験ID UMIN000004310)」を実施した 16 .本試験では,KRAS変異陰性であれば抗EGFR抗体薬セツキシマブを併用,KRAS変異陽性であれば抗VEGF抗体薬ベバシズマブを併用したmFOLFOX6療法を最大6コース実施し,切除可能であれば肝切除術を実施,切除不能であればFOLFIRIとベバシズマブまたはセツキシマブの併用療法を最大6サイクル実施し,切除可能であれば肝切除術を実施、切除不能であれば試験を終了するプロトコールであった 16 .試験には35例が登録され,23例(67.6%)が肝切除術を受けた.Conversion割合はKRAS変異陰性例が77.2%,陽性例が50.0%,R0手術割合はKRAS変異陰性例が50.0%,陽性例が41.7%であった(図6) 17 .つまり,Adamらの報告では13%に過ぎなかったconversionが,遺伝子変異の情報をもとにテーラーメード治療を行うことによって3分の2の症例で切除術可能にconversionしたことを示している.私はこれをPrecision Surgeryとよんでいる.私はこの仕事で肝胆膵外科学会の理事長賞を受賞した.

このような試験を実施する際に,患者のリクルートを一般腫瘍専門医が担当するか,肝臓外科医を含む集学的治療チームが担当するかによって肝切除術の実施割合が大きく異なることに注意が必要である.一般腫瘍専門医が患者をリクルートし肝切除術を決定したCRYSTAL試験とOPUS試験では,肝切除術の実施割合は13%と16%であったのに対し,肝臓外科医を含む集学的治療チームが患者をリクルートし肝切除術を決定したCELIM試験とPOCHER試験では,肝切除術の実施割合は33%と60%であった.我々のBECK試験では,3分の2の患者が肝切除術を受け,R0/R1手術を受けた患者の5年生存割合が71.1%であったことと,多変量解析でR0/R1手術が生存に影響する唯一の予後因子であったことを考慮すると 18 ,大腸癌肝転移のような集学的治療を必要とする疾患の治療にはチーム医療が必須であることがわかる.ただ,R0/R1手術例の6割は1年以内に再発し5年無再発生存割合は19.1%であることにも留意する必要がある.我々は再発すれば切除を繰り返し,最終的にcancer-freeの状態に至ればよいと考えている.BECK試験ではそのような患者が3分の1をしめた(図7) 18 .BECK試験の結果は大腸癌治療ガイドラインに引用されている 19 .
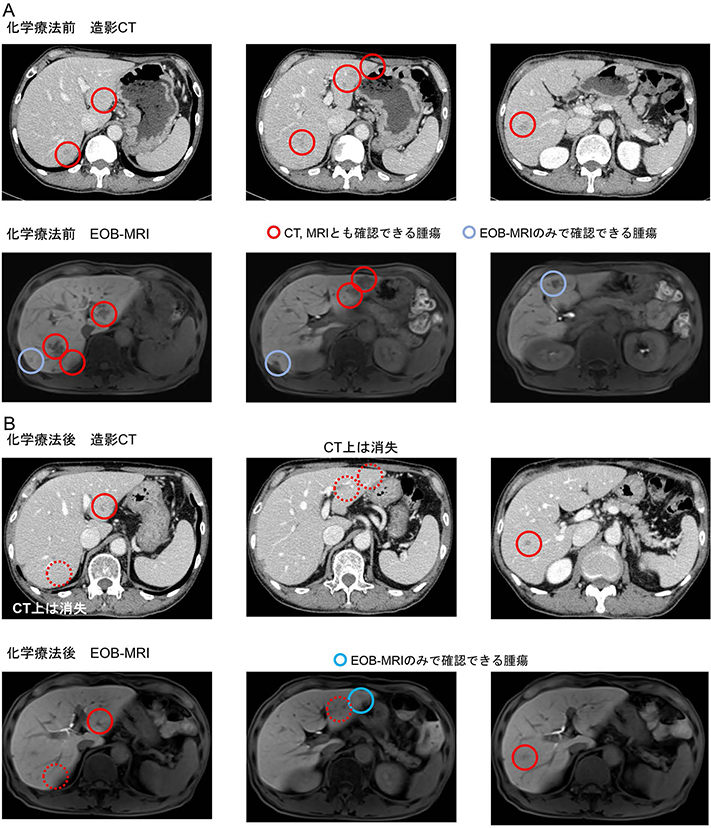
大腸癌肝転移の手術では腫瘍がどこにあるのかを正確に評価しておくこと,すなわちPrecision Oncosurgeryが重要である.図8Aは,BRAF変異陽性大腸癌肝転移の患者さんの化学療法前の造影CTとEOB-MRI画像をならべたものである.両者を比較するとCTでもMRIでも確認できるものと,CTでは確認できないかMRIでは確認できるものがあることがわかる.一方,化学療法後の画像(図8B)をみると,CTでもMTIでも消失しているものと,CTでは消失しているがMRIでは残存しているものがある.これらの情報をもとにシミュレーション画像を作成し,10または11か所の肝部分切除と2か所の焼灼治療を計画した(図9A).実際の手術では,術中に造影超音波検査を行ない,14か所を部分切除し術後に2か所を焼灼治療した.病理検査では,切除した14か所のうち腫瘍の遺残を認めたのは1か所だけであった(図9B).つまり,腫瘍の多くは切除した段階ですでに壊死していたのである.従って,術前の評価で消失した腫瘍は,術中の超音波検査でみつかっても切除しないことがある.この患者さんは予後不良の遺伝子変異を認めたが,術後1年9か月無病生存中である.
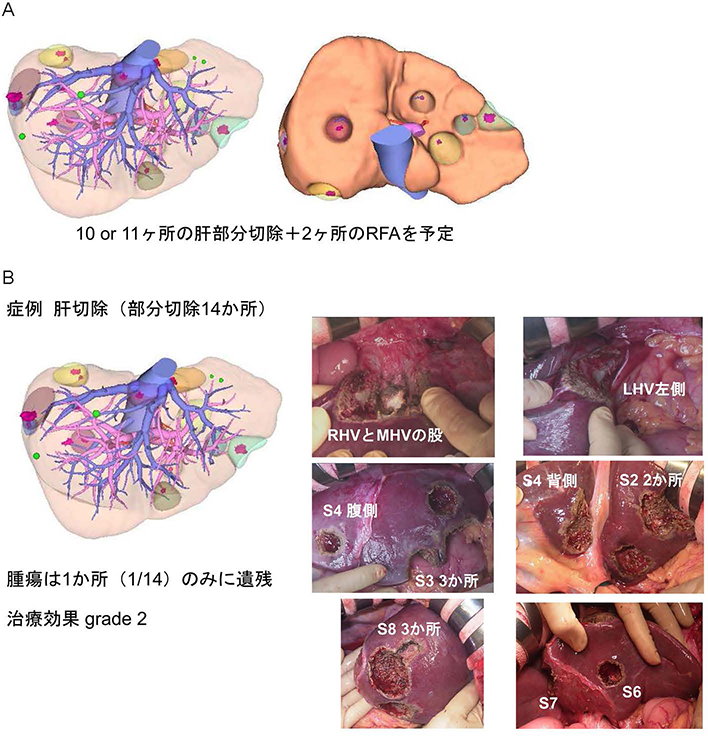
大腸癌肝転移は手術を含めた集学的治療で治癒が期待できる.緻密な画像診断には放射線科のサポートが必要であるし,適切な薬物療法の選択と有害事象のマネージメントは腫瘍内科が担当し,手術のタイミングはキャンサーボードが判断する.このようなチーム医療による集学的治療にはコミュニケーションが何よりも重要であり,大腸癌肝転移の患者の予後を左右することを知っておく必要がある.
消化器外科領域では,いずれの臓器でも,進行した癌患者を薬物療法によっていかに手術にもっていけるかがトピックになっている.我々はかねてより,切除不能の肝細胞癌患者に対して抗腫瘍剤の肝動脈内投与を実施してきた.猪飼伊和夫先生が研究責任者となって2004年から開始した「手術不能肝細胞癌患者に対する肝動脈注入化学療法(低用量シスプラチン+5-FU対インターフェロン+5-FU)に関する比較臨床試験(UMIN-CTR: C000000012)」は,下大静脈腫瘍栓 (Vv3) もしくは門脈腫瘍栓(Vp3,Vp4)を伴う手術不能肝癌患者に対して二つの肝動脈注入療法のいずれかを実施し,それぞれの治療成功期間および全生存期間に対する有効性と安全性を明らかにすることを目的として実施された 20 .この試験では29例が登録され,5例(17%)で肝切除術を実施し,生存期間は27–110か月であった(表1).
|
Case |
The reason for inoperable |
HAI chemotherapy |
Survival time (months) |
Recurrence |
|---|---|---|---|---|
|
1 |
Multiple lung metastasis |
FP |
27 |
Lung |
|
2 |
Shortage of the remnant liver volume |
FP |
67 |
No |
|
3 |
Shortage of the remnant liver volume |
FP |
88 |
Liver, lung |
|
4 |
Multiple lung metastasis |
IFN/5FU |
91 |
No |
|
5 |
Shortage of the remnant liver volume |
IFN/5FU |
110 |
No |
切除率:5/29例(17%)
HAI, hepatic artery infusion; HCC, hepatocellular carcinoma; FP, fluorouracil + platinum; IFN, interferon
2009年のソラフェニブを皮切りに肝細胞癌に対する薬物療法が次々に開発され,現在ではレゴラフェニブ(2017年),レンバチニブ(2018年),ラムシルマブ(2019年),アテゾリズマブ+ベバシズマブ(2020年),カボザンチニブ(2020年)を加えた6種類のレジメンが使用可能になっている.「切除不能肝細胞癌に対するレンバチニブ使用による外科的切除可能性を検討する多施設共同前向き臨床研究:LENS-HCC(臨床研究実施計画番号 jRCTs031190057)」は,切除不能肝細胞癌を有する患者にレンバチニブを8週間投与し,投与終了後に可能な限り外科的切除を実施するもので,主要評価項目は外科的切除率,副次評価項目は肉眼的治癒切除率や全生存期間などである 21 .本試験には私の前任地である兵庫医科大学の登録数が最も多かったので,当時の同僚の多田正晴先生が米国臨床腫瘍学会消化器癌シンポジウムで結果を発表した 22 .48例中R0切除27例(56%),R1切除2例(4%),R2切除4例(8%)で 22 ,切除症例の全生存は非切除症例と比較して有意に良好であった.
本庶佑先生の研究による免疫チェックポイント阻害剤は癌治療を一変させた.本庶先生がこの研究によってノーベル賞を受賞されたことはご承知の通りである.私が研究主催者として進行中の特定臨床研究「切除不能肝細胞癌におけるアテゾリズマブ+ベバシズマブ併用療法,外科的切除を用いた集学的治療の安全性,有効性を検討する多施設共同第II相臨床研究(RACB試験)(認定番号:CRB5180002)」は,切除不能肝細胞癌に対する抗PD-L1抗体アテゾリズマブと上述の抗VEGF抗体薬ベバシズマブの併用療法と外科的切除を用いた集学的治療の有効性を検討することを目的としている 23 .本試験では,無増悪生存期間を主要評価項目とし,切除不能をどの程度切除可能にconversionできるかの外科的切除率は副次的評価項目としている.
私は一人でも多くの患者さんにchemo-free,cancer-freeの状態になってもらいたいと思っている.薬物療法を続けていてもいずれ抵抗性となり,有害事象に悩まされることも多い.患者さんからは「いつまでこの治療を続けるんですか?」とよく問われる.外科手術をそのような状況で実施することができれば薬物療法から解放されるかもしれない.外科医の本分としては「切って治したい」のであるが,「切っただけでは治らない」ことが多いので,いずれかのタイミングで外科手術を実施し,その結果最終的に治ればいいのではないかと思っている.そのゴールに到達するには腫瘍内科や放射線科の医師とのコミュニケーションが重要であるし,今後はsurvival benefitやQOLも考慮した手術を考える必要があるだろう.
胆道癌診療ガイドラインでは,切除不能胆道癌に対してゲムシタビン+シスプラチン併用療法(GC),ゲムシタビン+S-1併用療法(GS),ゲムシタビン+シスプラチン+S-1併用療法(GCS)の3種類の化学療法レジメンが推奨されている 24 .グローバルスタンダードはGC療法であるが,FUGA-BT(JCOG1113)試験でGC療法に対するGS療法の非劣性が 25 ,Kansai Hepatobiliary Oncology Groupが実施したMITSUBA(KHBO1401)試験でGC療法に対するGCS療法の優越性が証明されたことから 26 ,現在ではGCS療法がファーストラインになっている.一方,根治切除後胆道癌に対するアジュバント療法としてS-1を投与すると,全生存も無再発生存も向上することがつい最近報告された 27 .
胆道癌はR0切除割合が低く,非切除,M1,R2切除,R1切除を合計すると22%に達する(表2) 28 .さらに,術後の化学療法の完遂割合が膵癌より低い.このような背景から,JCOG肝胆膵グループでは「JCOG1920:切除可能胆道癌に対する術前補助化学療法としてのゲムシタビン+シスプラチン+S-1(GCS)療法の第III相試験」を実施している 29 .本試験では,切除可能胆道癌患者に対して,術前補助化学療法としてGCS療法を3サイクル実施する試験治療群と,手術+術後補助化学療法の標準治療群に無作為に振り分けて治療成績を比較する.結果が判明するまでには時間が必要であるが,胆管癌治療でも術前補助化学療法がトレンドになっている.
|
疾患名 |
Total (人) |
非切除 |
M1 |
R2切除 |
R1切除 (浸潤癌) |
R1切除 (上皮内癌) |
非切除 or M1 or R2 or R1切除 |
|---|---|---|---|---|---|---|---|
|
肝門部領域胆管癌 |
298 |
17 (6%) |
26 (9%) |
7 (2%) |
54 (18%) |
31 (10%) |
120 (40%) |
|
遠位胆管癌 |
355 |
8 (2%) |
16 (5%) |
1 (0.3%) |
25 (7%) |
29 (8%) |
69 (19%) |
|
胆嚢癌 |
190 |
8 (4%) |
14 (7%) |
2 (1%) |
21 (11%) |
2 (1%) |
42 (22%) |
|
乳頭部癌 |
201 |
0 |
0 |
1 (0.5%) |
1 (0.5%) |
2 (1%) |
4 (2%) |
|
肝内胆管癌 |
128 |
8 (6%) |
10 (8%) |
1 (1%) |
16 (13%) |
2 (2%) |
29 (23%) |
|
疾患名不一致 (術前診断胆道癌) |
40 |
2 (5%) |
4 (10%) |
0 |
1 (3%) |
0 |
5 (13%) |
|
Total |
1,212 |
43 (4%) |
70 (6%) |
12 (1%) |
118 (10%) |
66 (6%) |
269 (22%) |
文献28から引用
京都大学における肝移植は2022年8月現在2,050例に達している.開始当初は小児の移植が大半であったこともあって生体肝移植が圧倒的に多いのに対して,脳死肝移植の実施件数は非常に少ない.やや古いデータであるが2012年の各国の肝移植件数をみると,米国では脳死肝移植が96%,韓国でも28%であるのに対して,わが国では生体肝移植が90%,脳死肝移植が10%である.我が国の人口100万人当たりの脳死ドナー数は各国のなかで最も少ない.2009年に改正臓器移植法が施行されて以降,脳死移植件数も増えてはいるが,生体ドナーのリスクを考慮すれば脳死移植の推進が重要である.一方,生体肝移植の成績をみると,すでに10年,20年,30年生存を算出できるようになっている(図10).10年生存割合は18歳未満が82%,18歳以上は66%で,全体でみると8割であるが,2013年から2021年の症例でみると,血液型一致・適合例は91%,血液型不適合でも89%に達している.すなわち肝移植は確立された治療であるということができる.
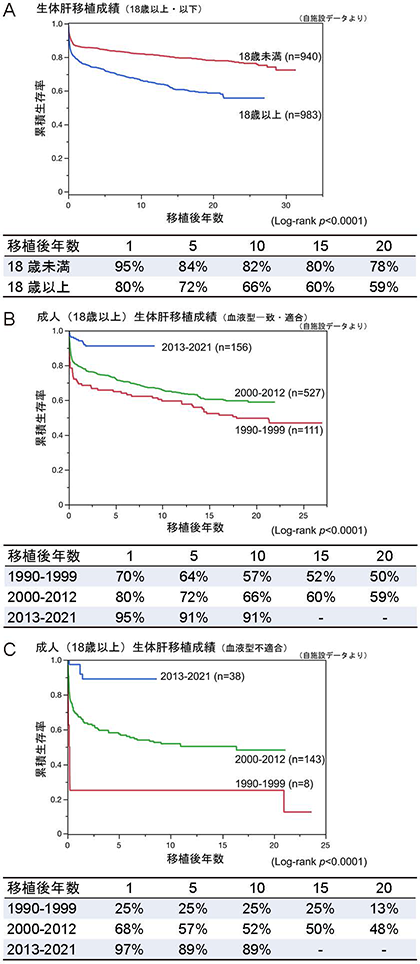
(A)18歳未満と18歳以上の生存曲線.(B)年代別成人生体肝移植(血液型一致・適合)の生存曲線.(C)年代別成人生体肝移植(血液型不一致)の生存曲線
我々は,非代償性肝硬変や代謝性肝疾患に対する外科治療として確立してきた肝移植を用いた癌治療,すなわちTransplant Oncologyを推進している.例として切除不能肝門部胆管癌に対する生体部分移植術(UMIN試験ID UMIN000033348)を取り上げよう 30 .ここでいう「切除不能」とは肝全体に広がっている癌や残肝の機能が不足している癌をさす.患者さんは原発性硬化性胆管癌を背景に広範な胆管癌を発症した40代の女性であった.胆管癌は切除可能であれば根治を目指すことができるが,病変部位によって術式が異なる.すなわち,下部胆管であれば膵頭十二指腸切除,上部胆管であれば肝切除を行うが,本症例では肝全摘と膵頭十二指腸切除を同時に実施し,次いで夫をドナーとした生体肝移植を実施した.手術に先立って化学療法を3か月,放射線照射を1か月実施し,転移がないことを確認するための手術も実施した.血管は放射線照射野外から採取したものをインターポジションした.図11はこれらの術式を示したものである.この患者さんは術後122日に自宅退院し,現在では職場復帰している.我が国では,胆管癌に対する治療として肝移植はまだまだ承認されていないので,先進医療としてこの治療をすすめている.
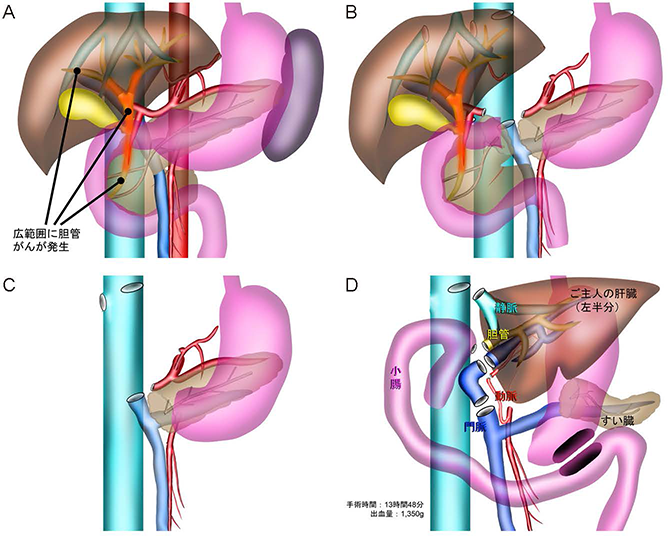
(A)広範囲に胆管癌が発生.(B,C)肝全摘+膵頭十二指腸切除.(D)生体部分肝移植,門脈再建,胆管・小腸吻合,胃小腸吻合.
最後に肝臓手術を支援する最新技術を紹介しよう.我々はパナソニックと手術用顕微鏡を制作している三鷹光器と3者共同で,プロジェクションマッピング技術を用いた新しい手術支援システムMIPS(Medical Imaging Projection System)を開発した.かねてより,インドシアニングリーン(ICG)を投与後に近赤外線を照射することによって血流を可視化する蛍光ガイド手術が行われてきたが,1)近赤外蛍光画像を外部モニター上で確認するため,術野とモニター間での視線移動が必要,2)無影灯を消灯する必要があるので術野が暗い,3)画像がぶれるなどの問題があった.今回開発したMIPSは,プロジェクションマッピング技術を用いて,近赤外蛍光観察で得た血流などの情報を臓器表面に直接投影するシステムである.その結果,術者が術野に集中することができるようになった.また,蛍光観察カメラとマッピング用プロジェクターを同軸光路上に配置することで,実際の患部の情報と投影画像のずれを±2 mm以下にし,投影遅延時間を0.2秒以内に抑え,臓器の移動や変形へのリアルタイムな追従を可能にした.さらに,プロジェクター光を直接投影するため,術野の暗さも解消されるほか,肋骨などの遮蔽物に邪魔されずマッピングを行えるよう,術者が自在に角度を変えられるアームを開発した.このシステムは,2019年にクラスⅡの医療機器として製造販売承認を取得し,「ものづくり大賞日本 経済産業大臣賞受賞」を受賞した.
動画(電子付録1, 2; https://doi.org/10.12936/tenrikiy.26-003)はMIPSを用いた手術の映像である.切除する後区域の脈管を遮断してICGを流すと,残す肝臓は着色するが,切除する肝臓はICGが流れないので着色しない.実際には肝表面にも肝実質内にもメルクマークはないのであるが,着色領域と非着色領域の境界で切除していくと正確な手術を行うことができる.MIPSのICG蛍光ガイド下手術は、開腹手術だけでなく,腹腔鏡手術にも応用できる(電子付録3, 4; https://doi.org/10.12936/tenrikiy.26-003).このような高度な先進技術を利用することによって手術の安全性を向上し,手術適応を拡大していけば,手術の症例数が増え,若い外科医にも執刀の機会が増えるであろう.
私は京都大学肝胆膵・移植外科を担当するにあたって,1)大きな組織を支えるのはコミュニケーションとリーダーシップ,2)多様性を許容する懐,3)限界にチャレンジする伝統(自分で限界を作らない)の三つを肝に銘じている.オスラーの「望ましい教師とは自分の専門分野の世界的に優れた研究に精通しているのはもちろんのこと、自らの理念を持ち、それを実行に移す覇気と活力の持ち主でなければならない」を胸に,今後も教室を引っ張っていきたいと思っている.
1989年 3月 京都大学医学部卒
1989年 7月 京都大学医学部附属病院(研修医)勤務
1989年 9月 高山赤十字病院研修医
1989年12月 京都大学医学部附属病院研修医
1997年 4月 京都大学医学研究科リサーチアソシエイト
1998年 4月 米国ノースカロライナ大学リサーチアソシエイト
(1998年7月から1999年10月まで日本学術振興会特別研究員)
2000年12月 京都大学医学研究科消化器外科医員
2002年 4月 京都大学医学研究科消化器外科助手
2006年 4月 京都大学大学院外科(肝胆膵移植外科)助手
2007年 4月 京都大学大学院外科(肝胆膵移植外科)助教
2010年 4月 京都大学大学院外科(肝胆膵移植外科)講師
2012年 4月 Visiting Professor, Department of Digestive Surgery & Transplantation, University Hospital of Hautepierre, Strasbourg, France
2014年 5月 京都大学大学院外科(肝胆膵移植外科)准教授
2016年 4月 兵庫医科大学外科学講座・肝胆膵外科 教授
2019年12月 兵庫医科大学消化器外科学講座・肝胆膵外科 主任教授
これは,令和4年(2022年)11月18日天理よろづ相談所学術講演会(座長:天理よろづ相談所病院消化器外科 待本貴文部長)で,主として非専門家を対象に行われた波多野教授の講演を当研究所で編集したものである.