2015 年 101 巻 12 号 p. 627-635
2015 年 101 巻 12 号 p. 627-635
To clarify the effects of blowing a H2-N2 mixture onto the surface of molten steel containing various oxygen contents on the absorption reaction of nitrogen in the molten steel, experimental studies were carried out using a 20 kg induction furnace. Blowing of the H2-N2 mixture accelerates the nitrogen absorption rate because the oxygen concentration at the gas-metal interface is decreased by the reducing effect of the hydrogen gas. The apparent chemical reaction rate of nitrogen absorption in the present work was evaluated at almost the same reaction rate as that of desorption of nitrogen in previous works. Furthermore, a mathematical model for the nitrogen absorption and desorption reactions in a RH degasser was developed in order to estimate the contribution of each nitrogen reaction site during decarburization and killing treatment with injection of pure N2 gas or the H2-N2 mixture in the molten steel. Using the mathematical model, it was estimated that a larger increase in the nitrogen concentration during decarburization treatment could be achieved by applying a 30% H2-N2 mixture to the injection gas in the RH degasser than by applying pure N2 gas.
近年,固溶窒素のひずみ時効硬化を積極的に利用した高成形性ハイテン素材のように極低炭素鋼で150 ppm以上の高窒素濃度が要求される鋼や,缶用鋼などのように高窒素濃度で窒素濃度範囲が10 ppm以内に制御する要求が強まり,RH真空脱ガス処理において高窒素濃度への制御技術が重要になってきている。
RH真空脱ガス法において,浸漬管より窒素ガスを吹き込み極低炭素−高窒素鋼を溶製する場合の脱窒,吸窒反応サイトとしては,①真空槽内浴面での脱窒,②吹き込んだ窒素気泡からの吸窒,③脱炭最盛期におけるCO気泡への脱窒,さらに,④浸漬管からのエアリークが考えられ,溶鋼中の窒素濃度は溶鋼成分や操業条件により複雑に変化する。さらに,脱炭処理時やセミキルド処理時においては,界面活性元素である酸素の影響により加窒速度が小さくなり,RH真空脱ガス処理での高窒素化は難しい状況といえる。
溶鋼からの脱窒・吸窒反応に関しては,これまでに多くの基礎的研究があり,脱窒・吸窒速度に及ぼす界面活性元素である酸素,硫黄濃度の影響1,2,3,4,5,6,7,8,9,10,11),圧力の影響9,12),マランゴニ対流による溶鋼側物資移動への影響13),脱窒速度に及ぼすArガスの吹き込みの影響14,15),還元性ガスの吹き込みの影響16,17),鉄鋼石粉末の上吹きの影響18),CaO含有フラックスの上吹きの影響19),炭化鉄の吹き込みの影響20)などについて明らかにされているが,高酸素溶鋼中への窒素と還元性ガスの混合吹きによる吸窒速度への影響は不明である。
本研究では,窒素に水素を混合したガスを溶鋼に上吹きすることにより,高酸素濃度の溶鋼においても気液界面の酸素濃度を低下し,加窒速度を向上させることができないか実験を試みた。また,窒素と水素の混合ガスをRH真空脱ガス法の還流ガスとして適用した場合の加窒挙動について,RH真空脱ガス法の窒素反応サイトを考慮した脱・吸窒反応モデルを用いて予測したので報告する。
窒素−水素混合ガス中の水素濃度と溶鋼中の酸素濃度が,吸窒速度に及ぼす影響を調べるため,20 kg高周波誘導溶解炉を用いて実験を行った。Fig.1に実験装置の模式図を,Table 1に実験条件を示す。実験には内径150 mmφのマグネシア製のルツボを用いて,20 kgの高純度鉄をArガス雰囲気下で溶解後,炭素,Mn,P,S濃度を調整した。酸化鉄の添加,および,炭素濃度により初期溶鋼酸素濃度を約400 ppm,100 ppm,50 ppm,5 ppmに調整した。なお,5 ppmの低酸素条件についてはAlを用いて溶鋼を脱酸して調整した。また,窒素ガスの上吹き前の溶鋼中窒素濃度は,窒化マンガンを添加することにより30~60 ppmに調整した。その後,溶鋼表面に内径2 mmφのノズルから1.0×10−5 m3/minの純窒素,10 mass%水素−窒素混合ガス,および,30 mass%水素−窒素混合ガスを上吹きし,石英サンプラーを用いて溶鋼を採取し,溶鋼中の窒素濃度を分析した。また,酸素プローブにより酸素濃度変化を測定した。なお,溶鋼温度は約1893±20 Kに調整した。
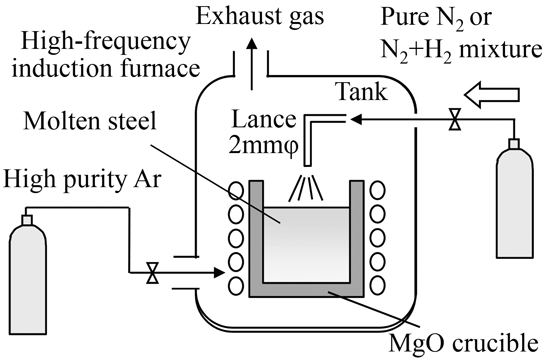
Schematic view of experimental apparatus.
| [C] | 0.02 ~ 0.20 mass% |
|---|---|
| [Mn] | 0.15 mass% |
| [P] | 0.005 mass% |
| [S] | 0.003 mass% |
| Initial [O] | 400 ppm, 100 ppm, 50 ppm, 5 ppm |
| Initial [N] | 30 ~ 60 ppm |
| Temperature | 1893 ± 20 K |
| Gas composition | Pure N2, 10%H2-N2, 30%H2-N2 |
| Gas flow rate | 1.0×10–5 m3/min. |
| Pressure | 770 torr |
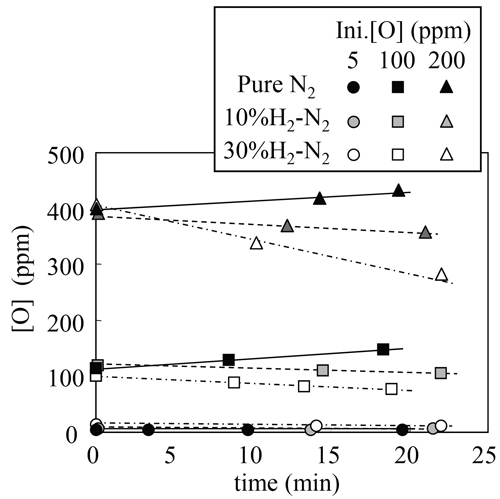
純窒素,10 mass%水素−窒素混合ガス,30 mass%水素−窒素混合ガスを上吹きした際の溶鋼中の窒素濃度の時間変化をFig.2に示す。純窒素ガスを上吹きした場合,溶鋼中酸素濃度が高いほど吸窒速度が低下する。一方,窒素−水素混合ガスを上吹きした場合,高酸素濃度域での吸窒速度が純窒素ガスを上吹きした場合に比べ大きくなり,その傾向は混合ガス中の水素濃度が高いほど大きくなる。

Behavior of nitrogen content in molten steel during blowing with N2-H2 mixture.
純窒素,10 mass%水素−窒素混合ガス,30 mass%水素−窒素混合ガスを上吹きした際の溶鋼中の酸素濃度の時間変化をFig.3に示す。純窒素を上吹きした場合,溶鋼中酸素濃度はほぼ一定であるのに対し,窒素−水素混合ガスを上吹きした場合,(1)式の反応により,溶鋼中酸素は時間とともに低下し,上吹き混合ガス中の水素濃度が高いほど脱酸速度が大きくなる。
| (1) |
Behavior of oxygen content of molten steel during blowing with N2-H2 mixture.
しかし,溶鋼中の酸素濃度の低下は30 mass%水素−窒素混合ガスでも著しく減少するものではなかった。
Table 2に示すように,溶鋼からの脱窒・吸窒反応に関しては,これまでに多くの基礎的研究が行われてきており,化学反応速度に及ぼす界面活性元素である酸素,硫黄濃度の影響1,2,3,4,5,6,7,8,9,10,11),脱窒速度に及ぼす還元性ガスによる界面酸素濃度の低下の影響16,17),および,マランゴニ対流による溶鋼側物資移動への影響13)などについて明らかにされてきている。本実験結果を用い,窒素−水素混合ガスと溶鋼間の吸窒反応について速度論的検討を行った。また,窒素−水素混合ガスを溶鋼に吹き込むことにより,高酸素濃度域においても加窒速度を向上させることができないか検討を行った。
| Rate - determing step | Studies | |
|---|---|---|
| Nitrogen desorption | Chemical reaction | Effect of the surface active elements (O, S)
Removal of surface active oxygen by reductive gas |
| Liquid-phase mass transfer | Effect of marangoni convection by reductive gas | |
| Nitrogen absorption | Mixed rate-determing
Liquid-phase mass transfer Chemical reaction |
Effects of oxygen and sulfur content on changing of rate-determing step |
| Chemical reaction
High oxygen concentration steel |
Removal of surface active oxygen by hydrogen gas ⇒ N2 + H2 mixture injection |
Fig.4に,窒素−水素混合ガスを吹き込んだ際のガス−メタル界面における窒素,酸素の濃度分布の模式図を示す。高酸素濃度域においては,表面活性元素である酸素により界面化学反応速度が低下することが知られているが,本実験では窒素ガスに水素を混合することにより,界面酸素を水素で脱酸し低下させる効果を期待している。

Profile of oxygen and nitrogen contents near interface between H2-N2 mixture and molten steel.
脱窒,吸窒反応速度に関して,メタル側の物質移動が律速される場合には (2)式のような1次式で,また,ガス−メタル界面での化学反応が律速される場合には(3)式のような2次式で表すことができる。
| (2) |
| (3) |
ここで,[N]は溶鋼中窒素濃度(%),[N]eは平衡窒素濃度(%),kNmは物質移動係数(m/min),kNrは反応速度定数(m/(%・min))である。また,Vは溶鋼体積(m3),Aは溶解/ガス間の反応界面積(m2)であり,ここではルツボの断面積(0.017 m2)を用いた。
吸窒反応において,上記いずれかの律速,もしくは両者の混合律速3,4)で整理すべきであるが,本実験条件では,高周波溶解炉を用いており,メタル側の物質移動は大きく,また,高酸素濃度域における実験が主体であることから,主に化学反応が律速されると考え,(3)式を積分した(4)式で整理を行なった。
| (4) |
ここで,tは時間(min)である。
なお,[N]eは(5)式で表せるが21),純窒素を上吹きした場合の窒素分圧,PN2(atm)については,本実験がAr雰囲気下での実験であり,上吹き時にArを巻き込むと考えられるため,酸素濃度が5 ppmの純窒素吹き実験の窒素濃度変化を回帰して求めた到達窒素濃度の値を[N]eとして用い,(5)式より窒素分圧をPN2=0.26として求めた。
| (5) |
ここで,Tは溶鋼温度(K),fNは窒素の活量係数である。
また,水素−窒素混合ガス吹き実験では,(6)式のように混合ガス中の窒素濃度,β(%)を純窒素吹き実験での窒素分圧(=0.26)にかけた値を窒素分圧として用いた。
| (6) |
Fig.5に各実験結果を2次の反応式である(4)式で整理した結果を示す。初期酸素濃度が400 ppm,100 ppm,50 ppmの実験では比較的良い直線関係が得られており,化学反応速度が主に律速しているものと考えられる。一方,初期酸素濃度が5 ppmの実験では2次の反応式では直線関係が得られず,むしろ,1次反応式で整理した方が良い直線関係が得られた。低酸素濃度域においては,液相側の物質移動速度が律速しているものと考えられる。

Influence of blowing with N2-H2 mixture and oxygen concentration on rate of nitrogen absorption.
直線の傾きより求めた見掛けの反応速度定数は,純窒素ガス吹きの場合,溶鋼中酸素濃度の増加により低下する。また,高酸素濃度において窒素−水素素混合ガスを吹き付けることにより,純窒素ガス吹きに比べ見掛けの反応速度定数は大きくなる。特に,100 ppm以上の高酸素濃度域でその効果が大きいことがわかる。脱窒反応速度に及ぼす還元ガスの影響については,Mizukamiら16),Kawakamiら17)により界面活性元素である酸素濃度の低下により,脱窒速度の向上が指摘されているが,本研究の窒素−水素混合ガスによる吸窒実験においても,高酸素濃度域において還元ガスによる吸窒速度の向上が認められる。
酸素濃度の低いAlキルドの水準については,30 mass%水素−窒素混合ガスを上吹きした場合,純窒素ガスを上吹きした場合に比べ脱窒速度が向上しており,マランゴニ効果による物質移動係数の増大の可能性も考えられる。
Fig.6に,純窒素を上吹きした実験における,見掛けの化学反応速度定数と上吹き時の平均溶鋼酸素濃度の関係を示す。これまでに報告された化学反応速度定数,kr(cm/(s・%))と酸素濃度の関係を(7),(8),(9)式に示す。
| (7)5) |
| (8)3) |
| (9)1) |
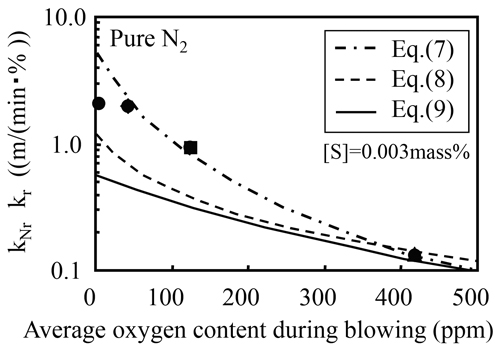
Comparison of apparent reaction rate constant, kNr in present work with chemical reaction rate constant, kr in previous works.
100 ppm以上の高酸素濃度域においては,今回得られた結果と(7)式のHarashima5)らが求めた結果がほぼ一致している。一方,酸素濃度が50 ppm以下では(7)式の関係に比べ見掛けの反応速度定数は小さく,一定値に近づく傾向が見られる。高酸素濃度域では化学反応速度が主要因であり,100 ppm以下の低酸素濃度域では酸素濃度が低下するにしたがい,液側物質移動抵抗が相対的に大きくなるものと考えられる。
次に,水素−窒素混合ガスを上吹きした場合の見掛けの反応速度定数と上吹き時の平均酸素濃度の関係をFig.7に示す。水素混合ガスを上吹きすることにより高酸素濃度域で見掛けの反応速度定数は(7)式の関係よりも大きく増加し,水素濃度が高いほど増加量が大きいことがわかる。これは,溶鋼中の酸素濃度の低下よりさらにガス−メタル界面の酸素濃度が低下した結果,見掛けの反応速度定数が増加したものと考えられる。一方,低酸素濃度域においては界面酸素による反応速度への影響が小さく,かつ,液相側の物質移動抵抗が相対的に大きくなるため,水素混合ガスの効果は小さくなると考えられる。
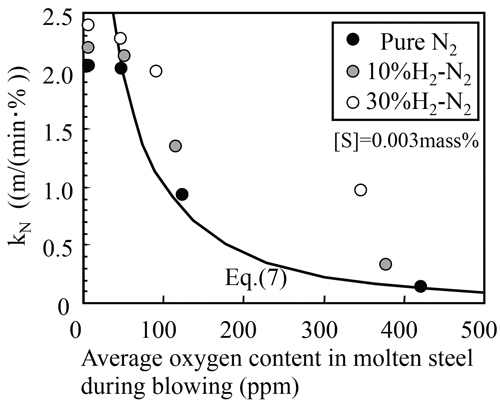
Effects of hydrogen and nitrogen gas mixture on apparent reaction rate constant.
水素混合ガスの上吹きにより溶鋼界面の酸素濃度が純窒素ガスに比べてどの程度低下するか,見掛けの反応速度定数から(7)式を用いて推定した。Fig.8に溶鋼中酸素濃度,[O]M(ppm)と界面酸素濃度,[O]I(ppm)の関係を示す。溶鋼中酸素濃度が100 ppm以上の高酸素濃度域においては,10 mass%水素−窒素混合ガスを上吹きした場合,界面酸素濃度は溶鋼酸素濃度の60~70%に,30 mass%水素−窒素混合ガスの場合は30~50%に低下すると見積もられる。
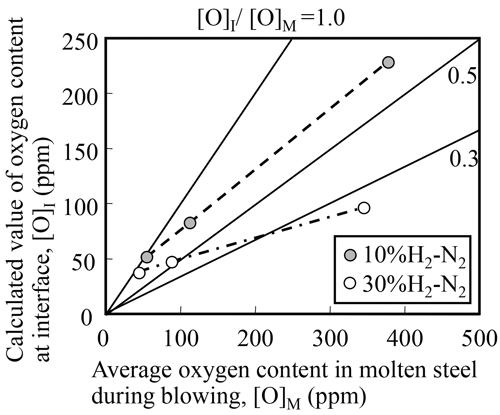
Relationship between oxygen content in molten steel and calculated value of oxygen content at interface between bubble of H2-N2 gas and molten steel.
以上より,窒素に水素を混合したガスを溶鋼に吹き込むことにより高酸素濃度域においても吸窒速度を向上できることがわかる。
4・2 RH真空脱ガス法の吸脱窒モデルによる窒素−水素ガス吹きの窒素濃度への影響の推定ラボ実験で得られた吸窒速度定数をもとに,水素−窒素混合ガスをRH真空脱ガス法の環流ガスとして吹き込んだ場合の吸・脱窒挙動を,純窒素ガス吹き込みの場合と比較した。吸・脱窒挙動を評価するために使用したRH真空脱ガス法の窒素反応モデルの概念図をFig.9に示す。モデルの前提として,リムド脱炭処理時(環流ガス:窒素),キルド処理時(環流ガス:窒素)の各ケースを考え,脱窒・吸窒の反応サイトとして,①真空槽内の鋼浴表面,②溶鋼環流用の吹き込み窒素ガスの気泡界面,③脱炭反応時のCO気泡界面,④浸漬管からのエアリークによる吸窒を考慮した。
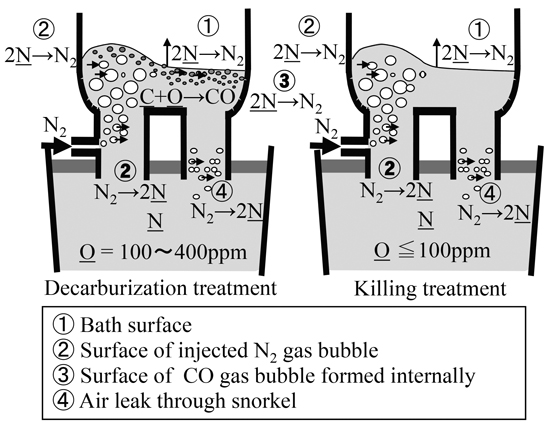
Nitrogen reaction sites during decarburization and killing treatment with nitrogen injection in RH degasser.
取鍋,真空槽内ともに溶鋼は完全混合と仮定し,各反応サイトの脱・吸窒速度を考慮すれば,真空槽内溶鋼,取鍋内溶鋼の窒素の変化速度はそれぞれ(10),(11)式で表される。
| (10) |
| (11) |
ここで,[N]V:真空槽内窒素濃度(%),[N]L:取鍋内窒素濃度(%),VV:真空槽内溶鋼量(m3),VL:取鍋内溶鋼量(m3),t:時間(min),d[N]leak/dt:浸漬管からの大気巻込みによる吸窒速度(%/min)である。なお,溶鋼環流量,Q(m3/min)はKuwabaraら22)が導出した(12)式を用いる。
| (12) |
ここで,Qg:環流用の吹き込みガス流量(Nm3/min),D:浸漬管径(m),P0:環流用ガスの吹き込み位置の圧力(atm),PV:真空槽内圧力(atm)である。
(10)式において,右辺第2項は鋼浴表面における反応速度,右辺第3項は溶鋼環流用の窒素ガス気泡界面における反応速度,右辺第4項は内部脱炭により発生したCO気泡界面における反応速度を表す。以降,各反応サイトにおける反応速度式について示す。
4・2・2 RH真空槽内の浴表面,COガス気泡界面での反応速度式RH真空槽内の反応サイトのうち,①真空槽内浴表面,③COガス気泡界面における反応速度は,メタル側物質移動と界面化学反応の混合律速と仮定する(真空度が十分でない場合,真空槽内浴表面におけるガス側の抵抗は無視できない場合もあるが,このモデルでは無視して解析)。各サイトの反応速度式を(13),(14)式に示す。
| (13) |
| (14) |
ここで,An:反応界面積(m2),km:窒素のメタル側物質移動係数(m/min),kr:窒素の化学反応速度定数(m/(min・%)),[N]i,n:メタル側界面の窒素濃度(%),[N]e,n:気相と平衡する窒素濃度(%)である。また,下添字nは反応サイトを示し,Sは真空槽内浴表面,COはCOガス気泡界面である。
COガス気泡と平衡する窒素濃度,[N]e,COはCO気泡内の初期の窒素分圧は0であると仮定し,[N]e,CO=0とする。また,真空槽内浴表面における平衡窒素濃度,[N]e,Sは真空度の影響を受けるとし,浴表面の窒素分圧が槽内真空度,PV(atm)であると仮定して,(15)式に示す平衡式により求める。
| (15) |
また,km(m/min)はMukawaら9)が高周波誘導溶解炉における実験にて0.054 m/minを得ているが,RH真空脱ガス法の真空槽内におけるkmは不明であるため,ここではパラメータとする。また,kr(m/(min・%))は,上述したHarashimaら5)により求められた界面活性元素であるO,Sの影響を考慮した(7)式を用いた。
4・2・3 吹き込み窒素ガスの気泡−溶鋼界面での反応速度式浸漬管より吹き込んだ窒素ガスの吸窒・脱窒の概念図をFig.10に示す。鋼中窒素濃度が窒素気泡内圧と平衡する窒素濃度よりも低ければ窒素気泡からの吸窒が,窒素気泡内圧と平衡する窒素濃度よりも高ければ窒素気泡への脱窒が生じる。よって,上昇管の窒素ガス吹込位置付近では,窒素気泡からの吸窒が生じるが,浴表面付近では窒素気泡の内圧が低いため脱窒が起こる。
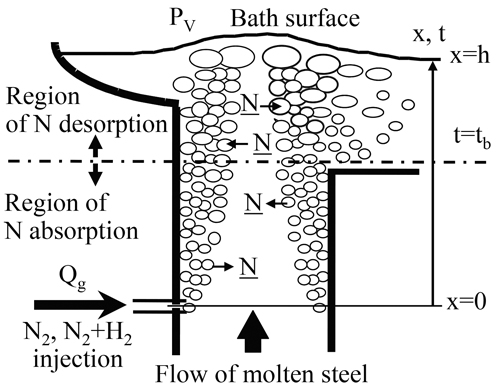
Mathematical model for nitrogen desorption and absorption reactions by injected N2 bubbles in snorkel.
この窒素気泡−溶鋼間の反応を定式化するために,a)上昇管内気泡位置と平衡窒素濃度の関係,b)上昇管内に吹き込まれた窒素ガスの気泡挙動についてモデル化し,窒素気泡界面における反応速度式を導いた。他のサイトと同様,(13)式に示すメタル側境膜の物質移動と界面化学反応の混合律速を仮定した。a),b)の仮定より,吹込窒素ガス気泡−溶鋼間の総括窒素反応速度は,ガスの吹込位置をx=0(m),鋼浴表面をx=h(m)とおくと,(16)式のように表される。
| (16) |
ここで,[N]e,N2(x)は窒素ガス吹き込み位置からの距離,xにおける窒素気泡−溶鋼間の平衡窒素濃度(%)であり,窒素吹き込み位置の圧力が大気圧であると仮定すると,(17),(18)式より求められる。
| (17) |
| (18) |
ここで,Pb,N2(x):xにおける窒素気泡内圧力(atm),ρFe:溶鋼の密度(=7000 kg/m3),g:重力加速度(=9.8 m/s2),h:浴表面から窒素ガス吹き込み位置までの距離(m)である(PV=1 atm時にh=1.47 m)。
また,AN2(x)(m2)はxにおける吹き込み窒素気泡と溶鋼の反応界面積であり,幾何学的に上昇管内の溶鋼中に滞留する全気泡体積の2/3乗に比例し,また,x方向に一定であると仮定すると(19)式のように表せる。
| (19) |
ここで,Qg:吹き込み窒素ガス流量(Nm3/min),tb:窒素気泡の鋼浴面までの滞留時間(min),α:吹き込み気泡の形状パラメータである。
tbについては,上昇管内に吹き込まれた窒素ガス気泡は合体しないと仮定し,(20)式で表される気泡の上昇速度,vb(m/s)から求めた。ここでv1(m/s)は溶鋼の上昇速度であり,(21)式で表せる。
| (20) |
| (21) |
また,Ozawaら23)は,オリフィスから溶鋼内に吹き込まれた時点の気泡径,db(m)はオリフィス内径の5~10倍としており,ここではオリフィス内径の10倍(db=0.06 m)と仮定した。
4・2・4 浸漬管の下降管からのエアリークによる吸窒速度Katoら24)は,RH真空脱ガス法(浸漬管内径=0.6 m,溶鋼量=280 t)において,浸漬管からのエアリーク量Qleak(Nm3/min)を定量的に求め,Qleak=0.17(Nm3/min)と評価した。今回はエアリーク量としてこの値を用いる。巻込まれた気泡は下降流にのり,取鍋内溶鋼中に一旦全量が溶解すると仮定すると,浸漬管からの大気巻込みによる吸窒速度,d[N]leak/dt(%/min)は(22)式のようになる。
| (22) |
ここで,MN2:窒素の分子量(=28)である。
4・2・5 計算結果以上のモデルにおいて,各サイトの反応速度定数に関してはラボ実験から求められた値を用い,また,液側の物質移動係数,および,反応界面積については様々な鋼種で窒素濃度変化に合うように下記①~④をパラメータとし,実績値とフィッティングさせた。①RH真空層内における溶鋼中窒素の物質移動定数,km,②真空槽内溶鋼浴表面の反応界面積,AS,③吹込ガスの反応界面積,Ab(x),④CO気泡の反応界面積,ACO。
Table 3に示す操業条件において,各鋼種の脱窒・吸窒速度実績値と計算値を最小二乗法でフィッティングさせることによりこれらのパラメータを決定した。その結果,①km=0.12(m/min)となり,Mukawaら9)の小型実験の値0.054(m/min.)の約2倍の値となる。②AS=26(m2)となり,下部槽の断面積=4.1(m2)の約6倍の値である。③吹き込み窒素気泡の反応界面積は,窒素ガス流量と気泡滞留時間によって変化するが,PV=1.3×10−3(atm),Qg=3(Nm3/min)の場合でAb=1.95(m2)となる。④脱炭最盛期のACO=164(m2)となる。
| Amount of molten steel | 280 t |
|---|---|
| Inner diameter of snorkel | 0.75 m |
| Inner diameter of vacuum vessel | 2.3 m |
| Pressure in vacuum vessel | 1 ~ 35 Torr |
| Flow rate of injection gas | 3 Nm3/min |
| [C] concentration | 0.002 ~ 0.040% |
| [O] concentration | 3 ~ 400 ppm |
| [N] concentration | 40 ~ 220 ppm |
| [S] concentration | 0.005 ~ 0.030% |
窒素濃度が50 ppm以上の高窒素溶鋼をRH真空脱ガス法で処理した場合の脱吸窒速度に関して,モデルより計算された平均窒素反応速度の実測値と計算値との比較をFig.11に示す。これによると,本モデルによる計算値は概ね実績と対応していることがわかる。
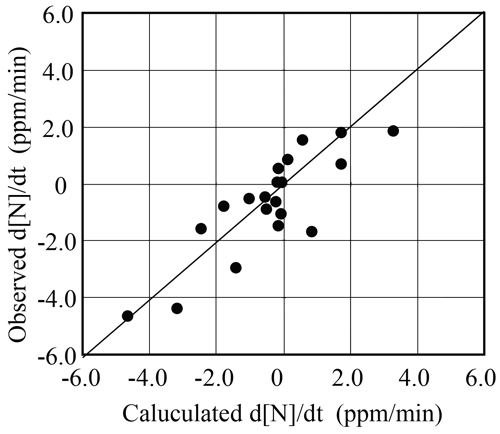
Comparison of reaction rate of nitrogen content calculated by mathematical model with observed rates.
以上のモデルを用い,浸漬管より純窒素ガスを吹き込んだ場合と30%水素−窒素混合ガスを吹き込んだ場合の処理中の窒素濃度変化について比較を行った。計算条件をTable 4に示す。計算は,高真空・高酸素濃度の下,CO気泡が多量に発生する脱炭I期,および,浴面近傍での脱炭が主体の脱炭II期について,いずれも酸素濃度が400 ppmと高い条件として行った。さらに,低真空状態(35 Torr)の下,Al脱酸した酸素100 ppmのセミキルド条件,および,酸素濃度5 ppmのフルキルド条件について計算を行った。
| I | II | III | IV | |
|---|---|---|---|---|
| Decaborization | Decaborization | Semi killing | Full killing | |
| [C] concentration | 0.005 ~ 0.040% | 0.002 ~ 0.005% | 0.002% | 0.002% |
| [O] concentration | 400 ppm | 400 ppm | 100 ppn | 5 ppm |
| [N] concentration | 20 ~ 200 ppm | |||
| [S] concentration | 0.005% | |||
| [Mn] concentration | 0.80% | |||
| Amount of molten steel | 280 ton | |||
| Injection gas | N2, 30%H2-N2 | |||
| Flow rate of injection gas | 3 Nm3/min | |||
| Pressure in vacuum vessel | 1 Torr | 1 Torr | 35 Torr | 35 Torr |
モデルより計算された極低炭素・高窒素鋼の窒素濃度変化の実績値と計算値の比較をFig.12に示す。脱炭I期(脱炭最盛期)は酸素濃度が高いが,内部脱炭によって大量のCO気泡が発生するため,高窒素域からの脱窒速度は大きい。脱炭II期は,内部脱炭によるCO気泡の発生がほとんど生じず,なおかつ高酸素であるため,脱窒がほとんど生じない。キルド期の脱酸不良の時期は,低真空状態(35 Torr)で窒素環流処理を行ったが,酸素濃度が脱炭期よりも低いため,浴表面からの脱窒速度が大きくなり脱窒が進行する。
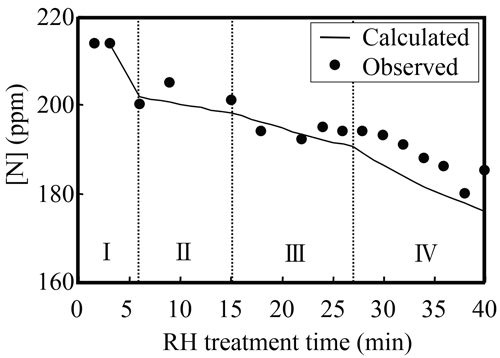
Comparison of change in nitrogen content calculated by mathematical model with observed changes during RH degassing process.
次に,純窒素,水素混合ガス吹き込み時の吸脱窒速度の比較をFig.13に示す。純窒素吹きに関しては実測値をプロットしている。脱炭I期に関しては,純窒素の吹き込みでは加窒することが困難であるが,水素混合ガス吹込みにより加窒速度は増加し,低窒素側では加窒することが可能となると考えられる。脱炭II期に関しても,純窒素では加窒することが困難であるが,水素混合ガス吹込みにより高窒素濃度側でも加窒することが可能となると考えられる。さらに,セミキルド状態においても水素混合ガスにより加窒速度は増加することがわかる。

Reaction rate of nitrogen content calculated by mathematical model during each period in RH degassing process.
一方,フルキルド状態では酸素濃度が低いため,水素混合ガスの吹き込み効果は小さく,純窒素ガス吹き込みに対して加窒速度を増加させることは難しいと考えられる。
窒素に水素を混合したガスを溶鋼に上吹きすることにより,高酸素濃度域においても加窒速度の向上が可能か実験を行うとともに,RH真空脱ガス法の還流ガスとして窒素と水素の混合ガスを適用した場合の加窒挙動について,窒素反応サイトを考慮した反応モデルを用いて予測した。
(1)高酸素濃度の溶鋼に水素−窒素混合ガスを上吹きすることにより,ガス−メタル界面の酸素濃度を低下することができ,純窒素ガスに比べ加窒速度を増加することができる。
(2)100 ppm以上の高酸素濃度域における加窒時の化学反応速度定数は原口らの脱窒反応時の化学反応速度定数に近い。
(3)RH真空脱ガス法の吸・脱窒モデルによる解析の結果,環流用窒素ガス気泡からの吸窒速度は鋼浴表面からの脱窒速度と比較して小さい。環流用窒素ガス気泡から迅速に加窒するためには,環流ガスの気泡−溶鋼界面での酸素濃度の低下や,反応界面積の増加が必要である。
(4)モデルによる解析の結果,環流ガスとして30%H2-N2混合ガスを適用した場合,高酸素濃度域,特にCO気泡の発生がない脱炭II期で吸窒促進効果が大きい。キルド処理中は,鋼中の酸素濃度が低いため,H2-N2混合ガス利用による効果は小さい。