2015 年 101 巻 12 号 p. 636-644
2015 年 101 巻 12 号 p. 636-644
The copper distribution ratio between the Na2S flux and silver, LCu(flux-Ag) (=[mass% Cu](in flux) / [mass% Cu](in Ag)), was measured at 1473 K in order to know the copper capacity of Na2S flux. As the greatest value, LCu(flux-Ag) = 42 was obtained. By combining the LCu(flux-Ag) value with the distribution ratio of copper between the silver and the carbon-saturated iron, LCu(Ag-Fe), the distribution ratio of copper between the Na2S flux and carbon-saturated iron, LCu(flux-Fe), is derived to be 330 at 1473 K. Moreover, the sulfurization removal of copper in iron silver phase into Na2S flux has been tried at 1473 K. Silver can keep iron from being sulfurized, which enables to maintain the high copper capacity of the Na2S flux. For this reason, the LCu value increases with an increase of sulfur potential. Copper removal proceeds at lower 0.1mass%Cu, and the Cu content decreased to 0.06mass%. The silver phase prevents the sulfur dissolution into the iron, and the sulfur content of iron can be kept lower ([mass%S]in Fe-C < 0.007-0.02).
鉄鋼スクラップは将来にわたり増加が見込まれ,高度循環型製鉄における主要資源の1つとして利用拡大が望まれている。しかし一部の老廃スクラップにはCuやSnのような,一旦鉄中に溶解すると除去困難なトランプエレメントが含まれており,リサイクルが難しい。そのため,多くのスクラップがリサイクルされずに蓄積するとの予測もある。
著者らはこれまでにAg相を媒介相として用いた溶鉄中Cu,Snの酸化除去について検討し,Cuは約0.3 mass%,Snは0.001 mass%以下1)に低減することを明らかにした。Cuの除去に関しては,さらにCu2Oの活量を低下させるB2O3系フラックスを用いることにより,Fe中Cu濃度を0.2 mass%以下に低減できることを示した2)。
一方,脱Cuに有効な方法として,硫化除去が多く検討されてきている例えば3,4,5,6)。Na2S系フラックスによる脱銅の結果3)をFig.1に示す。Na2S系フラックス中では,CuS0.5の活量係数が下がり,フラックスの脱Cu能は上昇するが,同時にFeSの活量係数も下がるため,FeSもフラックス中へ吸収されやすくなる。そのため,Na2S濃度の高い(FeS濃度の低い)高塩基性フラックス中では,硫黄ポテンシャルを上げることができず,分配比は小さくなる。その結果,Fig.1(b)に示す通りNa2S-FeS系フラックスでは,分配比は約20となり,脱Cuに十分な分配比を得ることができない。またFe中S濃度が上昇し,処理後の脱硫が必要となる。
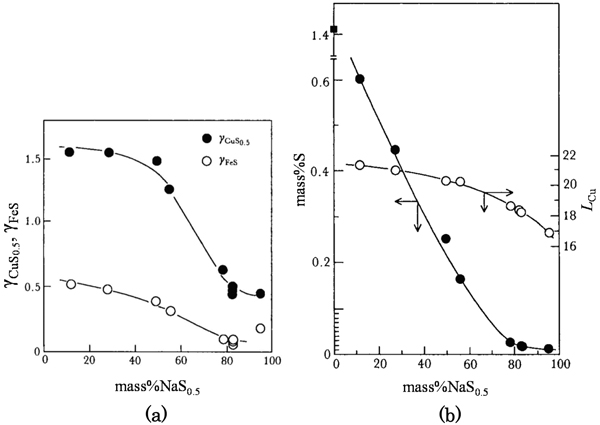
(a) The activity coefficient of CuS0.5 and FeS in NaS0.5 -FeS flux and (b) The distribution ratio of Cu between Fe-Csatd. and NaS0.5 -FeS flux and the sulfur content of Fe-Csatd. at 1473 K.
本研究ではFe,硫化物フラックス間にAgを配置することにより,溶鉄中Cuを,Agを媒介としてフラックス中へ硫化除去する方法について検討した。AgはFeと不混和なため,Feの硫化を抑制し,高いCu吸収能をもつフラックス中にCuのみを硫化できる可能性がある。そこでまず,本手法を用いたときの炭素飽和溶鉄−フラックス間のCu分配比を見積もるため,硫化物フラックスとしてNa2Sを用いてAg−フラックス間のCu分配比の測定を行った。さらに実際に,Ag相を介した炭素飽和溶鉄中Cuの硫化除去実験を行った。
Fig.2に原理図を示す。炭素飽和溶鉄,Ag間にCuが分配する反応は,(1)式で表される。
| (1) |
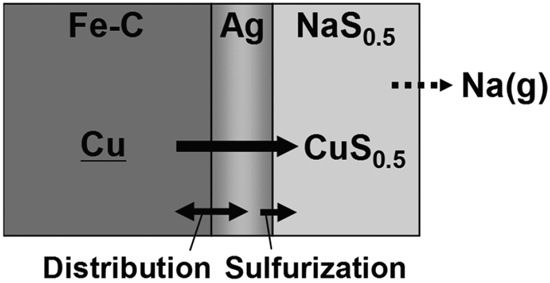
Schematic representation of the removal of Cu from Fe-Csatd. into NaS0.5 flux via Ag phase proposed in this study.
Ag中に分配したCuは,(2)式によりフラックス中のSにより硫化される。ここで本研究では硫化物はカチオン1個あたりを基本単位として表記し,フラックス中硫化物濃度はそのカチオン分率に等しいとした。
| (2) |
(1),(2)式を組み合わせると,Fe中Cuの硫化を表す(3)式が得られる。
| (3) |
本研究では,この原理に基づいてAg相を介したFe中Cuの硫化除去を試みた。また本研究ではFe相を炭素飽和鉄とし,硫化物フラックスとしてNa2Sを用いた。
実験にはガス雰囲気制御ができるムライト製反応管(外径70 mm,内径60 mm,長さ1000 mm)の電気抵抗炉を用いた。
3・1 フラックス−Ag間のCu分配比の測定Table 1に実験条件を示す。実験はるつぼの種類を変えたRun 1-7,Run 8-13の2通りで行った。実験方法を以下に示す。
| No. | Crucible | Metal (g) | Sulfide (g) | [mass%Cu] (in Ag) | Time (min) | |||
|---|---|---|---|---|---|---|---|---|
| Ag | Cu | Na2S | Ag2S | Cu2S | ||||
| 1 | Al2O3 | 9.7 | 0.29 | 5.1 | – | – | 2.9 | 10 |
| 2 | 10.0 | 0.31 | 5.0 | 3.0 | 30 | |||
| 3 | 10.0 | 0.30 | 5.0 | 2.9 | 60 | |||
| 4 | 9.9 | 0.29 | 5.0 | 2.9 | 50 | |||
| 5 | 10.2 | 0.30 | 5.0 | 2.9 | 110 | |||
| 6 | 10.1 | 0.31 | 5.0 | 3.0 | 170 | |||
| 7 | 10.1 | 0.31 | 5.0 | 3.0 | 890 | |||
| 8 | C | 10.0 | 0.11 | 1.8 | 0.25 | 0.24 | 1.0 | 180 |
| 9 | 10.1 | 0.30 | 1.8 | 0.62 | – | 2.9 | ||
| 10 | 10.0 | 0.31 | 1.7 | 0.93 | – | 3.0 | ||
| 11 | 10.1 | 0.08 | 1.7 | 0.50 | 0.28 | 0.8 | ||
| 12 | 10.0 | 0.30 | 1.5 | 1.55 | – | 2.9 | ||
| 13 | 10.0 | 0.08 | 1.5 | 1.12 | 0.28 | 0.8 | ||
(1)Run 1-7
アルミナるつぼ(外径30 mm,深さ45 mm,容量30 cm3)に試薬Ag 10 g,試薬Cu 0.3 g,Na2S 5 gを入れた。このるつぼをアルミナ製のホルダー(外径52 mm,内径42 mm,高さ100 mm)に入れ,1473 K,Ar雰囲気の炉に装入した。上方より試料を観察し,試料が溶融してから実験時間の計測を行った。なお,試料は約10 minで溶融した。所定時間経過後,試料を炉から取り出し,Ar気流中で空冷した。
ここで,Run 4-7の実験はRun 1-3と同様であるが,Naの蒸発を抑制する目的でアルミナれんがの蓋を取りつけている点が異なる。
(2)Run 8-13
黒鉛るつぼ(外径17 mm,内径12 mm,高さ80 mm)に試薬Ag,Cu,Na2S,Cu2S,Ag2Sをそれぞれ秤量し入れた。ここでフラックスの初期組成はCu,Sの全量をそれぞれ0.3,0.8 gに固定した。そのるつぼに直径1.7 mmの穴を開けた黒鉛製の蓋を取り付け,これをアルミナ製のホルダー (外径52 mm,内径42 mm,高さ100 mm)に入れ1473 K,Ar雰囲気の炉に装入し,保持した。実験時間は170 minとした。その後試料を炉から取り出し,空冷した。
実験後のRun 1-13の試料に対し,Ag中Cu濃度,フラックス中Cu,Ag,Na濃度をICP発光分光分析法により分析した。アルミナるつぼを使用したRun 1-7に関して,Ag,フラックス中Al濃度は十分希薄であることを分析により確認した。また,アルミナるつぼを使用したRun 3について,実験後のるつぼ内側を切削し,得られた粉末についてXRDにより相同定を行った。
3・2 Ag相を介した炭素飽和溶鉄中Cuの硫化除去実験に使用したFe-Cu-C合金は,黒鉛るつぼ(外径44 mm,内径36 mm,高さ125 mm)にFe-4 mass%Cu-C(satd.)の組成になるように電解鉄,試薬Cu,試薬C粉末を入れ,Ar雰囲気,1600 Kの炉内で2.5 h保持することによって作製した。
実験条件をTable 2に示す。るつぼの種類を変えて,Fig.3(a)Run 14-17,(b)Run 18,(c)Run 19-23の3通りの実験を行った。これらの実験方法を以下に示す。
| No. | Crucible | Initial mass (g) | Time (h) | |||
|---|---|---|---|---|---|---|
| Ag | Cu | Na2S | Ag2S | |||
| 14 | Al2O3 | 59 | 0.85 | 5.1 | – | 2 |
| 15 | 60 | 0.84 | 5.0 | – | 0.5 | |
| 16 | 65 | 0.71 | 5.0 | – | 4 | |
| 17 | 60 | 0.15 | 5.1 | – | 0.5 | |
| 18 | C | 45 | 0.41 | 2.5 | – | 1.5 |
| 19 | BN | 60 | 0.17 | 5.1 | – | 0.5 |
| 20 | 60 | 0.17 | 5.0 | – | 1 | |
| 21 | 60 | 0.17 | 5.1 | – | 4 | |
| 22 | 60 | 0.17 | 5.1 | – | 12 | |
| 23 | 55 | 0.17 | 3.3 | 7.0 | 12 | |
(1)Run 14-17
Fig.3(a)に実験装置図を示す。アルミナるつぼ(外径38 mm,内径33 mm,高さ50 mm)に開口部を設けたアルミナ円筒(外径21 mm,内径16 mm,長さ55 mm)を入れ,試薬Ag,Cuをアルミナ円筒内外に入れた。アルミナ円筒内に黒鉛円筒,あらかじめ作製したFe-Cu-C合金を入れ,アルミナ円筒をアルミナセメントで封じた。その後,試薬Na2Sをアルミナ円筒外に入れ,室温の炉内に装入した。炉内をAr雰囲気で1373 Kまで2 hで昇温して0.5 h保持し,Ag-Cu相のみを融解させた。その後1473 K(±5 K)まで0.5 hで昇温し,同温度に達してからの時間を計測し,実験時間とした。保持時間は0.5-4 hとした。その後試料を炉から取り出し,Ar気流中で空冷した。
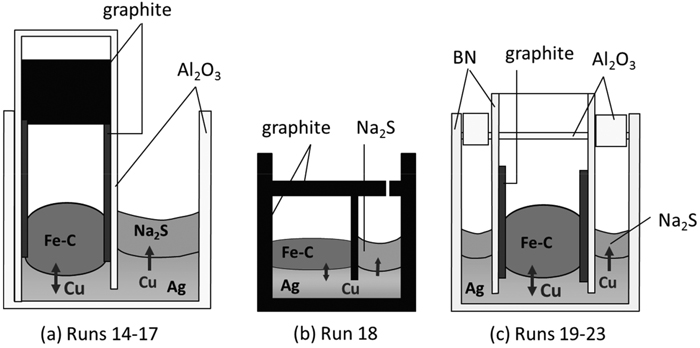
Schematic cross sections of the crucibles for the removal of Cu from Fe-Csatd. into NaS0.5 flux via Ag.
(2)Run 18
Fig.3(b)に実験装置図を示す。黒鉛るつぼ(外径38 mm,内径 34 mm,高さ50 mm)に開口部を設けた黒鉛円筒(外径25 mm,内径22 mm,長さ30 mm)を入れ,固定した。試薬Ag,Cuを黒鉛円筒内外に入れ,黒鉛円筒内にあらかじめ作製したFe-Cu-C合金を入れ,円筒外に試薬Na2Sを入れた。直径1.7 mmの穴を開けた黒鉛製の蓋 (直径34 mm,厚さ3 mm)を,穴がNa2Sの上方に位置するように取り付けた。この試料を1473 K,Ar雰囲気の炉内に装入し,1.5 h保持した。その後試料を炉から取り出し,空冷した。
(3)Run 19-23
Fig.3(c)に実験装置図を示す。窒化ホウ素製のるつぼ(外径38 mm,内径32 mm,高さ50 mm,以下窒化ホウ素をBNと表記する)に,開口部を設けたBN円筒(外径21 mm,内径16 mm,長さ55 mm)をるつぼの中央に位置するように固定した。試薬Ag,CuをBN円筒内外に入れ,円筒内に黒鉛円筒,あらかじめ作製したFe-Cu-C合金を入れた。その後,試薬Na2SをBN円筒外に入れた。1473 K,Ar雰囲気の炉内に装入し,0.5-12 h保持した。なおFe相が溶融した時点より計測を開始した。保持後試料を炉から取り出し,Ar気流中で空冷した。なおRun 23については,試薬Na2S,Ag2Sをアルミナるつぼに入れ,1473 K,Ar雰囲気で15 minプリメルトして得たものを硫化物フラックスとして用いた。また,Fe,Ag相のみを3 hプリメルトし,一旦取り出し冷却した後,硫化物フラックスを添加し,再び炉内に装入して1 h保持した。
実験後のRun14-23の試料に対し,Fe中Cu,Ag濃度,Ag中Cu濃度,フラックス中Cu,Ag,Na,Fe濃度をICP発光分光分析法,Fe中C,S濃度を高周波燃焼赤外線吸収法により分析を行った。Ag中Cu濃度に関しては円筒内外の濃度の違いを調べるため,円筒内外のAg相を分けて濃度分析を行った。
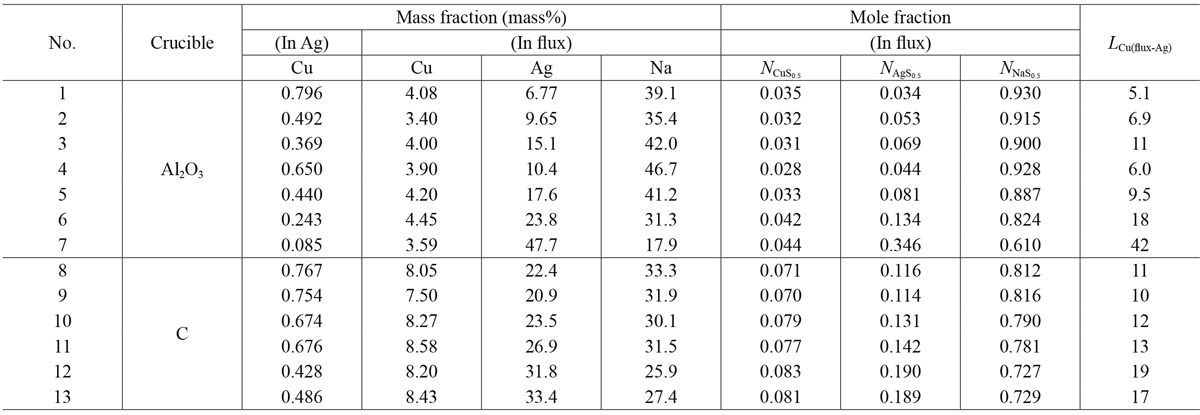
実験結果をTable 3に示す。表中の各硫化物組成は,カチオン1個あたりを基本単位として表記し,フラックス中の硫化物濃度はそのカチオン分率に等しいとした。以降熱力学的に取り扱いする際にはCu,Ag,Naの硫化物をCuS0.5,AgS0.5,NaS0.5として扱う。本実験において,NaS0.5によるCu,Agの硫化反応が,Naの蒸発とともに進行し,フラックスの組成が時間とともに変化する。そのため本測定値は,厳密には平衡状態といえない。しかしながら,一定時間保持後はNaの蒸発が十分緩やかとなりほぼ定常状態となるため,Agとフラックス間で平衡が成立していると仮定して分配比による整理を行った。本研究において,i-j間のCu分配比をLCu(i-j)(=[mass%Cu](ini)/[mass%Cu](inj))と定義した。Fig.4にRun 1-7における実験時間に対するAg中Cu濃度を示す。黒丸はRun 1-3,白丸はRun 4-7である。図より明らかなように時間が長いほど,Ag中Cu濃度が低下する傾向がみられ,蓋を付けていないRun 1-3はRun 4-7に比べてAg中Cu濃度の低下が速かった。Fig.5にRun 1-7における時間に対するフラックス−Ag間のCu分配比LCu(flux-Ag)の関係を示す。図より時間が長くなるにつれて分配比が大きくなる傾向を示した。またFig.6に実験結果をNaS0.5-CuS0.5-AgS0.5 3元系状態図上にプロットした。また図中の数字はLCu(flux-Ag)を表す。この結果より,フラックス中AgS0.5濃度が高くなるほどCu分配比が上昇し,最大42となった。
| No. | Crucible | Mass fraction (mass%) | Mole fraction | LCu(flux-Ag) | |||||
|---|---|---|---|---|---|---|---|---|---|
| (In Ag) | (In flux) | (In flux) | |||||||
| Cu | Cu | Ag | Na | NCuS0.5 | NAgS0.5 | NNaS0.5 | |||
| 1 | Al2O3 | 0.796 | 4.08 | 6.77 | 39.1 | 0.035 | 0.034 | 0.930 | 5.1 |
| 2 | 0.492 | 3.40 | 9.65 | 35.4 | 0.032 | 0.053 | 0.915 | 6.9 | |
| 3 | 0.369 | 4.00 | 15.1 | 42.0 | 0.031 | 0.069 | 0.900 | 11 | |
| 4 | 0.650 | 3.90 | 10.4 | 46.7 | 0.028 | 0.044 | 0.928 | 6.0 | |
| 5 | 0.440 | 4.20 | 17.6 | 41.2 | 0.033 | 0.081 | 0.887 | 9.5 | |
| 6 | 0.243 | 4.45 | 23.8 | 31.3 | 0.042 | 0.134 | 0.824 | 18 | |
| 7 | 0.085 | 3.59 | 47.7 | 17.9 | 0.044 | 0.346 | 0.610 | 42 | |
| 8 | C | 0.767 | 8.05 | 22.4 | 33.3 | 0.071 | 0.116 | 0.812 | 11 |
| 9 | 0.754 | 7.50 | 20.9 | 31.9 | 0.070 | 0.114 | 0.816 | 10 | |
| 10 | 0.674 | 8.27 | 23.5 | 30.1 | 0.079 | 0.131 | 0.790 | 12 | |
| 11 | 0.676 | 8.58 | 26.9 | 31.5 | 0.077 | 0.142 | 0.781 | 13 | |
| 12 | 0.428 | 8.20 | 31.8 | 25.9 | 0.083 | 0.190 | 0.727 | 19 | |
| 13 | 0.486 | 8.43 | 33.4 | 27.4 | 0.081 | 0.189 | 0.729 | 17 | |
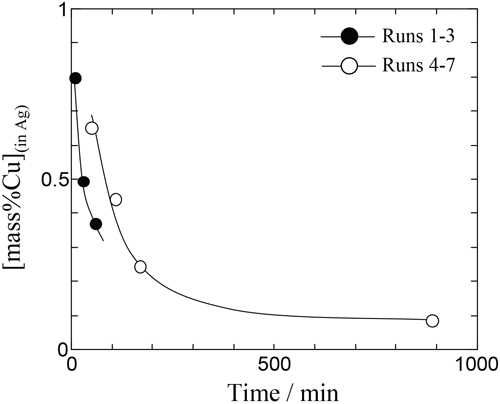
Variation of Cu content of the Ag with time at 1473 K.
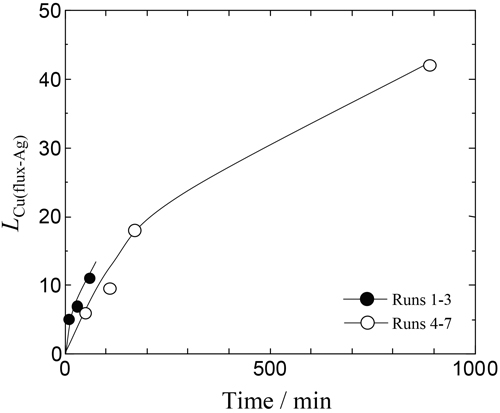
Variation of the distribution ratio of Cu between flux and Ag, LCu(flux-Ag)(=[mass%Cu](in flux)/[mass%Cu](in Ag)), with time at 1473 K.

The LCu(flux-Ag) values of the NaS0.5-CuS0.5-AgS0.5 flux in Runs 1-7 at 1473 K.
一方1473 KにおけるAg-Fe間の平衡Cu分配比LCu(Ag-Fe)は,以下のように計算される。平衡状態において,Fe,Ag中Cuの活量は等しいので,(4)式に対して(5)式が成り立つ。
| (4) |
| (5) |
(5)式を無限希薄溶液における活量係数とモル分率の積で表すとFe-Ag間のモル分率表示のCu分配比,LCu(Ag-Fe, mol)は(6)式で表される。
| (6) |
ここで,1523 Kにおけるγ°Cu(in Fe-C)(=50.2)7)を,正則溶液近似を用いて1473 Kに変換した値(=57.3)と,γ°Cu(in Ag)(=3.26)8)を代入し,質量濃度に換算すると,LCu(Ag-Fe)=7.86が得られる。LCu(flux-Ag)とLCu(Ag-Fe)の積より,フラックス−Fe間のCu分配比LCu(flux-Fe)は約330となり,本実験の硫化物フラックスはCu吸収能が非常に大きいと考えられる。本実験条件ではフラックスがAgの周りを覆っており,フラックスとるつぼが直接接触していた。Fig.7にRun 3のアルミナるつぼ内側を切削した粉末のXRD測定結果を示す。図より,Al2O3とNaAlO2相が同定され,Al2O3とNa2Sが一部反応していることがわかった。

X-ray diffraction pattern of the oxide formed on the alumina crucible in Run 3.
Run 8-13の実験結果をNaS0.5-CuS0.5-AgS0.5 3元系状態図上にプロットしたものをFig.8に示す。黒丸がフラックスの初期組成,白丸が実験結果を表す。また図中にLCu(flux-Ag)の値を示した。この結果,Fig.6と同様にフラックス中AgS0.5濃度が高くなるほどLCu(flux-Ag)の値が上昇した。また,本実験のようにCu,Sの量を固定した場合,フラックス組成がCuS0.5のモル分率がほぼ一定の直線上に表された。また,初期フラックス組成においてNaS0.5のモル分率を0.90,0.85,0.75の3通りで実験を行っており,各初期NaS0.5濃度において実験結果がほぼ一致した。また,実験前後のNaS0.5濃度は,初期モル分率が0.90,0.85,0.75の試料でそれぞれ9.5%,7.6%,2.9%減少し,初期NaS0.5濃度が高い試料ほど減少割合は大きくなった。
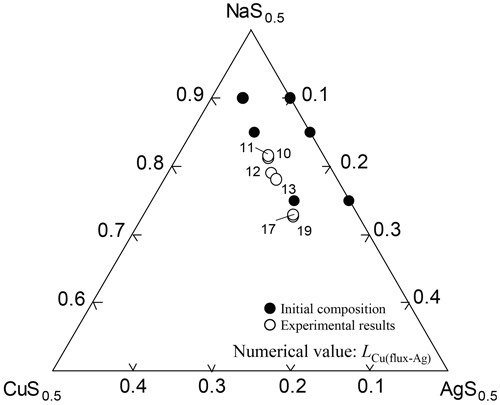
The LCu(flux-Ag) values of the NaS0.5-CuS0.5-AgS0.5 flux in Runs 8-13 at 1473 K.
Table 4に実験結果を示す。除去前のFe,Ag中Cu濃度は4・1で算出した1473 KにおけるLCu(Ag-Fe)の値(=7.86)と初期組成のFe,Cu,Agの質量から平衡分配した場合の濃度を算出した。このCu濃度の計算値と本実験結果を比較すると,実験時間が0.5 hのRun 15,19を除きFe中Cu濃度は計算値より低下し,Ag中Cu濃度は全ての実験で計算値よりも低下しており,Fe-Ag間のCu分配反応,Ag中Cuの硫化除去反応が同時に生じていた。
Experimental results of the sulfurizative removal of Cu from Fe-C(satd.) into sulfide flux via Ag at 1473 K.
Feの濃度分析結果より,Run 17,20-23において,硫化物フラックスにより平衡分配後のFe中Cu濃度が0.1 mass%以下においても,Cu濃度がさらに低下することがわかった。また,Fe中Ag濃度は0.05-0.08 mass%の範囲内であり,概ね0.06 mass%であった。S濃度は初期条件が一致しているRun 19-22で比較すると,保持時間が長いほど上昇する傾向があった。しかしながらRun 22,23以外は0.1 mass%以下であり,0.02 mass%前後と低かった。
Agの濃度分析において,Run 18,23は円筒内にAg相の量が十分でなく分析できなかった。また,一部の試料(Run 21-23)に関してはAg中Fe濃度の分析も行い,結果を表中に記載した。Ag中にはFeも0.01-0.04 mass%溶解していた。そして円筒内外のAg中Cu濃度はほぼ一致していた。
フラックスの濃度分析より,全ての実験でCuがフラックス中に溶解しており,これはメタル中Cuが硫化してフラックス中に移動したことを示している。一方,Ag濃度は3・1の実験と同様Cuよりも高くなり,本実験条件のようなCu濃度が低い条件ではCuよりAgの硫化量が大きいことが分かった。Fig.9に初期条件が一致しているRun 19-22の保持時間に対するLCu(flux-Fe),フラックス中Fe濃度の関係を示す。フラックス中Fe濃度は保持時間が長いほど上昇する傾向がみられ,12 h保持した場合,11.4 mass%と高濃度であった。その他の試料においてもFe濃度が数mass%の実験結果が複数あり,本実験条件においてFeの硫化によるFeSの生成反応は無視できない。フラックス中Na濃度はAg,Cu,Feの硫化にともない低下した。フラックス−Ag間,フラックス−Fe間,Ag-Fe間のCu分配比をTable 4中に示した。本実験条件において,LCu(flux-Ag)は4-14,LCu(flux-Fe)は17-51,LCu(Ag-Fe)は4-7となった。LCu(flux-Ag)は3・1の実験結果の最大値である42よりも小さく,4・1で計算された高い分配比が得られた試料はなかった。これは,Ag相中Cuの物質移動が律速となっているためと考えられる。
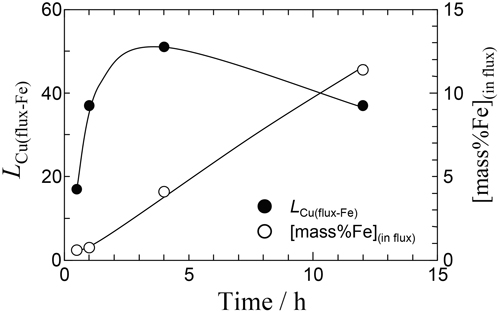
Variation of LCu(flux-Fe)(=[mass%Cu](in flux)/[mass%Cu](in Fe-C)) and Fe content of the sulfide flux with time at 1473 K in Runs 19-22.
本実験では,Al2O3,黒鉛,BN製のるつぼを用いた。ここでAl2O3製のるつぼと黒鉛製のるつぼを用いた実験では,るつぼ,円筒がAgよりNa2Sと濡れるために,それぞれ添加した硫化物の一部が円筒を伝ってFe相に移動した。この現象は特に黒鉛製のるつぼにおいて顕著であった。この現象が顕著であると,濡れによりFeと硫化物が直接接触し,接触部からFeの硫化が生じた可能性がある。一方,BN製のるつぼを用いた場合,Run 22,23以外はFeの上に硫化物は存在せず,硫化物の移動が生じにくかった。このことからAgを介した溶鉄中Cuの硫化除去実験においてはBNるつぼの使用が最適である。また,BNるつぼを使用してもフラックス中AgS0.5濃度が高い場合,濡れによるフラックスの移動が確認されたため,本フラックス系の全ての組成で濡れにくいるつぼの材質を選定する必要がある。
Table 3,Fig.4,5より,保持時間が長いほどAg中Cu濃度が下がり,フラックス中Cu,Ag濃度の上昇,LCu(flux-Ag)の上昇がみられた。また,蓋を取付けたRun 4-7に比べてRun 1-3はAg中Cu濃度の低下,フラックス−Ag間のCu分配比の上昇がともに速かった。この結果から,硫化物フラックスの構成成分の蒸発,それによるSポテンシャルの増大が考えられる。本研究において用いた硫化物フラックスはNaS0.5であり,Imai and Sanoの報告より,硫化物フラックスからはNaガスが生じていると考えられる3)。一方アルミナるつぼを用いた実験において,Fig.7よりNaS0.5はAl2O3と反応し,NaAlO2を生成していた。したがって,Sポテンシャルの増大について,NaS0.5の分解によるNaのガス化とNaAlO2の生成の2つが考えられる。すなわち,本研究における脱Cuは以下の反応によって進行すると推定される。
| (7) |
| (8) |
| (9) |
Ag中Cuが硫化するためにはS源が必要であり,本実験条件におけるS源はNaS0.5のみである。このことから,(7),(8)式の反応により生じたSによって(9)式で表されるCuの硫化反応が進行したと考えられる。アルミナるつぼを用いたRun 1-7においても,蓋を取付けることによりCuの硫化が遅くなったことから,(7)式が影響していると考えられる。黒鉛るつぼ,BNるつぼを用いたRun 8-13においてはAl2O3が含まれないため,(7)式のみが影響していると考えられる。
保持時間が一定で,黒鉛るつぼを用いたRun 8-13に対して,実験前後における各成分のモル分率の増減率をTable 5に示す。表中において正の値,負の値は実験前後でそれぞれモル分率が増加,減少したことを表す。Run 9,10,12においては初期CuS0.5濃度がゼロであり明らかにCuS0.5濃度が増加しているため「Increase」と表記した。表より,NaS0.5の初期モル分率を0.90としたRun 8,9は,実験後CuS0.5,AgS0.5のモル分率がともに上昇した。一方,NaS0.5の初期モル分率を0.85としたRun 10,11において,CuS0.5濃度は増加したが,AgS0.5濃度はRun 11が上昇,Run 10が減少した。またRun 10,11の実験後のフラックス組成はほぼ等しかった。NaS0.5の初期モル分率を0.75としたRun 12,13も同様の傾向を示した。
| No. | NCuS0.5 | NAgS0.5 | NNaS0.5 |
|---|---|---|---|
| 8 | 19 | 191 | –10 |
| 9 | Increase | 14 | –9 |
| 10 | Increase | –13 | –7 |
| 11 | 10 | 78 | –8 |
| 12 | Increase | –24 | –3 |
| 13 | 16 | 5 | –3 |
以上のことからRun 10-13において,Cuは全て正方向の硫化反応が生じていたが,Agは初期条件により正負両方向の反応が生じたと考えられる。Run 8-13のように初期硫化物にAgS0.5を加えた場合,過剰のAgS0.5は分解し,生じたSはCuの硫化に消費されると考えられる。つまり初期組成においてAgS0.5が過剰なRun 10,12は,溶融時のSポテンシャルが高く,分解することでSポテンシャルが低下する方向に反応が進むと考えられる。逆に初期組成よりもAgS0.5濃度が上昇した試料は実験中にSポテンシャルが上昇していると考えられる。すなわち,フラックスの初期組成により,溶融時Sポテンシャルが増加する方向,減少する方向の両反応が生じ,また,実験後のフラックス組成が初期NaS0.5量によりほぼ一致していることから,Ag−フラックス間は平衡状態にあると考えられる。
5・2 Agを介した炭素飽和溶鉄中Cuのフラックス中への硫化除去 5・2・1 炭素飽和溶鉄中pS2の算出Agを介した溶鉄中Cuの除去において,媒介相の効果を確かめるために,溶鉄中のSポテンシャルを調べることは重要である。本研究ではFe-S-C系のpS2を導出するためにChipman9,10,11)による侵入型溶体モデルを適用した。これは過去に硫化物フラックスと炭素飽和溶鉄を直接接触させることによる硫化脱Cuの研究において,Wangら12)が解析に用いたモデルである。本モデルを用いてFe相のS分圧を算出し,Wangらの結果4,5)との比較を行った。
溶鉄はfcc格子を構成していると考えられ12),侵入型元素の侵入位置の数はFe 1原子に対し1箇所である。Chipmanは侵入型原子と鉄原子の原子数比を原子比Yi,充填されている侵入位置と空いている侵入位置の数の比を格子比Zi,活量係数Ψi,相互作用係数θiを(10)−(13)式のように定義した9,10,11)。
| (10) |
| (11) |
| (12) |
| (13) |
ここでNi(in Fe)は元素iのモル分率,Nj(in Fe)は置換型元素jのモル分率を表す。活量の基準はヘンリーの法則にとり,Zi(格子比)→0のときΨi→1,ai→Ziとなるように決める。(10)−(13)式からFe中Sの活量は(14)式で表される。
| (14) |
ここでθjiは元素iに対するjの1次の相互作用係数であり,θSS,θCSは以下の値を用いた。θCSは温度依存性がないと仮定でき12),本実験条件においてFe中Cuのモル分率は非常に小さく,θSCuを含む項がaSに与える影響は非常に小さいため無視できる。
| (15) |
| (16) |
また,Fe中Sのガス化反応式とその標準ギブスエネルギー変化は(17),(18)式で表される12)。
| (17) |
| (18) |
(17)式の平衡式からFe中Sの分圧pS2が(19)式で与えられる。
| (19) |
(19)式に(10)−(16),(18)式の計算結果を代入し,pS2を算出した。Fig.10にFe相中pS2とLCu(flux-Fe)の関係を示す。1673 K,炭素飽和溶鉄とNaS0.5-FeSフラックス4)およびLiS0.5-FeSフラックス5)間のCu分配比LCu(flux-Fe)の測定結果を合わせて示す。図より,LiS0.5,NaS0.5系フラックスを用いた実験のpS2は10−7−10−4 atmとなったのに対し,本実験結果は10−10−10−8 atmとなり,平均して約3桁低くなった。また本実験の保持時間が0.5 h以上の試料においてLCu(flux-Fe)の値は29以上でありLiS0.5,NaS0.5系フラックスの実験結果よりも高い。このことから,Ag相を介することでフラックスとFe相間,すなわちAg相内に硫黄ポテンシャルの傾斜を与えることにより,Fe中Sポテンシャルを低く保ったまま溶鉄中Cu濃度が低下しているといえる。
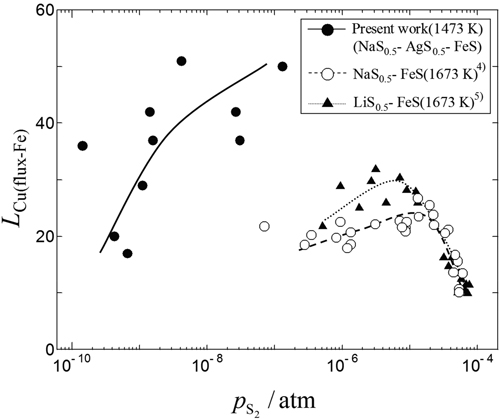
Dependence of LCu(flux-Fe) (=[mass%Cu](in flux)/[mass%Cu](in Fe-C)) on pS2 for several sulfide fluxes.
本実験においてCuの硫化反応は(20)式で表され,(20)式の標準生成ギブスエネルギー変化を(21)式に示す13,14)。フラックス中CuS0.5の活量,およびメタル中Cuの活量を活量係数とモル分率の積で表すと,メタル中Cu濃度が(22)式で表される。
| (20) |
| (21) |
| (22) |
ここでγi(inj),γ°i(inj),K(20)はそれぞれ純物質液体基準の溶媒j中iの活量係数,純物質液体基準の希薄溶液における溶媒j中iの活量係数,(20)式の平衡定数を表す。ここでK(20)の値は(21)式から1473 Kにおいて14.7である。ここである硫化物フラックスを用いて硫化脱Cuを行う際,γCuS0.5(in flux)が小さく,pS2が大きければ,メタル中Cu濃度を効果的に低下させることができる。しかし,本実験条件においてAg中S濃度の分析が困難であったため,γCuS0.5(in flux),フラックス中pS2の両方を測定できない。したがって,本研究では新たにCu分配比の指標ICuを(23)式のように定義した。
| (23) |
一方,(22)式においてNCu(in metal),NCuS0.5(in flux)は次式のようにmass%表示で近似できる。ここでMiはiの式量であり,フラックスの式量は(26)式により計算した。
| (24) |
| (25) |
| (26) |
ここで(27)式の関係からNCuS0.5(in flux)が(28)式で書き直される。
| (27) |
| (28) |
(24)−(28)式を(22)式に代入して整理すると,(29)式のようにICuの値は文献値とメタル,フラックスの濃度分析結果のみから求められる。
| (29) |
(29)式においてメタルをFeとすると(30)式が得られる。
| (30) |
(30)式にフラックスの式量と得られたICu,1473 KにおけるFe-C(satd.)の平均式量(=48.2),γ°Cu(in Fe-C)(=57.3),K(20)(=14.7)の値を代入すると,実験で用いた溶媒によらずフラックス−Fe(炭素飽和鉄)間のCu分配比を見積もることができる。
Fig.11にフラックス−Fe間のCu分配比を1−NNa(Li)S0.5(in flux)に対してプロットした。ここで測定値はそのまま使用し,Feを用いていない3・1の実験試料(NaS0.5-AgS0.5フラックス)については(30)式を用いて算出した。またFig.11中にWangらのNaS0.5-FeS,LiS0.5-FeSフラックスによる溶鉄からの脱Cu実験結果をあわせて示した4,5)。文献のFe相は本実験と同様に炭素飽和鉄である。Fig.11より,最も大きいCu分配比となったのは3・1の実験試料(NaS0.5-AgS0.5フラックス)であり,最大約330であった。3・1の実験試料(NaS0.5-AgS0.5フラックス)の値が3・2の実験試料(NaS0.5-AgS0.5-FeSフラックス)の値より大きくなった。これは,3・1の実験試料(NaS0.5-AgS0.5フラックス)が平衡状態のAg-Fe間のCu分配比となっているのに対し,Table 4に示すように3・2の実験試料(NaS0.5-AgS0.5-FeSフラックス)におけるAg-Fe間のCu分配比がいずれも平衡分配比である7.86よりも小さいためと考えられる。また,Wangらの結果は本実験結果よりも1−NNa(Li)S0.5(in flux)の値が大きく,フラックス−Fe間のCu分配比は本実験結果より小さかった。これは,本実験のようにAgを介することでFeのフラックス中への溶解が抑制され,Cu分配比が向上することを示している。
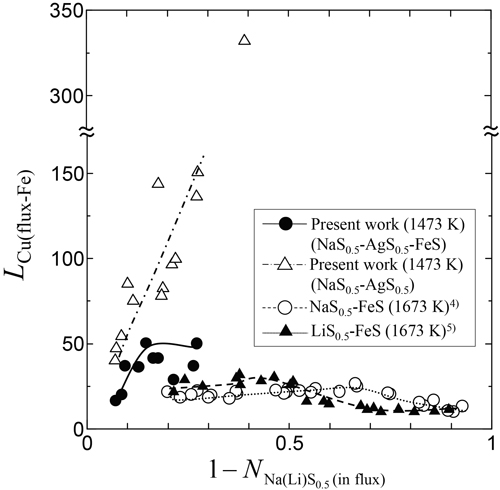
Comparison of the Cu distribution between flux and Fe, LCu(flux-Fe)(=[mass%Cu](in flux)/[mass%Cu](in Fe-C)), among several sulfide fluxes.
次に,pS2とγCuS0.5(in flux)の影響を考察するため,Fig.12において,NaS0.5-AgS0.5フラックスの本実験結果と文献値に対して(29)式からICuを計算し,1−NNa(Li)S0.5(in flux)に対してプロットした。ICuの値はNaS0.5-AgS0.5フラックスが最も大きい値となった。NaS0.5,LiS0.5濃度が高い場合ICuの値は低く,文献と傾向が一致した。文献よりNaS0.5,LiS0.5はCuS0.5の活量係数を小さくする効果はあるが,雰囲気を制御しない場合pS2が小さくなるため,Cu分配比の指標ICuが小さくなると考えられる。本研究においてpS2とγCuS0.5(in flux)の影響を完全に独立させることはできなかったが,Ag相を介することで高いCu分配比が得られることがわかった。

Comparison of the index of Cu capacity, ICu (≡p1/4S2 /γCuS0.5(in flux)), among several sulfide fluxes.
溶鉄中Cuの硫化除去におけるNaS0.5フラックスの硫化除去能の把握を目的とし,1473 KにおいてNaS0.5系フラックス−Ag間のCu分配比の測定,およびAgを介した炭素飽和溶鉄中Cuのフラックス中への硫化除去実験を行った。その結果,以下の結論が得られた。
(1)AgS0.5を含むNaS0.5フラックス−Ag間のCu分配比LCu(flux-Ag)は最大42となった。この値を用いて,LCu(flux-Fe)の値を計算すると最大約330と見積もられた。またフラックス中AgS0.5濃度が高いほどLCu(flux-Ag)は大きく,pS2が上昇していると考えられる。
(2)Agを介した溶鉄中CuのNaS0.5フラックスへの硫化除去を検討した結果,溶鉄中Cu濃度は初期濃度が0.1 mass%から0.06 mass%まで低減された。また本実験における溶鉄中S濃度は,概ね0.007~0.02 mass%程度に抑えられた。フラックス−Fe間のCu分配比は最大51となり,(1)の計算値より小さかった。
(3)溶媒メタルの異なる実験で得られたフラックスのCu吸収能を比較する指標としてICu(=p1/4S2 /γCuS0.5(in flux))を導入し,実験結果を比較した。本研究のNaS0.5(-AgS0.5)フラックス−Fe間のCu分配比について,過去のNaS0.5-FeS,LiS0.5-FeS系フラックスよりも大きい値が得られた。
本研究の一部はJSPS科研費24561012の助成を受けて行われたものである。ここに謝意を表する。