2018 Volume 104 Issue 11 Pages 634-639
2018 Volume 104 Issue 11 Pages 634-639
Copper sulfide (CuxS) has been frequently observed in steel samples, prepared using selective potentiostatic etching by electrolytic dissolution (SPEED). It is often the case that CuxS is detected unexpectedly from the precipitates extracted from steel samples by selective potentiostatic etching, although such CuxS formation during the heat treatment conducted is not anticipated by the thermodynamic equilibrium calculations.
In this study, we observed such artificial CuxS along with manganese sulfide (MnS) precipitates, which were extracted from steel materials by SPEED, using secondary electron microscope (SEM) equipped with energy dispersive X-ray spectroscopy (EDX) and Auger electron spectroscopy. These CuxS-MnS sulfide complex would be formed by the following mechanism: as the solubility of CuxS is far bigger (i.e. 10 times or more) than that of MnS, Cu2+ ion dissolved from steel matrix would be exchanged with Mn2+ ion on the MnS surface during the etching process, leading to a formation of CuxS-MnS sulfide complex.
In order to suppress the formation of such CuxS, we propose the use of following electrolyte: a non-aqaueous solutions of 4% methyl salicylate + 1% salicylic acid + 1% tetramethylammonium chloride (TMAC) + 5% Triethylenetetramine (TET) in volume fraction, in methyl alcohol (Cu ion selective hold etching by electrolytic dissolution, abridged as CUSH electrolyte). Then, this electrolyte was applied to precipitates in steel samples. It was effective to prevent the formation of sulfides in electrolyte, with the effect of metallic (Cu2+, Ag+, Pb+, etc.) chelating ability of TET.
鉄鋼材料は微量添加元素や様々な熱処理によって,材料マトリックス中に存在する鋼中微粒子(介在物や析出物)の種類,アスペクト比などの形状,粒径,個数密度等を制御して,鉄鋼材料に求められる強度や特性をコントロールすることが広く実施されている。したがって,鋼中微粒子の観察や,成分,含有量を測定することは鉄鋼材料の品質管理や製造プロセスの解析を行う上で重要である。鋼中微粒子の観察をSEM等で行うためには,マトリックス中に埋没した鋼中微粒子を観察表面に露出させる必要があり,1979年にKurosawaら1)が開発した非水溶媒系電解液を用いるSPEED(selective potentiostatic etching by electrolytic dissolution)法が広く世界中で使用されている。これらの鋼中微粒子を同定・定量分析する場合にも,鉄鋼試料を上述の方法で1 g相当電解した後,鋼中微粒子を電解残渣として回収し,同定・定量分析することが行われている。この時,鋼中微粒子を,存在していた状態のままに抽出することが重要である。この中でも,硫化銅(CuxS)の観察,分析には従来不明な点が報告されていた2–9)。例えば鉄鋼材料を1473~1573 Kの高温から急冷させSPEED法で電解エッチングして観察すると硫化銅が大量析出する10–12)と報告例があるが,これはFactSageなど化学熱力学的計算から予測13)される析出温度(973 K近傍)より高い温度域であり,計算予測と実験結果が一致していない。Tan and Pistorius2)はこれらの硫化銅が発生する理由として鋼の中で安定なMnSは水溶液中では不安定となり容易に分解しやすい上に,Cu2+は水溶液中では,Sが存在すると容易に硫化物を生成しやすいことから,水溶液と類似したメタノール(非水溶媒系)電解液中においてもMnSとCu2+が反応してartificialな硫化物を生成するためと報告している。そこで今回,SPEED法による電解エッチングの時にMnSの周囲に鋼の中では存在していなかった硫化物(以下,偽装硫化物と記す)が新たに生成するメカニズムについて検討するとともに,この生成を防止できる電解液および電解方法について検討したので,以下に報告する。
実験に使用した熱延板試料の組成をTable 1に示す。熱延板をL方向に鏡面研磨してSEM-EDX観察に供した。SEM装置は日本電子製FE-SEM,型式JEOL7001FをWD10 mm,加速電圧15 kVで使用した。オージェ電子分光分析装置は,PHI社製FE-AES PHI-700型,電子ビーム:10 kV,10 nA,イオンビーム:Ar/2 kVで実施した。電解エッチング装置は藤原製作所製SPEED ANALYZER FV-138を使用した。深さ方向のスパッタリングレートの換算には標準物質としてSi/SiO2を用い,薄膜SiO2換算のスパッタリング深さを採用した。試料表面の酸化に伴う酸素の影響は排除して原子量比率を計算した。ICP発光分析装置は,島津製作所製のICPS-8100を用い,測定波長は,Mn:257.610 nm,Cu:327.396 nmを使用して分析した。Table 2に試料前処理,電解液および電解条件を示す。鏡面研磨面の電解エッチング量は約30C,鋼を1 g相当電解して定量分析する場合は約3456C電解した。電解液のろ過はTable 2 No9(従来電解条件)では0.2 µmφポリカーボネート製フィルターおよびTable 2 No10(開発電解条件)では4フッ化エチレン樹脂製フィルター(PTFE)を採用した。
| Element | C | Si | Mn | S | Cu |
|---|---|---|---|---|---|
| weight % | 0.07 | 3.3 | 0.1 | 0.025 | 0.07 |
| No | name | surface finishing | Electrolyte | Cu chelating agent | added Ion | Coulomb (C) | Filter |
|---|---|---|---|---|---|---|---|
| 1 | Mirror | mirror-polished | – | – | – | – | – |
| 2 | 4%MS | mirror-polished | 4%MS | – | – | 30 | – |
| 3 | 10%AA | mirror-polished | 10%AA | – | – | 30 | – |
| 4 | 4%MS+Ag | mirror-polished | 4%MS | – | Ag 20 µg/ml | 30 | – |
| 5 | 4%MS+Cu | mirror-polished | 4%MS | – | Cu 20 µg/ml | 30 | – |
| 6 | 4%MS+5%TET | mirror-polished | 4%MS | 5% TET | – | 30 | – |
| 7 | 4%MS+5%PEH | mirror-polished | 4%MS | 5% PEH | – | 30 | – |
| 8 | 4%MS+5%EDTA | mirror-polished | 4%MS | 5% EDTA | – | 30 | – |
| 9 | 4%MS 3456C | polished | 4%MS | – | – | 3456 | Polycarbonate 0.2 μm |
| 10 | 4%MS+5%TET 3456C | polished | 4%MS | 5% TET | – | 3456 | PTFE 0.2 μm |
TMAC: Tetra methyl ammonium chloride, 4%MS: 4% methyl salicylate + 1% salicylic acid + 1%TMAC + methanol, 10%AA: 10% acetylacetone + 1%TMAC + methanol, TET: triethylene tetramine, PEH: pentaethylene hexamine, EDTA: ethylene diamine tetraacetic acid
熱延板の供試料をTable 2 No1の条件で鏡面研磨してSEM-EDX観察した例をFig.1に示す。約150 nmのMnS粒子にMn,S,CuのEDXの元素マッピングと強度比を重ね合わせていくと,MnとS元素マップは丸く,強度比はGaussian分布を示しており,熱延時に加工誘起析出したことを示唆した。一方,CuのEDXの信号強度はL方向に一定であり,母材と粒子間で信号強度の変化は確認されなかった。すなわち研磨後にSEM-EDX観察すると熱延で析出したMnS周囲にCuの存在は認められなかった。次にTable 2 No2 4%MSの条件でエッチングした後にSEM観察した例をFig.2に示す。MnS粒子の周囲にトップハット分布のCu付着が認められた。電解液をTable 2 No3の10%AAに変更しても同様の結果を得た。以上の結果よりFig.2で観察された硫化銅は,鋼の中には本来存在せず,鋼材に含まれるCuが電解液に溶解してCu2+となりMnS表層で偽装硫化物が新たに形成されたと推定した。
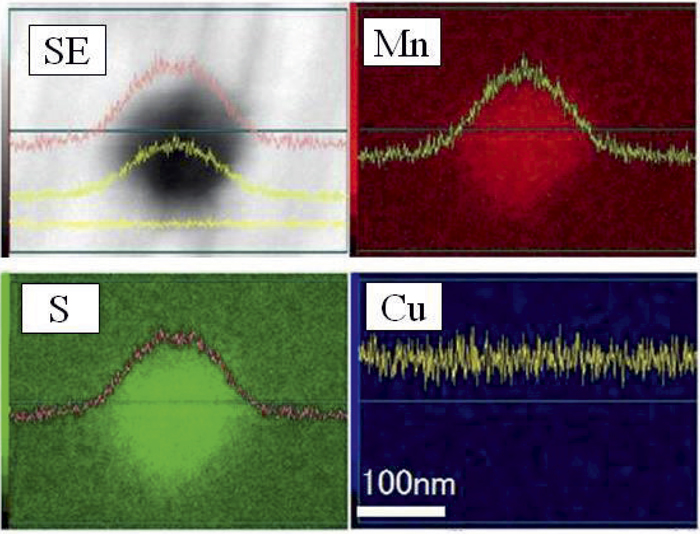
SEM-EDX mapping of MnS particle after mirror-polishing. (Online version in color.)

SEM-EDX mapping of MnS particle after SPEED etching with 4%MS electrolyte. (Online version in color.)
硫化物生成反応の発生有無には,硫化物間の溶解度積の違いが影響していると推定し,以下の式(1)のように硫化物の溶解度積14)(Ksp)の桁数比(δpKsp)を計算した(Table 3)。このδpKsp値が大きいほど,偽装硫化物が生成されやすくなると推定される。なお式(1)にはMnSとCuSの計算例を示した。
| (1) |
| No | Compound | Formula | Ksp (at 25°C) | pKsp | HgS | Ag,S | CuS | PbS | CdS | CoS | NiS | ZnS | Tl,S | FeS |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| pKsp → | –53.7 | –50.1 | –36.1 | –27.5 | –27.0 | –25.5 | –24.9 | –24.7 | –21.2 | –18.1 | ||||
| 1 | Mercury (II) sulfide (red) | HgS | 2 × 10–54 | –53.7 | 0.0 | |||||||||
| 2 | Silver (I) sulfide | Ag,S | 8 × 10–51 | –50.1 | 3.6 | 0.0 | ||||||||
| 3 | Copper (II) sulfide | CuS | 8 × 10–37 | –36.1 | 17.6 | 14.0 | 0.0 | |||||||
| 4 | Lead (II) sulfide | PbS | 3 × 10–28 | –27.5 | 26.2 | 22.6 | 8.6 | 0.0 | ||||||
| 5 | Cadmium sulfide | CdS | 1 × 10–27 | –27.0 | 26.7 | 23.1 | 9.1 | 0.5 | 0.0 | |||||
| 6 | Cobalt (II) sulfide (beta) | CoS | 3 × 10–26 | –25.5 | 28.2 | 24.6 | 10.6 | 2.0 | 1.5 | 0.0 | ||||
| 7 | Nickel (II) sulfide (beta) | NiS | 1.3 × 10–25 | –24.9 | 28.8 | 25.2 | 11.2 | 2.6 | 2.1 | 0.6 | 0.0 | |||
| 8 | Zinc sulfide (alpha) | ZnS | 2 × 10–25 | –24.7 | 29.0 | 25.4 | 11.4 | 2.8 | 2.3 | 0.8 | 0.2 | 0.0 | ||
| 9 | Thallium (I) sulfide | Tl,S | 6 × 10–22 | –21.2 | 32.5 | 28.9 | 14.9 | 6.3 | 5.8 | 4.3 | 3.7 | 3.5 | 0.0 | |
| 10 | Iron (II) sulfide | FeS | 8 × 10–19 | –18.1 | 35.6 | 32.0 | 18.0 | 9.4 | 8.9 | 7.4 | 6.8 | 6.6 | 3.1 | 0.0 |
| 11 | Manganese (III) sulfide (green) | MnS | 3 × 10–14 | –13.5 | 40.2 | 36.6 | 22.6 | 14.0 | 13.5 | 12.0 | 11.4 | 11.2 | 7.7 | 4.6 |
ここで,水溶液中25°Cにおける硫化物のKspは以下の値を用いた。
そこで,これらの推定がメタノール溶液中においても適用できるかを確認するために,Ag+とMnSの反応を検証した。Table 2 No4 4%MS+Ag20 µg/mlの条件で鉄鋼試料を電解エッチングしてSEM観察に供した。Fig.3にSE像,Mn,S,AgのEDXによる元素マッッピングを示す。AgはMnS粒子の円周端部で濃度が高まっており,MnS表面にAgが濃化していることが確認される。またMnS中央部では,Agの濃度は高まらず,MnおよびSの濃度が高いことから,MnSの表面だけがAgで置換されていると考えられる。以上の結果より,Cu2+と同様にδpKsp値が高い,Ag+とMnSの間でも容易に硫化物生成の反応が進行していると推定される。この他にもPb,Co,Ni,Znイオンでも同様に偽装硫化物が生成することが確認された。つまり,この反応は溶解度積の桁数差δpKspが少なくとも10桁以上大きくなると,鋼材1 g相当の電解時間(約2~3時間)で容易に反応が進行すると考えられる。

SEM-EDX mapping of MnS particle after SPEED etching with 4%MS electrolyte and silver standard solution (Ag 20 µg/ml). (Online version in color.)
偽装硫化物の生成反応はMnSの表層に新たに偽装硫化物が形成されるのか,それともMnSが溶出して,偽装硫化物が内部に浸潤して形成されるのかを判断するために,Fig.3で観察したMnS粒子の表層をオージェ電子分光法により1 nm間隔でArスパッタリングしながら元素分析を実施した。Fig.4横軸にArスパッタ深さ,縦軸にS,Mn,Ag,Cuの原子量比率(%)を示した。MnS表層の約1 nmでAgが最大値38%を示し,その後,ゆるやかに低下しながらも深さ100 nm程度まで浸潤していた。その間,MnはAgの代わりに,MnSの表層部で低下が見られた。Cuも表層で10%近く上昇したがAgの上昇の1/3ほどに留まった。以上の結果から,金属イオンとMnS間の硫化物偽装反応はMnが溶出し,内部にAg+やCu2+が浸潤して硫化物を作る交換反応と考えられる。

Atomic concentration analysis of the surface of MnS particle by Auger electron spectroscopy. (Online version in color.)
熱延鋼板をTable 2 No2の4%MS電解条件で処理するとFig.5の左下に示すように水平(L方向)に延伸された数µmの粗大MnSと,右上の白い枠線に500 nm以下の微細粒子が観察された。Fig.5(b)にMnを紫色,Cuを青色として元素マッピングを示した。この結果,右上の微細粒子は,ほとんどがCuxSと推定された。一方,左下の粗大MnS(紫色)の表層に青いCuxSが生成していた。

SEM-EDX mapping of MnS particle after SPEED etching with 4%MS electrolyte, (a) Secondary electron image, (b) Elemental mapping by EDX. (Blue as Cu, Violet as Mn). (Online version in color.)
そこで,この偽装硫化物生成反応における粒径と浸漬時間の関係について検討した。Table 2 No5 4%MS+Cu 20 µg/mlの電解液に供試料を10分から1000分間浸漬した後に,メタノール洗浄,風乾してFE-SEM観察に供した。観察される粒子のサイズ,EDX成分分析値を元に,横軸に粒径,縦軸にMn/(Mn+Cu)の質量含有量比率を計算し,浸漬時間10分経過材を●,浸漬時間1000分経過材を△としてFig.6にプロットした。観察結果より,浸漬時間が長いほど浸潤深さは深くなり,元々のMnSの粒径が小さいほど短い時間でMnSは容易にCuxSに変換されるのが判明した。Fig.6右下に示す,元々のMnS粒子(半径r1)の表層からCuSがr2だけ浸潤した計算モデルを元に,Mn/(Mn+Cu)の質量含有量比率を計算し,浸漬時間10分,1000分にフィットする浸潤深さr2を計算した。表層から内部に拡散する速度は一定とし,濃度勾配はつけなかった。その結果,200 nm付近ではばらつきがあるものの,少なくとも浸漬時間10分では約7 nm(実線),1000分では約35 nm(破線)相当がCuxSに変換されていると推定された。普段,鏡面研磨面をSPEEDエッチングして観察すると,多くの場合MnS表層にはCuが検出され,粒子サイズが小さくなるほどCu含有比率が高くなり,50 nmを下回るサイズになると,ほとんどCuとSだけしか検出されなくなるという結果を裏付けるものと考えられる。

Size dependence of sulfide exchange reaction between MnS and Cu2+ (Dipping time; ● 10 minutes, △ 1000 minutes). (Online version in color.)
これまでの結果から,偽装硫化物の発生を防止するにはCu2+をはじめとした,鋼材から溶出するFe以外の金属イオンもキレート剤で捕捉して無害化することが有効と考えた。Table 4にCu2+を選択的に捕獲できるキレート剤15)の例を示す。メタノールなどの有機溶媒にも可溶で,Cu2+の捕獲能力に優れたものを種々検討した中で,ポリエチレンアミン類を中心とした,トリエチレンテトラミン(TET),ペニシラミン,ペンタエチレンヘキサミン(PEH),エチレンジアミン4酢酸(EDTA)等のキレート剤にCu2+のみならず,その他のAg,Pb,Co,Ni,Znイオンなどについても優れた捕獲効果が認められることが判明した。これらのキレート剤は,Cu2+に対する選択性が高く,Nのアミン類に保持されたNの不対電子対がCu2+を選択的に取り囲む形状を作る。ゆえに,この電解液および電解法の名称としてCu2+を選択的に捕獲することができるという意味から,本論文では「CUSH法:Cu ion Selective Holding」と以下記すことにする。
| Chelating agent | Stability constant (logKML) |
|---|---|
| PEH: Pentaethylenehexamine | 26.2 |
| TEP: Tetraethylenepentamine | 23.1 |
| TET: Triethylenetetramine | 20.4 |
| EDTA: Ethylenediaminetetraacetic acid | 18.3 |
| DETA: Diethylenetriamine | 16.1 |
| EDA: Ethylenediamine | 10.7 |
| IDA: Iminodiacetic acid | 10.3 |
| NH3 | 4.2 |
Table 2のNo6(4%MS+5%TET),No7(4%MS+5%PEH),No8(4%MS+5%EDTA)のCUSH法による電解条件でSPEEDエッチングした後の,MnS粒子のMn,S,Cu元素マッピングの例をFig.7に示す。Mn,Sは粒子状の元素マップを示している。一方,Cuは,どのキレート剤を用いても明瞭なCuのEDX信号を得ることができず,偽装硫化物の生成は見られなかった。以上のことより,これらのCuイオンキレート剤は,SPEEDエッチング時に偽装硫化物生成を抑止する効果が高いことが判明した。

SEM-EDX mapping of MnS particle after SPEED etching using 4%MS electrolyte with Cu chelating; agents: (a) TET, (b) PEH and (c) EDTA. (Online version in color.)
Fig.8(a)に,従来の電解条件:Table 2 No9(4%MS 3456C),(b)に開発した電解条件:Table 2 No10(4%MS+5%TET 3456C)で得られた電解残渣のSEM観察とEDX分析の例を示す。従来法による電解残渣(a)はMnS表層部に不定形の偽装硫化物が付着している。一方,開発したCUSH法による電解残渣(b)はMnS粒子ひとつひとつの表面に不定形物が付着しておらず平滑であった。SEM-EDXによる元素分析結果より残渣(a)にはCuが37%と大量に含まれるがCUSH法で電解した残渣(b)はCuが0.5%以下であり,SPEEDエッチング時の偽装硫化物生成が防止されているのが確認できた。
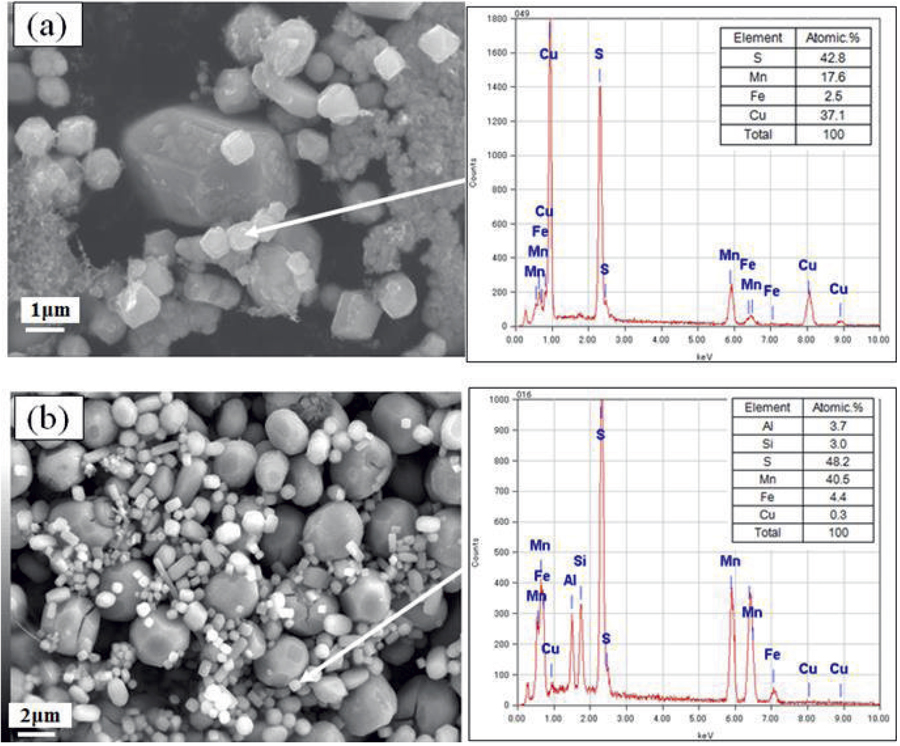
Comparison of sulfides by SEM-EDX after SPEED etching with (a) 4% MS (b) 4%MS+5%TET. (Online version in color.)
SPEEDエッチングの場合は,数10クーロンのみ電解するが,電解残渣を定量分析(鋼材約1 g相当の電解)した場合の,CUSH法の効果を調査した。その結果,大量に電解する時には偽装硫化物の生成を完全には防止できない場合があることが明らかとなった。そこで電解条件,電解液組成,鋼材成分などを検討し,偽装硫化物が発生する時には,以下の傾向があることが明らかとなった。
すなわち,
(1)電解量を増やすほど偽装硫化物が多くなる。
(2)試料の炭素含有量が増えるほど偽装硫化物が多くなる。
(3)電解中のArガスバブリングが少ないと偽装硫化物が多くなる。
実験した結果,電解液にCuイオンキレート剤を含まない場合は,電解液にArガスバブリングや撹拌の有無にかかわらず偽装硫化物発生は防止できなかった。一方,Cuイオンキレート剤を含ませた場合には,Arガスバブリングまたは撹拌を実施した場合のみに偽装硫化物の発生を防止することができた。Arガスバブリングまたは撹拌が弱い場合には偽装硫化物の発生に増減が発生して再現性が低かった。以上の結果を総合すると,電解量や炭素量が増加すると試料表面にセメンタイトが増加するため,Cuイオンキレート剤がMnS表層をカバーすることが困難となり,鋼から溶出したCu2+がMnSと反応する。この反応は非常に高速で起こるため,常にArガスバブリングを行いながらCuイオンキレート剤をMnS表層に供給させないと,偽装硫化物発生を完全に防止することができないと推定した。
最後に,最適化した電解条件での電解残渣定量結果をFig.9に示す。Table 2 No10の電解条件でArガスを600 ml/min供給した。(a),(b)は従来の4% MS系電解液で電解した場合,(c),(d)はCUSH電解液で電解した場合,得られた残渣に含まれるMn,Cuの量から換算したCombined Sの量である。従来の4% MS電解法ではCuxSが半分ほど発生する。それに対し,CUSH電解法では偽装CuxSは検出されなくなり,独立並行試験におけるCombined Sの繰り返し分析精度も改善された。

With Ar gas bubbling, comparison of combined sulfur analysis using electrolyte as follows, (a) 4% MS (n=1), (b) 4%MS (n=2), (c) 4%MS+5%TET (n=1) and (d) 4%MS+5%TET (n=2).
今回,SPEED法電解エッチングの時にMnS周囲に本来,鉄鋼中に存在していないと考えられる硫化物が生成するメカニズムについて検討するとともに,この偽装硫化物の生成を防止できる電解液および電解方法について検討して下記知見を得た。
(1)硫化物溶解度積の桁数比δpKsp値が大きいほど容易に反応する。
(2)硫化物偽装反応防止にはCuイオンキレート剤の添加が効果的である。
(3)Cuイオンキレート効果を高めるバブリングの併用が効果的である。
新電解液CUSH(Cu ion Selective Hold)を用いることにより,鋼中微粒子が本来存在する形態で観察でき,定量分析においては,硫化物の粒径や成分を正確に把握することが可能となる。
今後,同様の反応が予想されるものとしてMnSと同じ結晶構造で格子定数が極めて近いMnSe16)についても研究が必要と考えられる。