2018 年 104 巻 3 号 p. 121-127
2018 年 104 巻 3 号 p. 121-127
In recycling a lot of low grade ferrous scraps, we cannot remove tramp elements, such as copper and tin, which are inevitably dissolved in molten iron. Accordingly, the thermodynamic data between copper and alloying elements in molten iron are necessary to know the influence of copper on the property of steel. However, the available data are not enough because of the difficulty of the measurements. One of the purposes of this study is to develop a method to measure the thermodynamic data of tramp elements in iron. In this work, we have tried to measure the oxidation equilibria of copper in molten iron by using silver as an intermediate phase. By applying this method, the interaction between Cu and M(M: B, Co or Ni) in molten iron has been investigated at 1873 K.
高度循環型製鉄プロセスの構築のために,鉄源としての鉄スクラップ使用比率向上が課題となっている。鉄スクラップの利用拡大に伴って,鋼中循環性元素の濃度上昇は避けられず,鋼の性質に及ぼす循環性元素の影響が多く報告されている。不純物元素として代表的なCuは自動車のモーターや電気配線などから混入し,表面赤熱脆性や熱間加工性の低下を引き起こす1–3)。このとき,Snが微量共存するとCuの融液が発生しやすくなり,より性状の悪化が起こりやすくなる4)。このようなCuの悪影響を抑えるために,銑鉄などで希釈して利用しているのが現状である。そのため,リサイクルプロセスにおけるトランプエレメントの除去や無害化技術の確立が望まれている。一方,フェライト系ステンレス鋼では,Cuの添加によって防錆性,抗菌性,熱疲労特性が向上する。防錆性の向上は鋼中へのCuの固溶によるものであり,抗菌性,熱疲労特性の向上は時効によるε-Cu析出によるものと考えられている5)。Cuの特性は鋼中Cuの固溶限,すなわちFe中Cuの活量をコントロールすることで制御が可能であると考えられる。
Cuの分離や精錬反応への影響予測,鋼材の性質へのCuの影響予測や有効利用のためには,Fe中Cu-共存元素間の相互作用に関する熱力学データが必要である。しかしながら,一般に循環性元素の熱力学データの測定は難しく,不足しているのが現状である。本研究では,Fe中Cu-共存元素間の熱力学データの測定法として,Ag相を介した酸化によるFe中Cuの活量測定を考案し,それを用いて,1873 Kにおいて溶鉄中CuとB,Ni,Co間の相互作用係数の測定を行った。
Fig.1に本実験の原理図を示す。Fe-Ag間にCuが分配する反応は(1)式で表される。
| (1) |
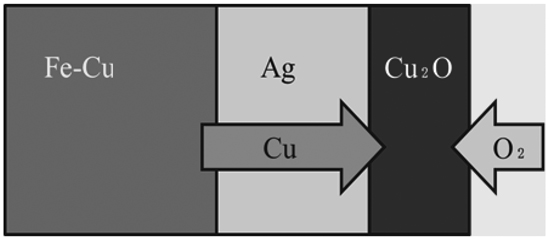
Schematic diagram of the method to oxidize Cu in molten iron via Ag phase.
Ag相中に分配したCuは(2)式によりO2で酸化されCu2O(l)になる。
| (2) |
(1),(2)式を組み合わせると,Fe中Cuの酸化を表す(3)式が得られる。
| (3) |
(3)式の標準ギブスエネルギー変化6)は(4)式で与えられる。
| (4) |
(3)式の平衡について(5),(6)式が成り立つ。
| (5) |
| (6) |
本研究では,この原理に基づいてAg相を介してFe中Cuの酸化平衡を,1873 K,PO2=1[atm]の条件において測定することを試みた。
Fe-Cu系においてFe中Cuの活量は(7)式で表される。
| (7) |
Fe-Cu-M系において,Fe-M中Cuの活量は(8)式で表される。
| (8) |
1873K,PO2=1[atm]の同一条件では,Fe-Cu系,Fe-Cu-M系のどちらにおいてもFe(-M)中Cuの活量は変化しないため,(9)式が成り立つ。
| (9) |
(7)~(9)式から(10)式が得られる。
| (10) |
(10)式から,Fe-Cu系,Fe-Cu-M系の平衡測定におけるFe中Cu濃度の差から,Fe中Cuの活量係数に及ぼすMの影響を表すγMCuが得られる。また,(11)式から,Fe中Cu-M間の相互作用母係数εMCuが求められる。
| (11) |
実験にはガス雰囲気制御ができるムライト製反応管の電気抵抗炉(外径70 mm,内径60 mm,長さ1000 mm)を用いた。実験条件をTable 1に,実験前の試料の模式図をFig.2(a)に示す。MgOるつぼ(外径18 mm,内径12 mm,高さ50 mm)の口に横5 mm,縦2-3 mmの長方形の切り欠きを作り,所定の組成となるよう秤量したFe,Cu,Agを入れた(No.1-5)。さらにNo.6以降の実験では,添加元素B(No.6,7),Co(No.8-10),Ni(No.11-15)を入れた。それを逆さまにしてMgOるつぼ(外径35 mm,内径30 mm,高さ50 mm)に入れ,残りのAgを入れた。試料装入後のMgOるつぼをMgOホルダー(外径51 mm,内径44 mm,高さ100 mm)の中に入れ,実験試料を常温の電気抵抗炉の中に装入した。Ar雰囲気で1873 Kまで昇温し,1 h保持した。実験中試料が溶融したときの試料の模式図をFig.1(b)に示す。その後,雰囲気をO2に切り替え,所定の時間保持した後,炉内から試料を取り出して水冷し,Fe,Ag中Cuならびに添加元素(B,CoまたはNi)濃度をICP発光分光分析法により分析した。なお,本実験において反応の進行とともにAg–気相界面にCu2O(l)の生成が観察される。Cu2O(l)がAg表面を完全に覆うと酸化反応の進行を妨げることがわかっている7)ので,あらかじめ予備実験によりおよその平衡値を把握し,初期条件においてその値よりも少し高いCu濃度を初期値として設定して実験を行った。
| No. | M | Initial mass [g] | O2 blow-in time [min] | |||
|---|---|---|---|---|---|---|
| Fe | Cu | Ag | M | |||
| 1 | – | 10 | 3.6 | 30 | – | 0 |
| 2 | 30 | |||||
| 3 | 40 | |||||
| 4 | 50 | |||||
| 5 | 60 | |||||
| 6 | B | 10 | 3.6 | 30 | 0.104 | 60 |
| 7 | 0.110 | 60 | ||||
| 8 | Co | 0.011 | 45 | |||
| 9 | 0.060 | 60 | ||||
| 10 | 0.103 | 60 | ||||
| 11 | Ni | 0.026 | 60 | |||
| 12 | 0.043 | 60 | ||||
| 13 | 0.054 | 60 | ||||
| 14 | 0.079 | 60 | ||||
| 15 | 0.080 | 60 | ||||

Schematic cross section of the sample arrangement in Fe-Ag-Cu-M system at 1873 K. (a) before melting, (b) during experiment.
実験結果をTable 2に示す。また,Fig.3にFe,Ag各相中Cu濃度の時間変化を示す。Ag中Cuに関しては,30,50,60 minにおいて一定の値を示しており,またFe中Cuに関しては40 min以降でほぼ一定の濃度となっていることから,本実験結果は30~40 min以降でほぼ定常状態に達していると考えられる。
| No. | M | Cu content [mass%] | M content [mass%] | LCu(mass)(Ag/Fe) | LM(mass)(Ag/Fe) | ||
|---|---|---|---|---|---|---|---|
| in Fe | in Ag | in Fe | in Ag | ||||
| 1 | – | 3.71 | 9.34 | – | – | 2.52 | – |
| 2 | 3.68 | 8.89 | 2.42 | ||||
| 3 | 3.49 | 9.31 | 2.67 | ||||
| 4 | 3.51 | 8.99 | 2.56 | ||||
| 5 | 3.39 | 8.96 | 2.64 | ||||
| 6 | B | 2.90 | 8.95 | 0.51 | < 0.0001 | 3.09 | – |
| 7 | 2.96 | 9.43 | 0.52 | < 0.0001 | 3.19 | ||
| 8 | Co | 3.43 | 7.60 | 0.17 | 0.0087 | 2.22 | 0.051 |
| 9 | 3.38 | 8.38 | 1.37 | 0.0147 | 2.48 | 0.011 | |
| 10 | 3.39 | 10.07 | 1.83 | 0.0131 | 2.97 | 0.007 | |
| 11 | Ni | 3.53 | 8.30 | 0.36 | 0.0077 | 2.35 | 0.021 |
| 12 | 3.98 | 9.33 | 0.38 | 0.0061 | 2.34 | 0.016 | |
| 13 | 3.51 | 9.55 | 0.66 | 0.0178 | 2.72 | 0.027 | |
| 14 | 3.42 | 9.25 | 1.03 | 0.0360 | 2.23 | 0.035 | |
| 15 | 3.42 | 9.98 | 2.68 | 0.0383 | 2.40 | 0.014 | |
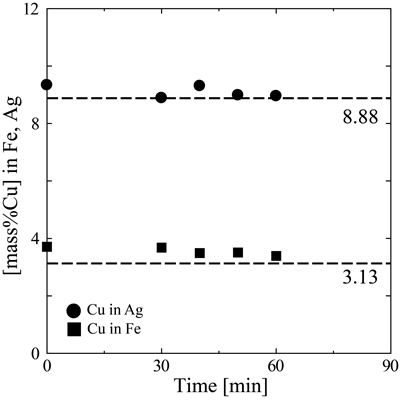
The variation of Cu content of Fe and Ag with time at 1873 K.
文献値から,Fe,Ag各相中Cuの酸化平衡濃度を計算した。(2)または(3)式で表されるCuの酸化反応の平衡から,1873 K,PO2=1[atm]においてaCu=0.237と計算される。Fe中Cuの活量係数γCu(in Fe)=8.588)より,Fe中Cuの酸化平衡濃度は[mass%Cu]=3.13と計算される。同様に,Ag中Cuの活量係数γCu(in Ag)=1.679)より,Ag中Cuの酸化平衡濃度は[mass%Cu]=8.88と計算される。Fig.3に,これらの計算で得たFe,Ag中Cuの酸化平衡濃度を合わせて示す。Ag中Cu濃度は計算上の酸化平衡濃度にほぼ等しく,またFe中Cu濃度は平衡濃度より少し高いが近い値が得られ,本手法によりCuの酸化平衡の測定が可能であることがわかった。
4・2 Ag相を介したFe中Cuの酸化反応シミュレーションFig.2(b)にFe相中CuがAg-気相界面で酸化物になるまでの移動過程を示す。Ag相中においてCuよりOの拡散係数が大きいため,Cuの酸化反応はAg-気相界面ではなくAg相中で起きていると考えられる。そこで,Ag相を20 mmの一次元経路と仮定し,Ag相中Fe,Cu,Oの拡散と,Fe,Cuの酸化反応に関するシミュレーションを行った。Ag相におけるCu,Oの濃度変化の模式図をFig.4に示す。
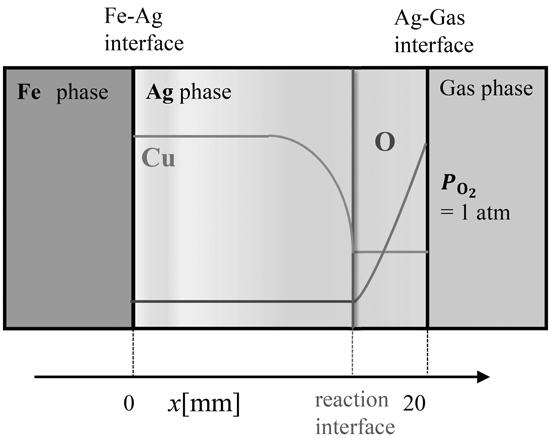
Profile of Cu and O contents of Ag phase.
以下に本モデルにおける仮定を示す。
(a)定常状態に達するまでの律速過程は,Ag相におけるFe,Cu,Oの物質移動であるとする。
(b)Ag相中の拡散は,Fickの第2法則に従う。
| (12) |
(c)Ag中各成分の拡散係数をTable 3に示す。文献値10)のD0(in Ag)をもとに,(13)式を用いて1873 Kにおける値を外挿により求めた。
| (13) |
| M | D0×10–7 [m2/s] | E / [kJ/mol] | Range [K] | Di×10–9 [m2/s] |
|---|---|---|---|---|
| Fe | 1.16 (±0.21) | 40.0 (±2.1) | 1248-1673 | 8.33 |
| Cu | 1.22 (±0.41) | 41.8 (±3.3) | 1282-1483 | 8.89 |
| O | 2.8 (±1.0) | 35 (+5) | 1273-1473 | 29.6 |
(d)Fe,Cuの酸化は(14),(15)式に従い,生成した酸化物は速やかにAg相外に排出されるものとする。
| (14) |
| (15) |
(e)気相はPO2=1 atmとする。
(f)初期xCu(in Ag)は,本実験の初期条件においてCuがFe-Ag間に平衡分配したと仮定し,xCu(in Ag)=0.149とする。
(g)初期xFe(in Ag)はAg中Feの飽和溶解度(=1.45×10−3)とする。初期xO(in Ag)はAg-気相界面においてのみ飽和溶解度(=0.0101)とし,Ag相中は0とする。Ag中Oの飽和溶解度は,Ag-O系状態図11)から求めた。
(h)境界条件として,Fe-Ag相界面におけるFe,Cu濃度,Ag-気相界面におけるO濃度は一定とする。
計算に関しては,各タイムステップにおいてまず各成分の拡散について計算を行い,次に(14),(15)式に基づいて各成分の反応量について計算を行った。拡散に関する計算は(12)式を変形して(16)式の差分方程式を用い,陽解法で計算を行った。この時,dt=0.1,dx=0.0001に設定した。
| (16) |
Fig.5に,Fe-Ag相界面におけるxCu(in Ag)を0.149に固定し,時間を0,10,50,150 minと変化させた時の計算結果を示す。なお,150 min以降は150 minと同じ結果となったため,定常状態に達していると考えられる。反応界面(Ag中のFe,Cu,Oが反応して平衡濃度に達している位置)が時間の経過に伴ってAg-気相界面からFe-Ag相界面に近づくのがわかる。今回の計算では,反応界面がFe-Ag界面から約2.3 mmの位置で定常状態に達するという結果が得られた。Fig.6に,時間を150 minに固定し,Fe-Ag相界面におけるxCu(in Ag)を0.149,0.146,0.143,0.142と変化させた時の計算結果を示す。Fe-Ag相界面におけるxCu(in Ag)が低下するにつれて,反応界面がさらにFe-Ag相界面に近付くのがわかる。また,Fe-Ag相界面におけるxCu(in Ag)が平衡濃度に達したとしても,Ag中Feの拡散によってOの拡散が止められ,OがFe-Ag相界面に到達することはないという結果が得られた。今回の計算では,反応界面がFe-Ag相界面から約0.9 mmの位置で定常状態に達するという結果が得られた。これらを合わせて考えると,時間の経過に伴ってFe-Ag相界面におけるxCu(in Ag)が低下しながら,最終的にFig.6のxCu,Fe-Ag interface=0.142の定常状態に達するまで反応が進む。すなわち,Ag相を介してFe中Cuを酸化させる本実験手法により,OがFe相に達することなくFe中Cuの酸化反応が進み,Fe中Cuの酸化平衡濃度が得られると考えられる。

The variation of the mole fraction of Fe, Cu and O in Ag with time.

The variation of the mole fraction of Fe, Cu and O in Ag with xCu at Fe-Ag interface.
実験結果をTable 2に示す。B添加実験において,Ag中B濃度は,ICP分析の検出下限値(0.0001[mass%])以下であった。Fe中Cu濃度は,Bの添加によって低下し,Co,Niの添加によってあまり変化しない結果が得られた。
(11)式に基づいて,縦軸にlnγMCu(in Fe),横軸にx'M(in Fe-M)をとり,実験結果をプロットした。それらをFig.7~9に示す。図中の直線は,最小二乗法を用いて原点を通るように描いた近似直線である。直線の傾きがεMCu(in Fe)に相当する。Fig.7から,Fe中Cuの活量係数に及ぼすBの影響を表すγMCu(in Fe)は1より大きく,Fe中CuとBは反発すると考えられる。一方,Fig.8,9から,Fe中Cuの活量係数に及ぼすCo,Niの影響は小さく,相互作用係数は小さな負の値となることがわかる。計算により得られたεMCu(in Fe)の値ならびに(17)式を用いて相互作用助係数eMCu(in Fe)に換算した値をTable 4に示す。
| (17) |

The activity coefficient of Cu on B in Fe at 1873 K.
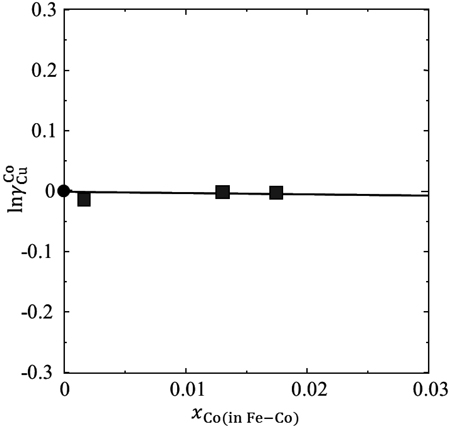
The activity coefficient of Cu on Co in Fe at 1873 K.

The activity coefficient of Cu on Ni in Fe at 1873 K.
| M | εMCu (in Fe,1873 K) | eMCu (in Fe,1873 K) |
|---|---|---|
| B | 6.35 (±0.50) | 0.125 (±0.011) |
| Co | – 0.21 (±0.46) | – 0.0006 (±0.0019) |
| Ni | – 0.36 (±1.17) | – 0.0013 (±0.0048) |
過去にFe-Cu-B系の2液相分離の相平衡(Fe-rich相中Cu濃度5~17mass%)からeBCu(in Fe)=0.18(±0.01)12)が報告されている。本研究で得られた値0.125(±0.011)は少し小さいが,本研究のFe中Cu濃度は約3mass%であり,活量係数の濃度依存性を考慮すると概ね妥当な値であると考えられる。
4・4 Fe中Cu-M間の相互作用係数再近接原子間の結合を考慮するとFe-Cu-M中Mの活量係数は次式で表される13)。
| (18) |
ここで正則溶体モデルでは,
が成り立ち,またxM≪1とするとxFe+xCu=1より,
| (19) |
ここで,lnγFe(in Fe-Cu)≈0より,
| (20) |
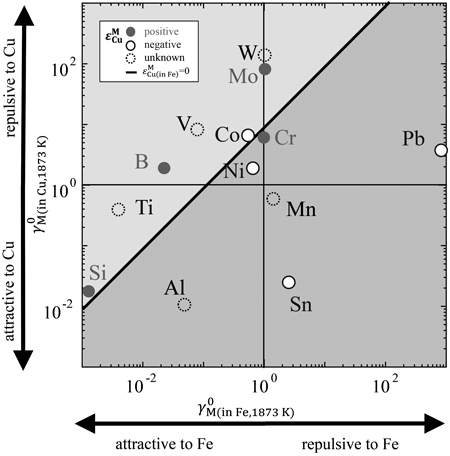
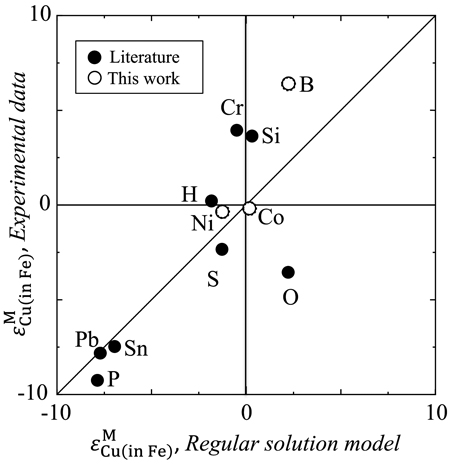
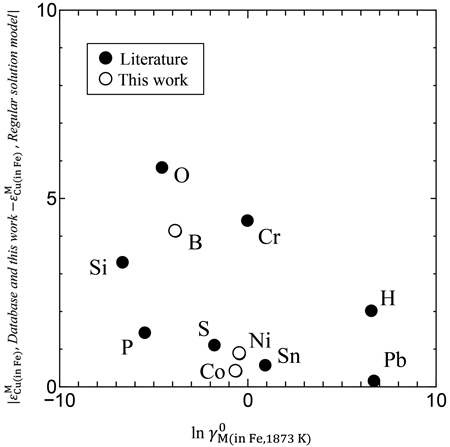
(20)式を用いて,Fe-M,Cu-M各2元系におけるMの活量係数から,Fe中Cu-M間の相互作用係数の推定を行い,実測値との差について考察した。各元素Mについて,γ0M(in Fe)は文献値8,14),γ0M(in Cu)は文献値15)と熱力学データならびに状態図16–18)から推算により求めた。それらの値をTable 5に示す。横軸にlnγ0M(in Fe),縦軸にlnγ0M(in Cu)をとり,Fe中Cu-M間の相互作用係数の正負で分類してFig.10に示す。この図において,lnγ0M(in Fe,Cu)>1はFe,CuとMが互いに反発し,lnγ0M(in Fe,Cu)<1はFe,CuとMが互いに引き合うことを意味している。(20)式にγ0Cu(in Fe)=8.58を代入し,εMCu(in Fe)=0となる境界線をFig.10に実線で示す。境界線の上の領域がεMCu(in Fe)>0,下の領域がεMCu(in Fe)<0表している。文献値のCrと本実験で得られたCoに関しては正負が逆転しているが,他の元素に関してはよく一致している。本実験で得られたCoの結果は0に近い負の値であったため,Coの値は境界線上に近いと考えられる。相互作用係数の実測値と推算値の比較をFig.11に示す。図中にy=xで表した実線から離れているほど,実測値と推算値の差が大きいことを表している。Fig.11より,B,O,Si,Crに関して差が大きいことがわかる。この要因は正則溶体からの偏倚が大きいためであると考え,実測値と推算値の差を母相であるFe中Mの活量係数に対してプロットし,Fig.12に示す。B,O,SiはFe中の活量係数が小さいため,Feとの親和性が強く,正則溶体からの偏倚が大きいと考えられる。しかし,Crに関してはFe中Crの活量係数は17)であるため,正則溶体からの偏倚は小さいと考えられるが,実測値とモデルによる推算値に有意な差がみられる。以上から,正則溶体モデルにより推算される溶鉄中Cuに関する相互作用係数は,多くの元素に関して正負の傾向は一致するが,値は大きく異なるものがある。そのため,Fe中Cuの正確な活量制御のためには,実験による熱力学データの測定が必要である。
| M | γ0M (in Fe) | γ0M (in Cu) | ||
|---|---|---|---|---|
| H | 727 | Steelmaking Data Sourcebook8) | 1150 | Physical Chemistry of High Temperature Technology15) |
| O | 0.011 | 0.96 | ||
| P | 0.0043 | 0.00002 | ||
| S | 0.17 | 0.47 | ||
| Al | 0.049 | 0.0105 | Selected Values of Thermodynamic Properties of Binary Alloys16) | |
| Si | 0.0013 | 0.0175 | ||
| Mn | 1.43 | 0.58 | ||
| Ni | 0.66 | 1.87 | ||
| Sn | 2.58 | 0.0245 | ||
| Pb | 837 | 3.7 | ||
| B | 0.022 | 2.03 | Estimated from Binary Alloy Phase Diagrams17) | |
| Mo | 1 | 91.3 | ||
| W | 1 | 138 | ||
| Ti | 0.004 | 0.39 | Estimated from Landolt-Börnstein, Thermodynamic Data of Binary Alloys18) | |
| V | 0.08 | 8.13 | ||
| Cr | 1 | 6.01 | ||
| Co | 0.55 | 6.51 | ||
Relationship among εMCu(in Fe), γ0M(in Fe) and γ0M(in Cu) at 1873 K.
Relationship between the measured εMCu(in Fe) values and those derived from a regular solution model.
The difference between measured εMCu(in Fe) values and those derived from a regular solution model plotted against ln γ0M(in Fe,1873K).
Ag相を介した酸化によるFe中Cuの活量の測定法の確立と,それを用いたFe中Cu-M間の相互作用係数の測定を目的として実験を行い,以下の知見を得た。
(1)Fe-Cu合金をAg相を介して酸化することにより,Fe中Cuの活量測定が可能である。
(2)1873 KにおいてAg相を介した酸化によるFe中Cu-M間の相互作用係数の測定を行い,Fe中Cu-B,Co,Ni間の相互作用係数として以下の値を得た。
(3)正則溶体モデルを用いてFe中Cu-M間の相互作用係数の推算を行った。多くの元素に関して正負の傾向は一致したが,値は大きく異なるものがある。そのため,Fe中Cuの正確な活量制御のためには,実験による熱力学データの測定が必要である。
本研究は,一般社団法人日本鉄鋼協会「第24回鉄鋼研究振興助成」によって行われました。ここに感謝の意を表します。