2019 年 105 巻 1 号 p. 55-63
2019 年 105 巻 1 号 p. 55-63
To elucidate the effects of electrolysis conditions on the formation of electrodeposited invar Fe-Ni alloys with low thermal expansion, Fe-Ni electrodeposition was performed at 10-5000 A·m–2 and 5×105 C·m–2 in agitated solution containing NiSO4, NiCl2, H3BO3, FeSO4, C7H4NNaO3S and C3H4O4 at 40-60°C. Ni content in deposits significantly decreased in the low current density region with increasing current density, reached a minimum, and then increased due to reaching at diffusion limiting current density for Fe deposition as the current density increased further. With increasing the concentration of FeSO4 in solution, Ni content in deposits decreased at lower current density region, reached a constant at lower current density, and then began to increase at higher current density. As a result, the current density range where Ni content in deposits was minimum and constant became wider with higher concentration of FeSO4. With decreasing pH in solution, since the partial polarization curve for H2 evolution and total polarization curve sifted to higher current density region, Ni content in deposits-current density curve shifted to higher current density region. With stirring the solution, Ni content in deposits reached a minimum as the current density increased, and then began to increase at higher current density than without stirring due to increase in diffusion limiting current density for Fe deposition. The change of the composition in deposits by electrolysis condition can be explained by the changes of the total polarization curve for Fe-Ni alloy deposition and the partial polarization curves for Fe and Ni depositions and H2 evolution.
Fe-Ni合金はその合金組成により熱膨張係数が変化し,Ni含有率が36 mass%となる時,熱膨張係数が最小となり,インバー合金と呼ばれている1,2)。インバー合金は,低熱膨張材料として,半導体リードフレームや光ファイバーのパッケージ部品等の電子通信機器分野を中心に広く利用されている3)。インバー合金は,現状,溶解鋳造,圧延,機械加工などの加工プロセスにより形成されているが,これらの従来の製造プロセスでは最終製品の形状および寸法精度に限界がある。そこで,このインバー合金を電析法で製造することができれば,成膜可能な部品形状の自由度が高くなり,製造コストも低下する。また,電析法とフォトリソグラフィーとを組み合わせた微細加工法では,従来技術では困難な微細,高アスペクト比,高寸法精度の形状を有する製品を製造することが出来る4)。
一方,Fe-Ni合金電析は,電気化学的に卑なFeが貴なNiより優先析出する変則型共析という特異的な挙動を示す5–18)。Fe-Ni合金の変則型共析機構については,卑なFeの水酸化物の優先生成およびその吸着による貴なNiの電析抑制モデル5),FeOH+,NiOH+の解離定数の差に基づく変則性出現モデル6)等が提案されている。Fe-Ni合金の熱膨張係数は,その組成への依存性が大きいため,Ni含有率が36 mass%となる合金組成の制御が必須である19–22)。このため,Fe-Ni合金の合金組成に及ぼす電解条件の影響を明らかにすることは重要であると考えられる。そこで,本研究では,電析の基本因子である溶液の組成,pH,温度,撹拌を変化させ,電析合金の組成に及ぼすそれら電解条件の影響を調査した。電解条件による電析合金の組成,電流効率の変化を,Fe-Ni合金電析における全分極曲線,Fe,Ni析出およびH2発生の部分分極曲線の変化より説明することを試みた。
Table 1に電解液組成および電解条件を示す。電解液は市販の特級試薬を用い,NiSO4・6H2O 0.95 mol·dm−3,NiCl2・6H2O 0.17 mol·dm−3,H3BO3 0.49 mol·dm−3,FeSO4・7H2O 0.296~0.507 mol·dm−3(標準条件0.394 mol・dm−3),C7H4NNaO3S 0.008 mol·dm−3,C3H4O4 0.05 mol·dm−3を純水に溶解させて作製した。pHは硫酸および水酸化ナトリウムにより1.5,2.4,3.0(標準条件2.4)に調整した。
| NiSO4·6H2O (mol·dm–3) 0.95 | Current density (A·m–2) 10 ~ 5000 |
| NiCl2·6H2O (mol·dm–3) 0.17 | Temperature (°C) 40, 50, 60 |
| H3BO3 (mol·dm–3) 0.49 | Amount of charge (C·m–2) 105 |
| FeSO4·7H2O (mol·dm–3) 0.296 | pH 1.5, 2.4, 3.0 |
| ~ 0.507 | Cathode Brass (1×2 cm2) |
| Saccharin sodium (mol·dm–3) 0.008 | Anode Pt (1×2 cm2) |
| Malonic acid (mol·dm–3) 0.05 | Stirrer 250 rpm |
電析は,定電流電解法により電流密度10~5000 A·m−2,通電量105 C·m−2,浴温40~60°C(標準条件:50°C)において棒形撹拌子(長さ39 mm)を用いマグネティックスターラー250 rpmの撹拌下で行なった。なお,一部の実験においては,撹拌の影響を調査するため,無撹拌下で電析を行なった。陰極には黄銅板(1×2 cm2),陽極にはPt板(1×2 cm2)を用いた。電解時,陽極反応によりFe2+が酸化されFe3+が形成されるため,電解槽には陽極室と陰極室をガラスフィルターで隔離した密閉型のH型セルを用いた。セルの液量は,陰極室0.45 dm−3,陽極室0.05 dm−3である。得られた電析物は硝酸で溶解し,ICP発光分光分析法によりFe,Niを定量し,電析合金組成,Fe,Ni電析の電流効率を求めた。Fe,Ni,H2の部分電流密度は,全電流密度にそれぞれの電流効率(%)/100を乗じて算出した。水素発生の電流効率は,100からFe,Niの電流効率(%)を差し引いて求めた。分極曲線を測定する際,参照電極としてAg/AgCl電極(飽和KCl,0.199 V vs. NHE,25°C)を使用したが,電位は標準水素電極基準に換算して表示した。
Fig.1にFeSO4濃度の異なる溶液において,種々の電流密度において電析させたFe-Ni合金のNi含有率を示す。図中の破線で示すCRL of Niは,Niについてその液組成と合金組成が等しい場合を示す組成参照線(Composition reference line)である。合金のNi含有率がこの線の上部に位置していれば,電気化学的に貴なNiが優先析出する正常型共析であり,下部に位置していれば卑なFeが優先析出する変則型共析となる。何れのFeSO4濃度の溶液においても,10 A·m−2近傍の低電流密度域では,電析合金中のNi含有率は,CRLの上部に位置しており正常型共析となっているが,電流密度の増加に伴いNi含有率は大きく低下し,変則型共析の領域に移行した。Ni含有率は,200~500 A·m−2において最低となり,それ以上の電流密度になると増加した。溶液中のFeSO4濃度の違いに着目すると,電析合金中のNi含有率−電流密度曲線は,FeSO4濃度が高くなると,10~100 A·m−2の低電流密度域では,低電流密度側に移行するのに対して,1000 A·m−2以上の高電流密度域では高電流密度側に移行した。また,FeSO4濃度が高くなると,200~500 A·m−2の電流密度域で,Ni含有率の変化が小さくなる領域が見られた。

Ni content in Fe-Ni alloys deposited at various current densities from the solutions containing FeSO4 of different concentration. [pH 2.4, 50°C, 250 rpm, 10-5000 A·m–2]
Fig.2にFeSO4濃度の異なる溶液において,種々の電流密度において電析させたFe-Ni合金の電流効率を示す。何れのFeSO4濃度の溶液においても,合金電析の電流効率は,電流密度が高くなる程増加し,2000 A·m−2で最大となり,それ以上の電流密度では若干低下した。1000 A·m−2以下の領域では,電流効率は,FeSO4濃度の高い溶液からの方が高くなった。なお,FeSO4濃度0.507 mol・dm−3の溶液では,200 A·m−2において,電流効率が一旦低下した。この条件下では,Fig.1に示すように電析合金中のNi含有率が最小値となっていた。

Current efficiency for Fe-Ni alloy deposition at various current densities from the solutions containing FeSO4 of different concentration. [pH 2.4, 50°C, 250 rpm, 10-5000 A·m–2]
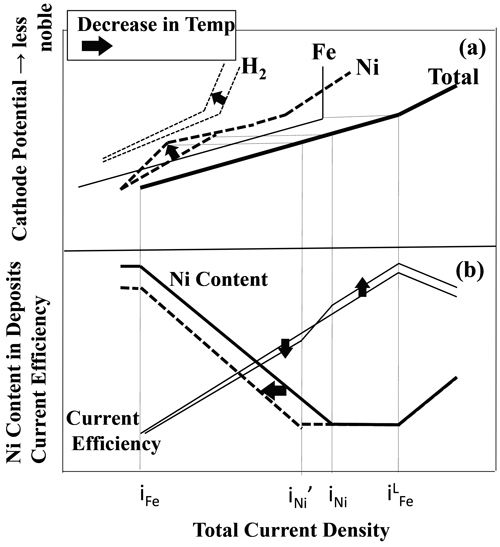
Figs.1,2に示すFe-Ni電析合金の組成,電流効率と電流密度の関係よりFe-Ni合金電析の全分極曲線,Fe,Ni析出,H2発生の部分分極曲線の形状を推察した。Fig.3にFe-Ni合金電析の分極曲線(a),Fe-Ni電析合金の組成,電流効率と電流密度の関係(b)の模式図を示す。電析合金のNi含有率の変化の観点から3つの領域が存在する。全電流密度がiFe以下の領域では,電気化学的に貴なNiが卑なFeより優先析出するため,電析合金中のNi含有率が高い。しかし,全電流密度がiFe以上となりFe析出の部分分極曲線が立ち上がると,Fe析出によりNi析出が抑制され,Ni析出の部分分極曲線の傾斜は,Fe析出のそれに比べ緩やかとなる。そのため,全電流密度がiFe以上のIの領域では,全電流密度が高くなるほど,Ni析出が強く抑制されるようになり,電析合金のNi含有率が低下する。全電流密度がiFe以上の領域で,H2発生の部分分極曲線の傾斜がFe,Ni析出のそれに比べて緩やかであれば,合金電析の電流効率は,電流密度が高くなるほど増加する。全電流密度がiNi以上でNi析出の部分分極曲線の傾斜がFe析出のそれと同程度になるIIの領域では,電析合金のNi含有率はほぼ一定となる。全電流密度がiLFe以上となるIIIの領域では,Fe析出のみがFe2+の拡散律速となりNi析出はまだ拡散限界電流密度に到達していないため,電流密度の増加に伴い,電析合金のNi含有率は増加する。更に電流密度が増加して,Ni析出もNi2+の拡散律速となると電析合金のNi含有率は,組成参照線まで増加して一定となる。しかし,本研究の電析条件においては,Fig.1に示すように,高電流密度域で電析合金のNi含有率は電流密度の増加に伴い高くなっているが,組成参照線までは到達していないため,Ni析出はまだ拡散限界電流密度なっていないと考えられる。一方,H2発生は,H+イオンの拡散限界になっていると考えられるが,より卑な電位では水の電気分解によってH2が発生するため,iLFe以上の電流密度では,合金電析の電流効率は,電流密度の増加に伴い低下する。
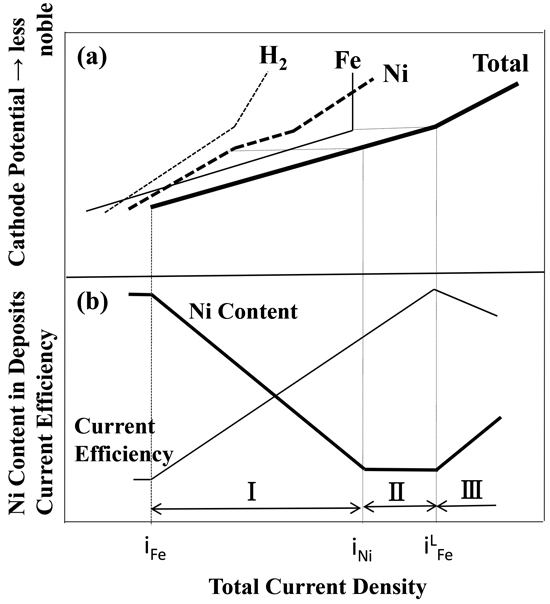
Schematic diagram of correspondence of current density-alloy composition and current density-current efficiency curves (b) to the polarization curves for Fe-Ni alloy deposition (a).
Fig.4にFeSO4濃度0.507 mol·dm−3におけるFe-Ni合金電析の全分極曲線,Fe,Ni析出,H2発生の部分分極曲線を示す。−0.45~−0.7 Vの領域において,Ni析出の部分分極曲線の立ち上がりは,Fe析出のそれに比べて緩やかである。しかし,Ni析出の部分電流密度は,−0.7 V付近から−0.77 Vの領域において急増した。次に,Fe析出は,−0.77 V近傍でFe2+の拡散律速に近づいているが,Ni析出は,−0.77 V~−1.23 Vの領域で増加を続けており,Ni2+の拡散限界には到達していない。実際,Fig.1に示すように,高電流密度域で電析合金のNi含有率は電流密度の増加に伴い高くなっているが,組成参照線までは到達していないため,Ni2+の拡散限界は,全電流密度が5000 A·m−2より高い領域にあると予想される。以上述べたように,Fe析出の方がNi析出よりも卑な電位より拡散限界電流密度に到達している。また,H2発生の部分分極曲線は,Fe,Ni析出のそれに比べて,傾きが小さかった。以上の分極曲線の特徴は,Fig.3(a)に示すFe-Ni合金電析の全分極曲線,Fe,Ni析出,H2発生の部分分極曲線の模式図と一致するものであった。
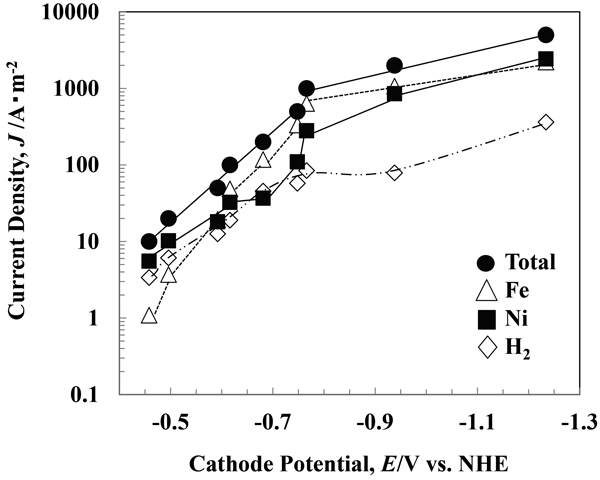
Total and partial polarization curves for Fe-Ni alloy deposition. [FeSO4 0.507 M, pH 2.4, 50°C, 250 rpm, 10-5000 A·m–2]
鉄族金属(Fe,Co,Ni)は元来その平衡電位からは電析を開始せず,析出過電圧を必要とすることがよく知られている23–28)。鉄族金属の析出開始に要する最小過電圧は,鉄族金属イオンの多段階還元における律速段階による。下記に示す一連の反応が鉄族金属の析出過程として提案されている15,16)。反応式におけるMは鉄族金属を,添字のadは吸着状態を表す。
| (1) |
| (2) |
| (3) |
上式により鉄族金属の電析は,吸着中間体MOHadを経由して進行し,式(2)の反応が律速となる。これは,吸着中間体MOHadの吸着サイトが陰極面で制限されていることを意味している。FeOH+,NiOH+の解離定数6)はそれぞれ5.78×10−8,4.50×10−5であり,電解時の陰極層でのFeOH+の濃度はNiOH+の濃度より1000倍程度高い。このため,Fe-Ni合金電析においてはNiOHadの吸着サイトがFeOHadによって奪われることになる。したがって,Fe-Ni合金電析では上記式(2)で示されるNiOH+の還元はNi単独浴からの電析の場合に比べ大きく抑制される。このため,Feとの共析時においてのみNi電析の抑制が生じ,電析挙動は変則型となる。Fig.4に示すように,Ni析出の部分分極曲線の立ち上がりが,Fe析出のそれに比べて緩やかとなるのは,NiOH+の還元がFeOHadにより抑制されるためと考えられる。一方,Niの析出速度が,−0.7 V付近から−0.77 Vの領域において急増したのは(Fig.4),Fe2+の還元がFe2+の拡散律速に近づき,且つ,FeOHadからのFeへの還元速度が増加することにより,FeOHadの被覆率が低下し,FeOHadによって奪われていたNiOHadの吸着サイトが解放されるためと考えられる。また,Fig.2の200 A·m−2において,電流効率が一旦低下したのは,FeOHadによるNi析出の抑制効果が大きくなったためと考えられる。
Fig.5にFeSO4濃度の異なる溶液からのFe-Ni合金電析におけるFe,Ni析出,H2発生の部分分極曲線を示す。Fe析出の部分分極曲線は,100 A·m−2以下の部分電流密度では,FeSO4濃度の影響がほとんど見られず,Fe析出の拡散限界に近づく電位が,FeSO4濃度が高くなると−0.7 Vから−0.8 Vへとより卑となった。すなわち,FeSO4濃度が高くなるとFe析出は拡散限界になり難くなった。一方,Niの析出は,10~100 A·m−2の低い部分電流密度の領域において,FeSO4濃度が高くなるとより分極した。すなわち,低電流密度の領域において,FeSO4濃度が高くなるとNi析出はより抑制された。また,Niの析出速度は,FeSO4濃度0.296,0.507 mol·dm−3において,それぞれ,−0.77~0.88 V,−0.7~−0.77 Vの領域において急増した。H2発生においても,Ni析出と同様に,FeSO4濃度が高くなるとより分極しており,H2発生はより抑制されることが分かる。H2には先述した鉄族金属と同様に,その平衡電位から発生しないという属性があり,これはH2発生に遅い素過程が存在するためである23,29)。H2発生を律速している素過程は吸着中間体Hadを経由したものであり,この過程が遅いということはHadの吸着サイト(水素発生の活性点)が制限されていることを意味している。従って,Hadの吸着サイトに優先吸着してその数を減じる異物質(析出抑制剤)により水素発生電位は分極する。本研究においては,FeOHadが水素発生の抑制剤として作用し,FeSO4濃度が高くなる程,抑制効果が強くなると考えられる。Fig.2に示すようにFe-Ni合金電析の電流効率が1000 A·m−2以下の領域で,FeSO4濃度の高い溶液からの方が高くなったのは,FeSO4濃度が高くなる程,水素発生の抑制効果が強くなるためと考えられる。

Partial polarization curves for Fe (a), Ni deposition (b) and H2 evolution (c) from the Fe-Ni alloy solutions containing FeSO4 of different concentration. [pH 2.4, 50°C, 250 rpm, 10-5000 A·m–2]
Fe-Ni電析合金の組成,電流効率と電流密度の関係に及ぼすFeSO4濃度の影響をFe-Ni合金電析の全分極曲線,Fe,Ni析出,H2発生の部分分極曲線の形状より考察した。Fig.6に液中のFeSO4濃度を変化させた際のFe-Ni合金電析の分極曲線(a),Fe-Ni電析合金の組成と電流密度の関係(b)の模式図を示す。iFe~iNiの低電流密度域では,FeSO4濃度が高くなるとNi析出がより抑制されるために,Ni含有率−電流密度曲線は,低電流密度側に移行する。一方,Fe析出がFe2+の拡散限界となる全電流密度iLFeは,FeSO4濃度が高くなるとiLFe’に増加する。このため,iLFe以上の高電流密度域でのNi含有率−電流密度曲線は,高電流密度側に移行する。すなわち,電流密度の増加に伴い,Ni含有率が増加し始める電流密度は,高くなる。以上の結果より,電析合金のNi含有率がほぼ一定となるIIの領域は,FeSO4濃度が高くなると広くなることが分かった。このIIの領域で,Ni含有率が36 mass%となるように電析条件を設定すれば,より広い電流密度の範囲で,安定したインバー合金を製造できると考えられる。一方,H2発生の部分分極曲線は,FeSO4濃度が高くなるとより分極するため,Fe-Ni合金電析の電流効率は,FeSO4濃度の高い溶液からの方が高くなる。

Schematic diagram of the changes in the polarization curves for Fe-Ni alloy deposition (a) and current density-alloy composition curves (b) with increase in Fe2+ ions concentration.
Fig.7にpHの異なる溶液において,種々の電流密度において電析させたFe-Ni合金のNi含有率を示す。なお,以下の実験においては,電析合金のNi含有率がほぼ一定となるIIの領域およびその周辺に着目するため,電流密度は100~1000 A·m−2に設定した。何れのpHの溶液においても,低電流密度の領域においては,電流密度が高くなる程,Fe-Ni合金のNi含有率は低下した。100~200 A·m−2の低電流密度で比較すると,pHが高くなる程,Ni含有率は低下した。pH3の溶液では,Ni含有率は200 A·m−2で最低となり,それ以上の電流密度では,Ni含有率は増加するのに対して,pH1.5の溶液では,700~1000 A·m−2でNi含有率は一定となり,Ni含有率の増加は見られなかった。pH2.4の溶液では,Ni含有率は,300~600 A·m−2でほぼ一定となり,それ以上の電流密度で若干増加した。すなわち,pH2.4,3の溶液では,Fig.3で説明したI,II,IIIの領域が出現しているのに対して,pH1.5の溶液ではI,IIの領域のみが現われた。1000 A·m−2の高電流密度で比較すると,pHが高くなる程,Ni含有率は増加しており,100~200 A·m−2の低電流密度の場合とは逆の傾向を示した。
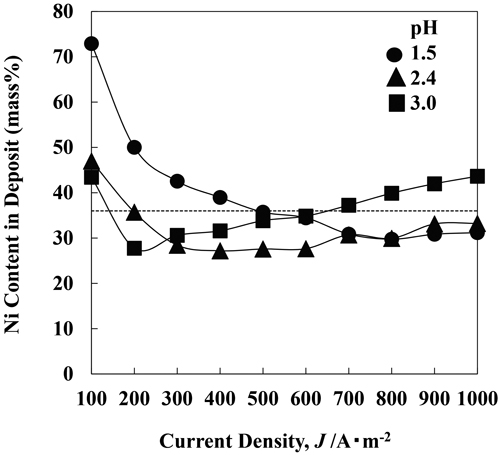
Ni content in Fe-Ni alloys deposited at various current densities from the solutions of different pH. [FeSO4 0.394 M, 50°C, 250 rpm, 100-1000 A·m–2]
Fig.8にpHの異なる溶液において,種々の電流密度において電析させたFe-Ni合金の電流効率を示す。何れのpHの溶液においても,電流効率は,電流密度が高くなる程増加した。また,何れの電流密度においても,電流効率は,pHが高くなる程高くなった。

Current efficiency for Fe-Ni alloy deposition at various current densities from the solutions of different pH. [FeSO4 0.394 M, 50°C, 250 rpm, 100-1000 A·m–2]
Fig.9にpHの異なる溶液からのFe-Ni合金電析におけるFe,Ni析出,H2発生の部分分極曲線を示す。Fe,Ni析出の部分分極曲線は,pHが1.5と低くなると,やや貴な電位の方に移行しているが,pH2.4,3では大きな差は見られなかった。それに対して,H2発生の部分分極曲線は,pHにより大きく異なった。pHが低くなる程,H2発生の部分分極曲線は,高電流密度側に移行した。

Partial polarization curves for Fe (a), Ni deposition (b) and H2 evolution (c) from the Fe-Ni alloy solutions of different pH. [FeSO4 0.394 M, 50°C, 250 rpm, 100-1000 A·m–2]
Fe-Ni電析合金の組成,電流効率と電流密度の関係に及ぼす溶液pHの影響をFe-Ni合金電析の全分極曲線,Fe,Ni析出,H2発生の部分分極曲線の形状より考察した。Fig.10に液中のpHを変化させた際のFe-Ni合金電析の分極曲線(a),Fe-Ni電析合金の組成,電流効率と電流密度の関係(b)の模式図を示す。Fe-Ni合金電析においては,Fe,Ni析出の部分分極曲線もpHにより若干変化するが,H2発生の部分分極曲線の変化に比べるとその程度はかなり小さいので(Fig.9),Fig.10(a)に示すFe-Ni合金電析の分極曲線の模式図では,H2発生の部分分極曲線および全分極曲線のみがpHが低下すると図中の矢印の方に変化すると仮定した。Feの析出が開始する全電流密度iFeは,pHが低下するとiFe’に増加するため,Ni含有率が低下を始める電流密度は高い方に移行する。また,Feの析出がFe2+の拡散限界となる全電流密度iLFeは,pHが低下するとiLFe’に増加するため,Ni含有率が増加を始める電流密度は高い方に移行する。すなわち,Ni含有率−電流密度曲線は溶液中のpHが低下すると高電流密度側に移行する。このため,pHが低くなる程,Ni含有率は,100~200 A·m−2の低電流密度では増加するのに対して,1000 A·m−2の高電流密度では低下する。一方,Fe-Ni合金電析の電流効率は,pHが低下するとH2発生の部分分極曲線が高電流密度側に移行するため,全電流密度域において低下する。

Schematic diagram of the changes in the polarization curves for Fe-Ni alloy deposition (a), current density-alloy composition and current density-current efficiency curves (b) with decrease in pH.
Fig.11に温度の異なる溶液において,種々の電流密度において電析させたFe-Ni合金のNi含有率を示す。何れの温度の溶液においても,低電流密度の領域においては,電流密度が高くなる程,Fe-Ni合金のNi含有率は低下した。100~400 A·m−2の電流密度で比較すると,温度が高くなる程,Ni含有率は増加した。何れの温度の溶液においても,Ni含有率は最小となった後,更に電流密度を上げると増加した。700~1000 A·m−2の電流密度では,Ni含有率は何れの温度においてもほぼ同等の値となった。

Ni content in Fe-Ni alloys deposited at various current densities from the solutions of different temperature. [FeSO4 0.394 M, pH 2.4, 250 rpm, 100-1000 A·m–2]
Fig.12に温度の異なる溶液において,種々の電流密度において電析させたFe-Ni合金の電流効率を示す。何れの温度の溶液においても,電流効率は,電流密度が高くなる程全体としては徐々に増加した。電流効率は,500 A·m−2以上の高電流密度域では,温度が高くなる程,低くなるのに対して,400 A·m−2以下の低電流密度では,温度が高くなる程,高くなる傾向にあった。また,40,50,60°Cにおいて,それぞれ,200,300,500 A·m−2で,電流効率が一旦低下する現象が見られた。この200,300,500 A·m−2では,Fe-Ni合金のNi含有率が最小値に向かって低下しており(Fig.11),FeOHadによるNi析出の抑制効果が最大になり,電流効率が低下したと推察される。
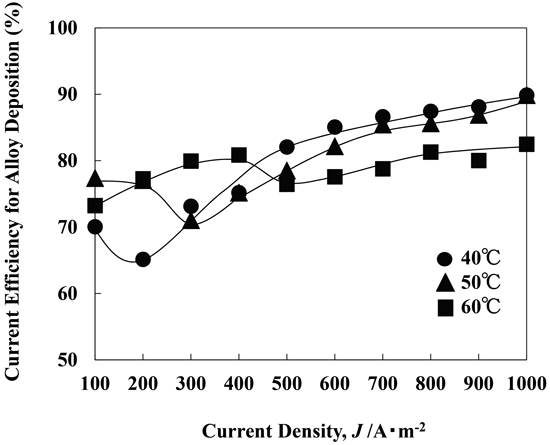
Current efficiency for Fe-Ni alloy deposition at various current densities from the solutions of different temperature. [FeSO4 0.394 M, pH 2.4, 250 rpm, 100-1000 A·m–2]
Fig.13に温度の異なる溶液からのFe-Ni合金電析におけるFe,Ni析出,H2発生の部分分極曲線を示す。Fe,Ni析出,H2発生の何れの部分分極曲線とも温度が低くなる程,卑な電位の方に移行した。特に,Ni析出において,その部分電流密度50 A·m−2以下の低電流密度域では,温度が低くなる程,分極の程度が大きくなった。すなわち,温度が低くなる程,低電流密度域でのFeOHadによるNi析出の抑制効果が大きくなった。また,温度が低くなる程。全電流密度が高い条件でH2発生の部分電流密度が低下していることも顕著である。

Partial polarization curves for Fe (a), Ni depositions (b) and H2 evolution (c) from the Fe-Ni alloy solutions of different temperature. [FeSO4 0.394 M, pH 2.4, 250 rpm, 100-1000 A·m–2]
Fig.14に溶液の温度を変化させた際のFe-Ni合金電析の分極曲線(a),Fe-Ni電析合金の組成と電流密度の関係(b)の模式図を示す。Fig.14(b)に示す電析合金のNi含有率−電流密度の関係,および電流効率−電流密度の関係は,各部分分極曲線の相対的な変化に依存する。Fig.13に示すFe,Ni,H2の分極曲線の分極の変化が同一であれば,電流効率,Ni含有率に及ぼす温度の影響は相殺され,Ni含有率−電流密度の関係,および電流効率−電流密度の関係は変化しない。よって,Fe,Ni,H2の分極曲線の相対的な変化が重要となる。そこで,本研究では,Fe,Ni,H2の分極曲線の変化において相対的な変化が大きいものを模式図において反映せた。Fig.13に示すようにFe,Ni析出,H2発生の何れも温度の影響を受けるが,温度が低下すると,低電流密度域でのNi析出の分極と高電流密度域でのH2発生の部分電流密度の低下が顕著であったので,Fig.14には,Fe析出は,一定と仮定して記載した。iFe~iNi’の低電流密度域では,溶液の温度が低くなるとNi析出がより抑制されるために,Ni含有率−電流密度曲線は,低電流密度側に移行する。また,温度が低くなると,高電流密度域では,H2発生の部分電流密度が低下するため,電流効率は上昇する傾向にあるが,低電流密度域ではNi析出の抑制の影響が優勢となり電流効率は低下する。
Schematic diagram of the changes in the polarization curves for Fe-Ni alloy deposition (a) and current density-alloy composition curves (b) with decrease in temperature.
Fig.15に静止溶液,撹拌溶液において,種々の電流密度において電析させたFe-Ni合金のNi含有率を示す。撹拌有り無しの何れの溶液においても,低電流密度の領域においては,電流密度が高くなる程,Fe-Ni合金のNi含有率は低下した。撹拌有りの溶液においては,Ni含有率は300~600 A·m−2において最小となり 600 A·m−2以上では,電流密度の増加に伴い高くなるのに対して,撹拌無しの溶液では,Ni含有率は200 A·m−2において最小となり200 A·m−2以上では,電流密度の増加に伴い高くなった。このように溶液を撹拌すると,Ni含有率が一定となる領域(Fig.3のII)が広くなり,また,Ni含有率が増加し始める電流密度(iLFe)が高くなった。

Ni content in Fe-Ni alloys deposited at various current densities from the solutions with and without stirring. [FeSO4 0.394 M, pH 2.4, 50°C, 100-1000 A·m–2]
Fig.16に静止溶液,撹拌溶液において,種々の電流密度において電析させたFe-Ni合金の電流効率を示す。撹拌有り無しの何れの溶液においても,Fe-Ni合金電析の電流効率は,電流密度が高くなる程,全体的には増加した。また,撹拌の有り無しで比較すると,電流効率は,撹拌有りの方が,低くなった。
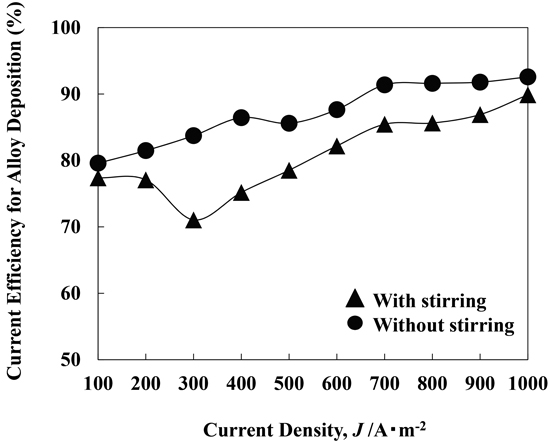
Current efficiency for Fe-Ni alloy deposition at various current densities from the solutions with and without stirring. [FeSO4 0.394 M, pH 2.4, 50°C, 100-1000 A·m–2]
Fig.17に静止溶液,撹拌溶液からのFe-Ni合金電析におけるFe,Ni析出,H2発生の部分分極曲線を示す。Fe析出の部分分極曲線(a)は,撹拌の有り無しでほとんど変化していないが,拡散限界電流になる電位は,撹拌無しで−0.75 Vであるのに対して,撹拌有りの場合,−0.78 Vとより卑になっており,撹拌することにより,Fe2+の拡散限界になり難いことを示している。Ni析出の部分分極曲線(b)では,撹拌無しの場合,−0.73 V付近より電流密度が急増するのに対して,撹拌有りの場合,−0.77 Vより急増しており,その結果,部分電流密度100 A·m−2以上でのNi析出の分極は,撹拌をした方が大きくなった。−0.73 V(撹拌無し),−0.77 V(撹拌有り)付近よりNiの析出速度が急増したのは,前述したように,Fe2+の還元がFe2+の拡散律速に近づき,FeOHadよって奪われていたNiOHadの吸着サイトが解放されるためと考えられる。撹拌をした方が,Fe2+の拡散律速になり難いため,NiOHadの吸着サイトが解放され難く,Ni析出の分極は大きくなると考えられる。一方,H2発生の部分分極曲線(c)は,部分電流密度100 A·m−2以下の領域で,撹拌をした方が,貴な方に移行した。これは,撹拌によりH+イオンの拡散が促進されるためと考えられる。

Partial polarization curves for Fe (a), Ni depositions (b) and H2 evolution (c) from the Fe-Ni alloy solutions with and without stirring. [FeSO4 0.394 M, pH 2.4, 50°C, 100-1000 A·m–2]
Fig.18に静止溶液,撹拌溶液におけるFe-Ni合金電析の分極曲線(a),Fe-Ni電析合金の組成,電流効率と電流密度の関係(b)の模式図を示す。Fe析出がFe2+の拡散限界となる全電流密度iLFeは,溶液を撹拌するとiLFe’に増加する。このため,iLFe以上の高電流密度域でのNi含有率−電流密度曲線は,高電流密度側に移行する。すなわち,電流密度の増加に伴い,Ni含有率が増加し始める電流密度は高くなる。よって,電析合金のNi含有率がほぼ一定となるIIの領域は,撹拌をした方が広くなる。一方,Fe-Ni合金電析の電流効率は,撹拌するとH2発生の部分分極曲線が貴な電位の方に移行するため,全電流密度域において低下する。また,撹拌をした方が,FeOHadによるNi析出の分極がより大きくなっており[Fig.17(b)],電流効率低下の一因になっていると考えられる。

Schematic diagram of the changes in the polarization curves for Fe-Ni alloy deposition (a) and current density-alloy composition curves (b) with stirring of solution.
Fe-Ni合金の合金組成に及ぼす溶液の組成,pH,温度,撹拌の影響を調査した結果,以下のことが分かった。電析合金中のNi含有率は,電流密度の増加に伴い低電流密度域で大きく低下し,最小値を示した後,更に電流密度を増加するとFe析出のみがFe2+の拡散律速となりNi析出は拡散限界電流密度に到達していないため上昇した。溶液中のFeSO4濃度が高くなると,電析合金中のNi含有率は,低電流密度域で低くなり,電流密度を増加させて行くとより低い電流密度で一定となった後,より高い電流密度から増加を始めた。その結果,FeSO4濃度が高くなると,Ni含有率が最小で一定となる電流密度の領域が広くなった。pHが低下するとH2発生の部分分極曲線および全分極曲線が高電流密度側に移行するため,Ni含有率−電流密度曲線は,全体的に高電流密度側に移行した。溶液の温度が低くなるとFe2+の共存により,Ni析出がより抑制されるために,Ni含有率は,低電流密度域で低くなった。溶液を撹拌するとFe析出がFe2+の拡散限界となる電流密度が増加するため,Ni含有率が最小値を示した後に増加し始める電流密度は高くなった。以上の電解条件による電析合金の組成の変化は,Fe-Ni合金電析における全分極曲線,Fe,Ni析出およびH2発生の部分分極曲線の変化により説明することが出来る。