2019 年 105 巻 4 号 p. 479-487
2019 年 105 巻 4 号 p. 479-487
In steelmaking slag, phosphorus is distributed between liquid phase and solid solution of 2CaO·SiO2 and 3CaO·P2O5 at refining temperature. Using the difference in water solubility of the solid solution and the other phases, we are developing the process to separate phosphorus by acid leaching. In this paper, the optimum condition of leaching by nitric acid by the control of valency of Fe in slag was investigated and the recovery of phosphorus from leachate was also conducted. To dissolve the solid solution, pH has to be decreased to 3 and the solid solution containing FeO showed lower dissolution ratio. To suppress the dissolution of other phases in slag at this pH, slow cooling to avoid the formation of glassy phase was necessary. The artificially steelmaking slag with the appropriate composition was made and subjected to the leaching experiment. The dissolution ratio of phosphorus has reached about 91% and the phosphorus content in the residue was enough low. After the separation of residue, pH of the leachate increased to precipitate phosphate. At pH=7, 80% or more of the phosphorus in the leachate was precipitated and the phosphate content of the precipitate was about 25% after calcination.
製鋼スラグの付加価値向上と利用拡大は,わが国での鉄鋼生産を維持する場合に避けて通れない重要な課題である。しかし,最新の統計によれば,転炉系製鋼スラグの生成原単位はゆるやかではあるが増加しており125~130 kg/tに達している1)。その用途は,22.7%を占める自社内再使用を除けば,道路用途が29.2%,土木用途が31.8%となっている1)。この構造は,長い間,変わっていないが,これらの用途は今後の伸びが期待できない上に競合材料も多いため付加価値がほとんどなく,販売価格も低いものでしかない。
一方,わが国はリン資源のすべてを海外からの輸入に頼っており,2015年の統計では約112千トンのPが,リン鉱石やリン酸などの中間原料,あるいは,リン酸肥料として輸入されている2)。リン鉱石は世界的に見て枯渇資源であり,特に良質の資源は限られている上に,東アジアでの人口の急増に伴う肥料需要の増大を考慮すると,資源セキュリティー上,非常に問題のある元素である3)。このため,国内2次資源からのリサイクル技術が注目され,特に下水汚泥からの回収では多くの技術が開発されている4)。これに対して,2015年の転炉系スラグの生成量は11,614千トン1)であるためスラグとして排出されているPは86千トンにもおよび,これは生活排水に含まれるPの1.5倍以上で,リン鉱石としての輸入量の約3倍になる。さらに,生活排水が各地方自治体などに広く希薄に分布するのに対して,一貫製鉄所に集中している上に,HgやAsのような有害重金属が含まれないため,良質の資源と言える。
製鋼スラグ中のPは,精錬温度では2CaO・SiO2と3CaO・P2O5の固溶体と液相に分配されているが,冷却後は,急冷等で液相スラグがガラス化した相がある場合を除けば,ほとんどが固溶体中に存在している。したがって,スラグからPを分離するには,固溶体とその他の相を分離すれば良く,磁気特性差5)や密度差6,7)を利用した方法や,キャピラリーを利用した方法8)等が開発されている。
当研究室では,固溶体相とその他の相との水溶液への溶解特性差を利用して,浸出による分離を開発しているが9,10),この中で,将来の鉄鉱石の劣質化リン濃度の増加を想定した,Pの濃度が高い製鋼スラグからの浸出に関する一連の研究を行っている11–13)。その結果,Na2OやK2Oをスラグに溶融混合する事で固溶体の溶解が容易になるとともにマトリックス相の溶解が抑制され,pHを6程度にクエン酸を用いて制御すれば,高い選択性で浸出させる事ができた。さらに,固溶体中のP濃度が高いため浸出液のP濃度も高く,pH制御によるリン酸塩の析出回収にも成功した。
一方,現状の製鋼スラグに対してもクエン酸による浸出に関する研究を行っている。Pの濃度が低いスラグでは固溶体中の3CaO・P2O5の濃度が低いため,Na2O等を添加しなくともpHを3程度まで下げれば固溶体は溶解でき,徐冷とFe2+/Fe3+の制御で固溶体以外の各相の溶解を抑制すれば,選択浸出が可能であるという結果を得た14)。しかし,クエン酸でpHを制御すると弱酸のためクエン酸イオンが水溶液中に多量に存在し,pHを上げてもリン酸カルシウムの沈殿が起こらず,浸出液からのリン酸塩の回収ができなかった。
一方,硝酸を用いてもpHを3程度にすれば固溶体は溶解する9)。これを受けて,1673 Kで固溶体を晶出させた後に急冷したスラグを用いた浸出実験を行ったが,pH=3でもPの浸出率は十分には高くならなかった10)。ところで,当研究室では製鋼スラグを稲作用肥料として利用する事を目的とした研究を行っているが,その中で,pH=4に硝酸で制御した水溶液に対して,Fe2+/Fe3+が高い場合にガラス相が水溶性を示す事があきらかになった15)。これより,硝酸で固溶体を浸出する場合には,固溶体以外の相,特にガラス相の存在が選択浸出性に影響すると思われる。
そこで,本研究では,スラグ組成(Fe2+/Fe3+)と鉱物相を制御することで,硝酸による選択浸出の可能性を調べた。さらに,浸出液からのリン酸塩の回収を試みた。
製鋼スラグには,溶銑脱リンスラグや脱炭スラグが含まれ,その組成や冷却方法は作業所毎に異なっている。著者らは,製鋼スラグを原料とし,それを粉砕して袋詰めしただけの製鋼スラグ系肥料を10銘柄程度入手し,その組成と鉱物相を調査した16)。その結果,共通して観察された相は,2CaO・SiO2-3CaO・P2O5(C2S-C3P)相,MgO-FeOx相,CaO-FeOx相,free-CaO相,金属鉄相と,製鋼温度では液相に相当する組成の相がガラス化した相であった。そこで,本研究では,これらのうち,free-CaO相と金属鉄相を除いた各相を試薬で合成した。合成原料として,CaOは1273 KでCaCO3を焼成して得,FeOは1723 Kで金属鉄とFe2O3の反応により作製した。これ以外は市販の化学試薬を用いた。また,P2O5は室温で不安定なため,3CaO∙P2O5を用いた。それぞれの合成方法は既報16)と同様であり,1473~1873 Kで48時間焼結させた。ガラス相は,酸化鉄をFeOとした場合は鉄坩堝を用いAr雰囲気で,Fe2O3とした場合はMgO坩堝を用い大気雰囲気で,1673 Kでスラグを溶解後に急冷した。
合成した酸化物組成をTable 1に示す。ここで,焼結したものは配合組成を,溶融させたものはICP-AESによる分析値を示している。尚,酸化鉄の価数は配合した酸化鉄と同じと仮定した。また,一部のものはすでに報告している結果を引用している。C2S-C3P相は,CaO-SiO2-P2O5の3元系9)に加えて,スラグ系肥料で観察された組成16)も作成した。ガラス相はCaO-SiO2-FeOの3元系17),その3元系にP2O5を加えた4元系17)と,スラグ系肥料で観察された組成16)を作成した。MgO-FeOx相,CaO-FeOx相はスラグ系肥料で観察された組成16)を作成した。尚,ガラス相とMgO-FeOx相では,酸化鉄をFeOとしたものと,Fe2O3としたものを作成し,CaO-FeOx相はFe2O3で作成した。
| Name | CaO | SiO2 | P2O5 | FeO | Fe2O3 | MnO | Al2O3 | MgO | |
|---|---|---|---|---|---|---|---|---|---|
| Mineral | Pure 0.8C2S-2C3P | 62.9 | 27.9 | 9.2 | – | – | – | – | – |
| Pure 0.7C2S-3C3P | 61.8 | 24.5 | 13.7 | – | – | – | – | – | |
| Actual C2S-C3P | 64.0 | 27.0 | 7.2 | 1.3 | – | – | 0.5 | – | |
| C2F | 38.7 | – | – | – | 55.8 | – | 5.5 | – | |
| MF2+ | 3.2 | – | – | 61.1 | – | 9.6 | – | 26.1 | |
| MF3+ | 3.0 | – | – | – | 63.6 | 9.0 | – | 24.4 | |
| Glass | Pure 3 Fe3+ | 35.0 | 35.0 | – | 30.0 | – | – | – | – |
| Pure 4 Fe2+ | 33.7 | 32.6 | 5.4 | 28.3 | – | – | – | – | |
| Actual Slag; Fe2+ | 25.2 | 31.0 | 3.5 | 27.2 | – | 7.1 | 2.3 | 3.7 | |
| Actual Slag; Fe3+ | 23.2 | 30.4 | 3.4 | – | 19.7 | 6.0 | 2.3 | 15.1 |
疑似スラグは,代表的なスラグ系肥料の組成と同じに配合した試料を,既報と同様にMgO坩堝で溶解し3 K/minの冷却速度で徐冷した。この場合も,酸化鉄をFeOとしたものと,Fe2O3としたものを作成した。また,酸化鉄の価数の影響を調べるため,FeOとFe2O3の混合比を変化させた試料も作成した。合成した疑似スラグの分析結果をTable 2に示す。尚,FeOとFe2O3を混合させた場合には,合成したスラグを滴定法により分析しFe2+とFe3+の濃度を測定した。
| Slag | CaO | SiO2 | P2O5 | FeO | Fe2O3 | MnO | Al2O3 | MgO |
|---|---|---|---|---|---|---|---|---|
| A | 28.9 | 17.2 | 2.5 | – | 29.9 | 5.3 | 3.0 | 13.2 |
| B | 30.4 | 19.6 | 2.0 | 25.8 | – | 5.3 | 2.9 | 14.0 |
| C | 31.4 | 19.3 | 3.0 | 5.8 | 23.4 | 5.5 | 3.2 | 8.4 |
| D | 32.8 | 18.2 | 3.0 | 12.3 | 17.2 | 5.7 | 3.3 | 7.5 |
| E | 33.4 | 19.9 | 3.1 | 21.7 | 6.9 | 5.7 | 3.3 | 6.0 |
各相の浸出実験は既報10,14)と同じ方法で行った。ポリエチレン製容器に400 mLのイオン交換水を入れ,<53 µmに粉砕した1 gの酸化物を投入しマグネチックスターラーで撹拌した。実験温度は恒温槽を用いて298 Kとし,雰囲気は空気をバブリングした大気雰囲気下で行った。実験開始後,pHが一定になるように希硝酸を添加した。実験中に所定の時間毎に水溶液5 mLをシリンジで採取し,シリンジフィルターを通した後の溶液組成をICP-AESで分析した。実験は120分間おこなった。
疑似スラグの浸出実験では,浸出液を用いて行う析出実験も考慮し,より多くのリンが浸出するように,一部の実験では投入する酸化物の量を4 gとした。
2・3 析出実験14)疑似スラグの浸出実験を120分間おこなった後,シリンジフィルターを通して固体を分離し,浸出液を回収した。浸出液100 mLをポリエチレン製容器に入れ,そこにpHが所定値になるまで1 mol/LのNaOH水溶液を添加し,マグネチックスターラーで1時間攪拌した。その後,10分間静置させ析出物を沈殿させた上で,上澄み液をシリンジで吸い取った。残った残渣は,遠心分離機(2000 r/min.)にかけた後にシリンジフィルターを通して液体を分離し,333 Kで十分な時間,乾燥させて重量を測定した。次いで,Pt坩堝に入れて,873 Kで2時間,煆焼した。煆焼前後重量の変化を析出物の結晶水の含有量とした。得られた粉末の組成をICP-AESで分析しXPSで結晶相を同定した。
すでに既報で示したように,各相からのカチオンの溶解挙動は,実験開始から60分以降は定常状態になり,水溶液中の濃度はほぼ一定値になる。pHが高い場合は,水溶液中でヒドロキシアパタイト[HAP:Ca10-x(HPO4)x(PO4)6-x(OH)2-x]や非晶質SiO2等が析出する場合があるため,水溶液中の各元素の濃度比は鉱物相中での濃度比とは対応しない場合もある。本研究では,各相の溶解比Rdis.を,各相を構成する酸化物MOxにおけるカチオンMの120分時点での水溶液中の濃度CM(mol/m3)と,水溶液量V(m3),各相の添加質量W(kg)を用いて,次式で計算した。ここで,XMOxはMOxの分子量(kg/mol)である。
| (1) |
Fig.1はC2S-C3P固溶体相の溶解率とpHの関係である。スラグ系肥料で見られた固溶体の組成はC3P/(C2S+C3P)で0.2程度の場合が多いため,ここでは,3元系においてC3P/(C2S+C3P)が0.2と0.3の固溶体について整理したが,pHの低下とともに溶出率は増大し,pH=3であれば,80%以上の溶出率になる事がわかる。また,スラグ系肥料で見られる固溶体にはFeOが含まれるため,やや溶解度が低下している。これは既報でも同様の傾向が得られている。Fig.2には3元系でC3P/(C2S+C3P)が0.3の固溶体について,水溶液中のP/Ca,Si/CaとpHの関係を示す。pHが下がる事で水溶液中のP/Caが固溶体組成に近づく事が明確にわかるが,これはpHが高い場合には,水溶液中でのHAP等の溶解度積でPの溶出が上限となっているためである。また,Si/CaはpHに依らず固溶体組成と近いため,Siの溶出を阻害する化合物は水溶液中で形成されていない事がわかる。この結果より,固溶体を完全に溶解させるにはpH=3が必要であり,また,固溶体にFeOが含まれると溶解度が低下する事が明らかになった。

Influence of pH on the dissolution ratio of the solid solution of 2CaO·SiO2-3CaO·P2O5.

Composition of aqueous solution after the dissolution of the solid solution.
一方,Fig.3はガラス相の溶解率とpHの関係を示すが,ガラス相の溶解は既報のように酸化鉄の価数に大きな影響を受け,酸化鉄が2価の場合にはpH=3では,ほぼ完全に溶解する事がわかる。これに対して,3価の場合はpH=3でも約60%の溶解度に抑制される。しかし,固溶体を選択浸出させるには,価数に依らずガラス相の存在は好ましくないと言える。これに対して,結晶相の溶解度をFig.4に示すが,いずれの場合でも溶解度は極めて低かった。これより,pH=3で固溶体相以外の相の溶解を防ぐには,ガラス相が存在しないように徐冷する事が必要であると言える。

Influence of pH and the valency of Fe oxide on the dissolution ratio of glassy phase.

Influence of pH on the dissolution ratio of the mineralogical phases observed in steelmaking slag.
上記の検討により,硝酸を用いてpH=3で選択浸出を行うには,徐冷によるガラス相の生成抑制と,酸化鉄を3価にして固溶体の溶解を阻害させない事が重要であるとの結論を得た。そこで,試薬で合成した疑似スラグの浸出実験を行った。
浸出実験に供した試料の代表的な組織をFig.5に示す。MgO坩堝で溶解したためMgO濃度が高くなった事もあり,観察された鉱物相はC2S-C3P固溶体,MgOが6%程度含まれたC2S-C3P固溶体,MgO-Fe2O3相,および,MgO相であり,PだけでなくCaやSiも,ほとんどが固溶体相に含まれていた。

Mineralogical structure of the synthesized slag.
各酸化物の溶出率を次式で計算した。ここで,(%MOx)は疑似スラグ中の酸化物MOxの濃度(mass%)である。
| (2) |
Table 3に結果を示すが,Pだけでなく,Ca,Siもほぼ完全に溶出しているのに対して,Fe,Mn,Alはほぼゼロであり。固溶体相以外の溶出を完全に抑制して選択浸出ができている事がわかる。Table 3には比較のため酸化鉄をFeOとして合成したスラグの結果も示すが,Pの溶出率がやや低下し,Mnの溶出率が増加している。
| Ca | Si | P | Fe | Mn | Al | |
|---|---|---|---|---|---|---|
| Fe2O3 Slag (slag A) | 0.939 | 1.037 | 0.857 | 0.003 | 0.059 | 0.003 |
| FeO Slag (slag B) | 0.923 | 1.194 | 0.754 | 0.034 | 0.140 | 0.003 |
実験後の残渣を回収して質量を測定するとともに,組成をICP-AESで分析した。浸出試験前後のマスバランスをFig.6,Fig.7に示すが,酸化鉄をFe2O3として合成したスラグ(Fig.6)では固溶体の90%程度が溶解し,残渣はFe2O3-MnOが主成分になっている事がわかる。この場合,スラグに含まれていたPの質量と,浸出液に含まれるPの質量の比から浸出率を計算すると91%であった。一方,酸化鉄をFeOとして合成したスラグ(Fig.7)では固溶体の溶解率は70%程度に低下し残渣中のリン濃度も高くなっている。
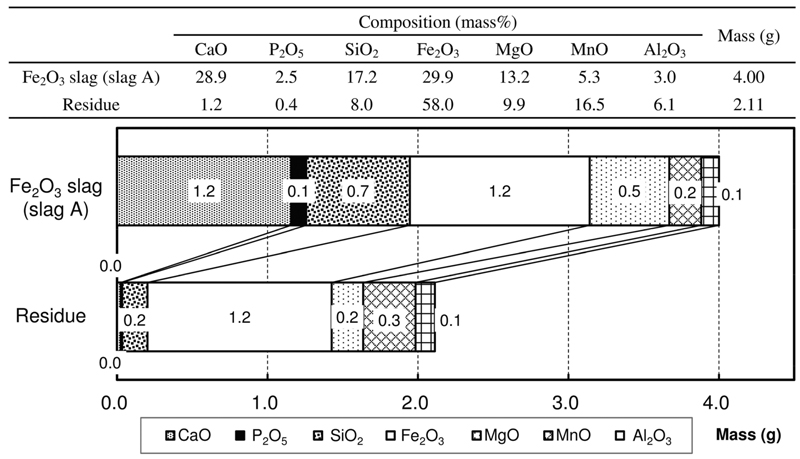
Result of the leaching experiment of the synthesized slag containing Fe2O3 as Fe oxide.

Result of the leaching experiment of the synthesized slag containing FeO as Fe oxide.
Fig.8にP,FeおよびMnの溶出率へのFe2O3/(FeO+Fe2O3)の影響を示す。Fe2O3/(FeO+Fe2O3)が1の場合に比べるとFeOが混合する事でPの溶出率は僅かではあるが低下し,MnとFeの溶出率はFeOが20%程度混合した場合でも増加している。これは,Pの選択浸出という視点では大きな差ではないが,後記するように析出物をリン酸肥料として利用する場合には,Feの濃度は低い事が望まれるため,酸化鉄の価数は3価に制御する事が必要である。

Influence of the valency of Fe in the synthesized steelmaking slag on the dissolution ratio of P, Mn and Fe.
酸化鉄をFe2O3,および,FeOとして合成したスラグを浸出した時に得られた浸出液のpHを上昇させると沈殿物が生成した。沈殿物を固液分離後に煆焼した回収物の組成と質量から各元素の析出率を式(3)で計算した。
| (3) |
ここで,(mass%M)Precは回収物中のM元素の濃度,WPrecは回収物質量(kg),CM,Leach(mol/m3)はM元素の浸出液中の濃度,VLeac(m3)は浸出液量,XMはMの原子量(kg/mol)である。
各元素の析出率とpHの関係をFig.9に示す。ここで,析出率が1を超えた場合は1とした。酸化鉄をFe2O3とした場合,PはpH=7ですでに80%以上が析出するのに対して,SiはpH=7では10%程度の析出率で,pHを上げるほど析出率が増加した。一方,CaはpHの上昇とともに析出率は増加したが,pH=11でも析出率は20%程度であった。酸化鉄をFeOとした場合も傾向は同じであったが,FeはPと同様にpHを上げると析出するため,回収物のFe濃度を下げるには浸出させない必要がある。そのためには,Fig.7に示したにFe2O3/(FeO+Fe2O3)を1に制御する事が重要である。

Precipitation ratio of P, Ca and Si from leachate at various pH.
各pHでの回収物の組成をTable 4に示すが,酸化鉄をFe2O3としpHを7で析出させた場合にはP2O5の濃度が25 mass%程度に達した。しかし,さらにpHを高くするとSiO2が析出するためP2O5の濃度が低下し,また,酸化鉄をFeOとした場合には浸出時の選択性が悪いため,いずれもP2O5の濃度は20 mass%以下であった。酸化鉄をFe2O3としたスラグの浸出液をpH=7で処理した時に得られた回収物に対するXRDの結果をFig.10に示すが,回収物は煆焼しても非晶質であった。また,この場合に,回収物中に含まれるPの質量と浸出液中に含まれていたPの質量の比から回収率を計算すると86%であった。前述のようにPの浸出率は91%であるため,この結果は,スラグに含まれていたPの78%が回収された事になる。
| Slag | pH | CaO | SiO2 | P2O5 | FeO | MnO | Al2O3 | MgO | H2O |
|---|---|---|---|---|---|---|---|---|---|
| Fe2O3 Slag (slag A) | 7 | 23.4 | 27.6 | 24.8 | 1.4 | 2.2 | 0.5 | 0.7 | 19.4 |
| 9 | 16 | 47.5 | 11.3 | 0.6 | 1.4 | 0.4 | 2.6 | 20.2 | |
| 11 | 17.8 | 34.5 | 6.7 | 0.3 | 0.8 | 0.1 | 11 | 28.8 | |
| FeO Slag (slag B) | 7 | 12.9 | 35.5 | 16.9 | 9.1 | 2.8 | 0.6 | 2.8 | 21.5 |
| 9 | 11.3 | 51.3 | 6 | 3.5 | 2.4 | 0.2 | 2.4 | 22.7 | |
| 11 | 16.8 | 36.3 | 4.2 | 2.4 | 1.7 | 0.2 | 9.2 | 29.4 |
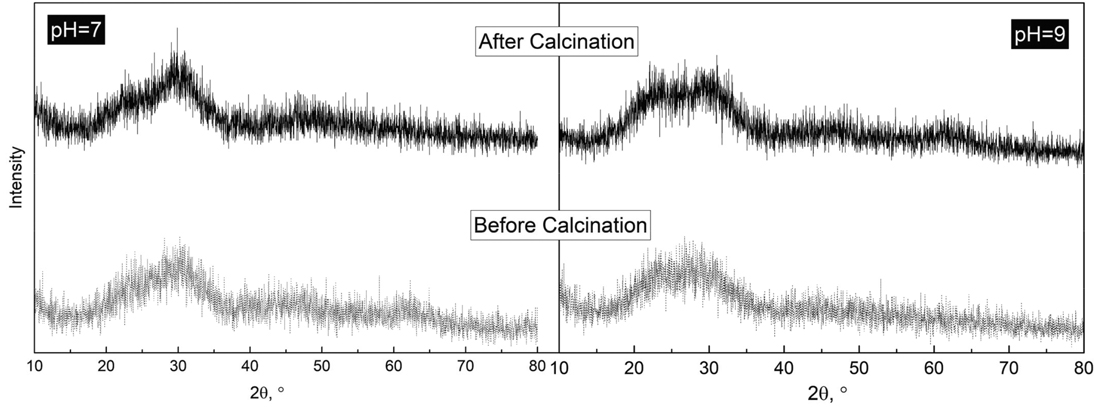
Result of XRD analysis for the product before and after calcination.
ここでは,既報で示したクエン酸による処理との差異を議論する。クエン酸の場合にもpH=3で浸出した場合にはC2S-C3P相の選択浸出は可能であったが,析出回収は困難であった。本研究のような多くの元素が共存する水溶液での反応を解析するため,地球化学分野で開発されたUSGS製の平衡計算ソフトpHREEQC18)を用いて考察した。このモデルでは式(4)で表される水溶液反応に対し,式(5)で示される飽和指数(Saturation Index:SI)により,その状態を評価している。
| (4) |
| (5) |
ここで,KSPは式(4)で表される反応の平衡定数であり,IAPは実験で得られた水溶液中のカチオンAy+とアニオンBx−の活量積(式(6))であり,単純な濃度ではなく,水溶液中で生じる様々な錯体反応等を考慮して計算される値である。
| (6) |
つまり,水溶液系が化学平衡にあればSIはゼロであり,正の値をとれば過飽和で,負の値であれば未飽和である事を示す。計算ではpHREEQCに含まれる種々のデータベースからllnlを利用し,それに下記の平衡関係19)を追加して行った。
| (7) |
酸化鉄をFe2O3として合成したスラグに対して硝酸,あるいはクエン酸を用いて行った実験において,60 min時点での浸出液組成を用いて計算したSIをTable 5に示す。計算はllnlデータベースにあるすべての固相に対して行われたが,主要な溶出元素を含むSIが0に近い固相と,溶液中のPの濃度に対する影響が考えられる固相を挙げた。Berlinite(AlPO4)やDCPD(CaHPO4:2H2O)やHAP(Ca5(OH)(PO4)3)はいずれの溶媒においても負のSIを示しており,Pの濃度には影響を及ばさない。Todorokite(Mn7O12:3H2O)は硝酸では正のSIであるが,Pを含まないためPの溶出への影響はない。一方,硝酸の場合はGoethite(FeOOH)が過飽和となる。Goethiteは溶液中のPを吸着する事が知られているが,その吸着能は1 gのGoethiteに対して数10mgであるため20,21),Feが大量に溶けない限りの吸着による浸出液中のPの濃度低下は無視できる。更に,Vivianite(Fe3(PO4)2(H2O)8)はすべての溶媒において大きな負の値であった。従って,Feを含む沈殿でP濃度に影響するのはStrengite(FePO4:2H2O)と考えられる。そのSIは,いずれの溶媒においても負の値を示すが,硝酸の場合では平衡に近いことが分かる。また,SiO2(am-gel,H4SiO4)は溶媒と関係なく過飽和であり,その原因はpHが低い環境でSiO2のゼータ電位が高く凝集しないことと考えられる22)。これは析出実験において,pH 7で得た析出物にSiO2が存在することで説明できる。つまり,pH 7におけるH4SiO4の溶解度はpH 3と同様であり,且つ中性ではCa-Si-H系沈殿が生成しないため,pH上昇によってゼータ電位が低下しH4SiO4が凝集したと考えられる。
| Equilibrium phase | Leaching agent | |
|---|---|---|
| Nitric | Citric | |
| Goethite (FeOOH) | 0.76 | –1.64 |
| SiO2 (am-gel, H4SiO4) | 0.63 | 0.76 |
| Strengite (FePO4:2H2O) | –0.28 | –2.6 |
| Berlinite (AlPO4) | –1.92 | –4.08 |
| DCPD (CaHPO4:2H2O) | –2.16 | –2.17 |
| Todorokite (Mn7O12:3H2O) | 0.29 | –0.13 |
| Hydroxylapatite (HAP, Ca5(OH)(PO4)3) | –14.88 | –15.09 |
| Vivianite (Fe3(PO4)2(H2O)8) | –41.81 | –48.85 |
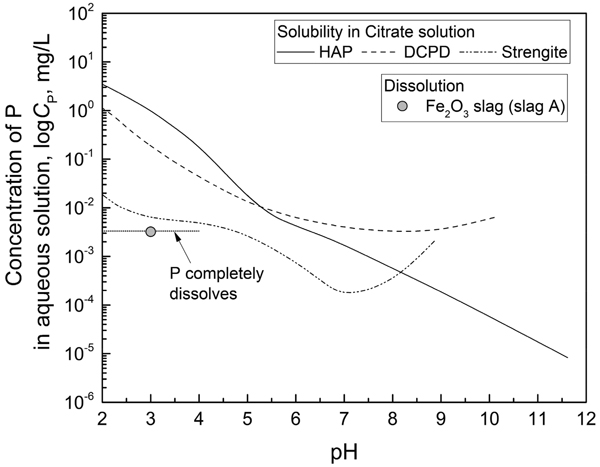
上記の考察を踏まえて,Pの濃度に影響するStrengiteと,Pの溶出上限とも言えるDCPD,HAPに対して,pHによるPの溶解度変化を計算した。その結果および実験結果との比較をFig.11およびFig.12に示す。

Solubility of each compound in the aqueous solution at various pH controlled by nitric acid.
Solubility of each compound in the aqueous solution at various pH controlled by citric acid.
図中にはpH=3での浸出液中のPの濃度を丸印で,浸出液のpHを7に上げてPを析出させた後の溶液中のPの濃度を四角印でプロットしてある。また,スラグに含まれるPがすべて溶解した場合の濃度(最大溶出濃度)を水平線で示している。
まずFig.12に示した,クエン酸を用いた場合のDCPD,HAP,および,Strengite の溶解度から計算されるPの濃度(Pの溶解度)とpHの関係を見ると,pH=3での実験値は最大溶出濃度に等しく,これらの溶解度積で決まるPの溶解度より低い事がわかる。これは,本実験の浸出条件では,Pはこれらの析出の影響を受けすに溶解できる事を示している。一方,pHが高い条件ではCa-Citrateの錯体が生成するため,pHを3から7に上昇させても,Pの溶解度は大きくは変化しない。これが,クエン酸を用いた浸出液のpHを上げてもCa-P系の沈殿が発生しなかった理由と考えられる。
次にFig.11に示した,硝酸を用いた場合のDCPDおよびHAPの溶解度から計算されるPの濃度(Pの溶解度)とpHの関係を見ると,実験値はDCPDおよびHAPで決まるPの溶解度より低い事がわかる。しかし,Strengite の溶解度から計算されるP濃度よりは高い値になっており,また,酸化鉄をFeOとしたスラグの場合には最大溶出濃度にほぼ等しいが,Fe2O3としたスラグの場合には,それよりやや低い事がわかる。溶出したPの濃度に対する同時に溶けたFe濃度の影響については後に考察する。一方,pH=7でPを析出させた後の溶液中のP濃度を見ると,酸化鉄をFeOとしたスラグの場合にはHAPの溶解度に近く,Fe2O3としたスラグの場合にはDCPDとHAPの溶解度の間に位置している。つまり,硝酸の場合にはpHを上げるとHAPで決まるPの溶解度が大きく低下するため,浸出液中に溶解していたPがCa-P系の化合物として沈殿したものと考えられる。
クエン酸と硝酸の差をまとめると,pH 3におけるPの浸出には同等の効果を持つが,pH上昇によるPの析出には硝酸が有利であることになる。
ところで,前記のように,酸化鉄をFeOとしたスラグに対して硝酸を用いた場合の実験結果は,最大溶出濃度には達しなかった。これは,溶出したFeの量が増えてStrengiteの析出の影響が顕れたものと考えられる。以下では,溶出したPの濃度に対する同時に溶けたFe濃度の影響について考察する。
ここでは,Pが100 mg/L,Caの濃度がモル比率でPの3倍含まれる溶液を仮想し,その溶液中のFeの濃度を変化させた場合の平衡濃度を,llnlデータベースを用いてpHREEQCによって計算した。本実験は大気環境で行われたため,酸化還元電位は空気と平衡する溶存酸素によって決まるとし,硝酸によりpHを 3とした条件で行った。
その結果をTable 6に示す。ここで上段は仮想溶液中の各元素濃度とFe/Pで,下段はpHREEQCによって平衡状態を計算した結果で「P remain」は析出せずに溶液中に残存するPの濃度である。これより,Feの濃度の上昇によってStrengiteの析出によるPの平衡濃度への影響が大きくなり,Pに対し1/5程度のFeがある場合には,Pの約10%が析出し,Pと同等のFeが存在する場合には,50%以上が析出する事がわかる。実験で得られた浸出液のFeとPの濃度比(Fe/P)は,Fe2O3の場合には0.07であったのに対してFeOの場合は1.004にも達した。これからも,酸化鉄をFeOとしたスラグから溶け出したFe2+が酸化されてStrengiteが析出し,それがPの溶出を妨げている事がわかる。pHが低い場合にはFe2+の酸化速度が遅いため,酸化還元電位の制御や短時間浸出によりPの溶出に対するStrengiteの影響を抑えられる可能性がある。しかし,析出物の酸化鉄濃度を減らにはFeの溶出量自体を減らすしか方法はない。
| Initial condition | P, mg/L | 100.0 | 100.0 | 100.0 | 100.0 | 100.0 |
| Ca, mg/L | 387.0 | 387.0 | 387.0 | 387.0 | 387.0 | |
| Fe, mg/L | 10.0 | 20.0 | 30.0 | 50.0 | 100.0 | |
| Fe/P | 0.1 | 0.2 | 0.3 | 0.5 | 1.0 | |
| At equilibrium | P remain, mg/L | 96.8 | 91.2 | 85.7 | 74.6 | 46.8 |
製鋼スラグ中のリンは,精錬温度では2CaO・SiO2と3CaO・P2O5の固溶体と液相に分配されているが,この固溶体相とその他の相との水溶液への溶解特性差を利用して,浸出によるリンの分離技術を開発している。本研究では,スラグ組成(Fe2+/Fe3+)と鉱物相を制御することで,硝酸による選択浸出の可能性を調べ,さらに,浸出液からのリン酸の回収を試みた。その結果,以下の事項が明らかになった。
(1)固溶体を完全に溶解させるにはpH=3が必要であり,また,固溶体にFeOが含まれると溶解度が低下する。また,このpHで固溶体相以外の相の溶解を防ぐには,ガラス相が存在しないように徐冷する事が必要である。
(2)酸化鉄を3価とし,徐冷によるガラス相の生成を抑制した,試薬で合成した疑似スラグの浸出実験を行った結果,固溶体の90%程度が溶解し,Pの浸出率は91%に達した。残渣はPの濃度が低くFe2O3-MnOが主成分になっていた。一方,酸化鉄を2価とした場合には,溶解率は70%程度に低下し残渣中のPの濃度も高くなった。
(3)酸化鉄の2価と3価の比率を変えた実験の結果,2価が混合する事でPの溶出率は僅かではあるが低下した。また,すべてが3価の場合に比べると2価が20%程度混合しただけでMnとFeの溶出率は増加した。
(4)浸出液を固液分離した後,アルカリを添加してpHを上げ析出物を回収した。その結果,酸化鉄をFe2O3とした場合,PはpH=7ですでに80%以上が析出し,析出物中のP2O5の濃度は約25%に達した。また,pHをさらに上げるとSiO2の濃度が高くなった。
(5)回収物中に含まれるPの質量と浸出液中に含まれていたPの質量の比から回収率を計算すると86%であった。浸出時の浸出率と合わせると,この結果は,スラグに含まれていたPの78%が回収された事になった。