2023 年 109 巻 12 号 p. 941-950
2023 年 109 巻 12 号 p. 941-950
The effect of the particle size distribution of MgO and carbon on the behaviour of the MgO-C reaction was investigated by heating four kinds of MgO-C sample bricks with different size distributions, and the reaction mechanism was discussed quantitatively using an improved MgO-C reaction model in which the unreacted core model was combined with a statistical distribution function. As a result, it was found that the MgO-C reaction is promoted when the ratio of fine particles of MgO increased and finer particles of carbon were used in the brick. A kinetic model of the MgO-C reaction based on the unreacted core model was developed and improved by combining the model with the statistical distribution function. The improved model considers the effect of the particle size distribution of the refractory materials on the MgO-C reaction rate. The effect of the carbon particle size on the MgO-C reaction can be explained using this model. The effect of the MgO particle size on the reaction behaviour can also be explained by the model under conditions with a relatively large ratio of MgO aggregates. However, when the ratio of fine MgO particles was large, the calculation result was much larger than the experimental result. As a reason for this, it is predicted that the fine particles sinter with each other during heating, resulting in an increase in the apparent particle diameter of the fine MgO.
MgO-C耐火物はPericlase相と黒鉛の単純な材料から成るので,相変態は起こらず,高温まで比較的安定である。この種の耐火物は,優れた耐熱衝撃性と製鋼スラグ特有の塩基性スラグに対する高い耐食性という利点を有する。このため,製鋼の主要工程である転炉のウェア耐火物や取鍋スラグライン部のウェアれんが1,2,3,4)など,多くの製鋼設備にMgO耐火物が適用されてきており,実際MgO-C耐火物は日本の製鋼プロセスにおいて30年以上5,6,7,8,9,10)ウェア耐火物として一般的に使用されてきている。MgOと耐火物中の炭素との反応である,いわゆるMgO-C反応は,還元性雰囲気11,12)中で起こることが知られており,一旦MgO-C反応が起こると,耐火物中の気孔が増加して組織が粗くなり,耐用性劣化の原因となる。このため,耐火物の耐久性を改善し,寿命を延ばすためにはこの反応を制御することが重要である。
MgO-C反応はMgOの純度,添加物,炭素含有量,雰囲気や温度などに影響されると考えられる。MgO-C反応の挙動に関する多くの研究13,14,15,16,17,18)は今日までに報告されているが,従来の研究はMgO-C反応に及ぼすこれら全ての因子の影響を説明できなかった。そのため,反応に及ぼす因子の影響を総合的に考慮できる新しい反応モデルの構築が望まれている。
著者らはMgO-C反応速度に及ぼす温度,ガス流量,耐火物中の炭素含有量のようないくつかの因子の影響を調べ,反応挙動19)に及ぼすそれらの影響を説明する反応モデルを提案し検討した。具体的には,MgO-C反応速度に及ぼす耐火物中の温度と炭素含有量の影響を説明することを可能にする未反応核モデルに基づくMgO-C反応モデルを構築し,MgO-C反応挙動がこのモデルを用いて予測できることを実証した。他の従来研究におけるMgO-C反応挙動もこの反応モデルを適用することによって説明できることも確認した。しかし,この反応モデルは耐火物中の粒径分布を考慮できないので,耐火物は均一な平均粒径を持つと仮定して計算を行っている。一般に,実際の耐火物は,Andreasenの式20,21) のような定義された分布式に従って,mmオーダの骨材からµmオーダの微粒子までの広い粒度分布で構成されている。MgO-Cれんがを含むこれらの耐火物はこの広い粒度分布を特徴とするので,粒度分布を考慮するためにこの反応モデルを改良する必要がある。さらに,粒子サイズの減少は反応を制御する方法として以前の反応モデルによって予測されたが,より詳細な検証が求められる。
本研究では,様々なMgOと炭素の粒度分布を有するMgO-Cれんがのサンプルを調製し,不活性ガス雰囲気中で加熱した実験を行い,MgO-C反応に及ぼすMgO,炭素成分の粒度分布の影響を調べた。反応挙動を未反応核モデルに基づく改良反応モデルを構築して検討した。
Fig.1に実験装置を示す。実験条件をTable 1に示す。前報と同様に横型炉を使用して,両端を閉じた状態で炉の均熱部にセットされたMgO-Cサンプルを加熱した19)。実験方法は以下の通りである。最初に,耐火物試料を炉の一端にセットした。炉内にアルゴンガスを導入し,炉内雰囲気をアルゴンガスに置換した後,炉内を0.083 K/s(1473 K以上で0.03 K/s)の速度で加熱した。次に,実験目標温度まで加熱した後,ロッドを使用してサンプルを炉の端から中央に素早く(ほぼ瞬時に)移動させ,指定された時間その温度に保持した。所定時間経過後,サンプルを炉の反対側の端に迅速に移動させ,不活性ガス雰囲気中で急冷した。試料の重量を加熱前後に測定し,重量減少率を評価し,各試験条件で比較した。重量減少率は式(1)のように定義した。いくつかの試料についてはミクロ組織をSEMで観察した。
| (1) |
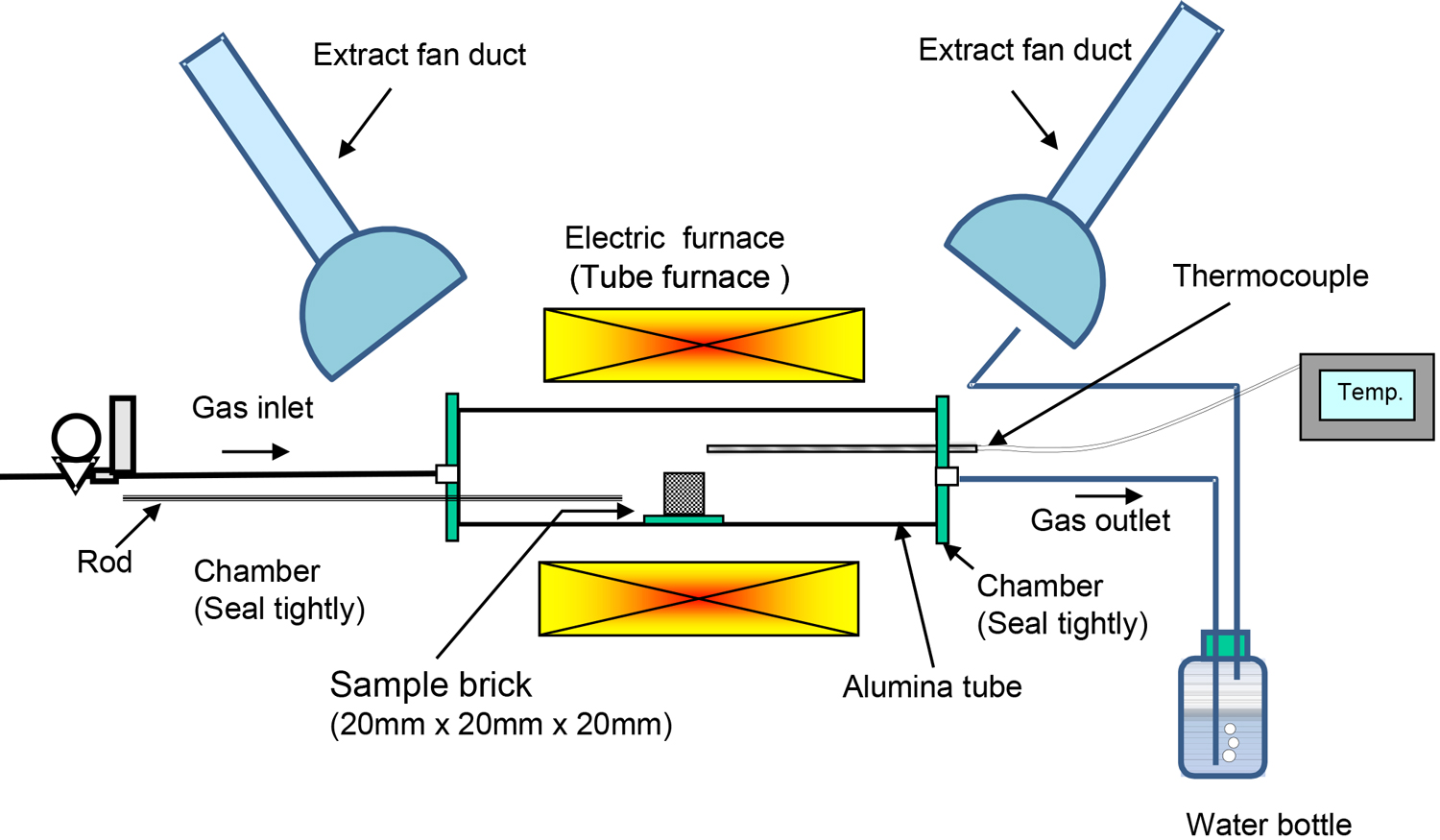
Experimental apparatus19). (Online version in color.)
| Sample brick | MgO-20%C (with different particle size distribution) |
| Sample dimensions | 20 mm × 20 mm × 20 mm (cubic) |
| Temperature | 1773 K |
| Atmosphere and gas flow rate | Ar: 1.67×10−5 Nm3/s |
| Holding time | 0 ~ 10800 s |
Table 2に実験で使用したサンプルの一覧を示す。焼結MgOと鱗状黒鉛(グラファイト)を原料として用いた。MgOと鱗状黒鉛の含有量合計が100 mass%になるように原料を配合した。Alに代表される酸化防止剤は,MgO-C反応挙動に影響する可能性があるため,いずれの試料にも使用しなかった。バインダーとしてはフェノールレジンを用い,MgOと鱗状黒鉛の合計重量に対して3 mass%(外掛け)添加した。これらの粉末を結合剤(フェノール樹脂)と混合した後,混錬物を型枠に挿入し,フリクションプレス機を用いて,114 mmW×65 mmH×230 mmLの標準サイズのれんがに成形し,その後,20 mm四方の立方体に加工した。これらの試料をCO雰囲気中,1 673 K×3 hで熱処理(コーキング処理)し,得られた試料を評価した。MgOとグラファイトの粒径分布はカーボン含有量が一定(20 wt%)の条件下で変化させた。試料MCはベースの条件であり,Andreasenの式における分配係数であるq値は0.45,MgOとグラファイトの平均粒径はそれぞれ0.6 mmと0.18 mmであった。試料CCはMgO骨材の最大径を増加させ,q値は0.68,平均粒径は1.2 mmとした。試料FCは,MgO微粉の量を増加させ,q値を0.15,平均粒径が0.25 mmになるように調整した。試料MFではMgOの粒径分布は試料MCと同等とし,黒鉛の粒径は0.18 mmから0.045 mmに減少させた。
| Sample No. | MC | CC | FC | MF | |
|---|---|---|---|---|---|
| MgO clinker | Top size (5-3mm) | 21 mass% | 30 mass% | 8 mass% | 21 mass% |
| Fine particles* (under 1mm) | 31 mass% | 19 mass% | 58 mass% | 31 mass% | |
| Flake graphite | 180 μm class | 20 mass% | 20 mass% | 20 mass% | 0 mass% |
| 45 μm class | 0 mass% | 0 mass% | 0 mass% | 20 mass% | |
| Phenol resin ** | +3 mass% | +3 mass% | +3 mass% | +3 mass% | |
| q value from Andreasen’s equation | 0.45 | 0.68 | 0.15 | 0.45 | |
| Average particle diameter of MgO (mm) | 0.66 | 1.21 | 0.25 | 0.66 | |
(Remark)
* : Fine particles were defined at the mass% of MgO particles with diameters <1 mm.
** : As a binder, phenol resin was added to the sum of MgO particles and graphite by an outer number of 3%.
Fig.2に炭素粒子径の異なる条件における重量減少率の経時変化を示す。ここで,実験方法の関係上,MgO-C反応は保持時間が0 sであっても加熱および冷却期間中に僅かに生じるため,重量減少率の正味値は,実験結果から昇降温期間中(保持時間0 s)の重量減少率を差し引くことによって表した。Fig.3に重量減少率と平均炭素粒径の関係を示す。これらの図から,MgO-C耐火物に微細な炭素粒を用いる(本試験では,サンプルMF)と,重量損失比は増加した。しかし,重量減少の増加は多くても14%であった。ここで,重量減少の増加は,基準条件における重量減少率に対する任意条件(ここでは2 h後)における重量減少率の比として定義された(すなわち,サンプルMC中の重量損失に対するサンプルMF中の重量損失の比率)。Fig.4にMgOの粒度分布を変化させた場合の重量減少率の経時変化を示す。Fig.5にAndreasenの式における2時間後の重量減少率とq値の関係を示す。これらの図から,骨材を多く含むサンプルCCでは最も重量減少率が低下し,微粒子の割合が多いサンプルFCでは重量減少率が増加した。これらの結果に基づいて,MgO-C反応挙動に及ぼすMgOと炭素の粒径分布の影響について,反応モデルを構築することによって議論した。
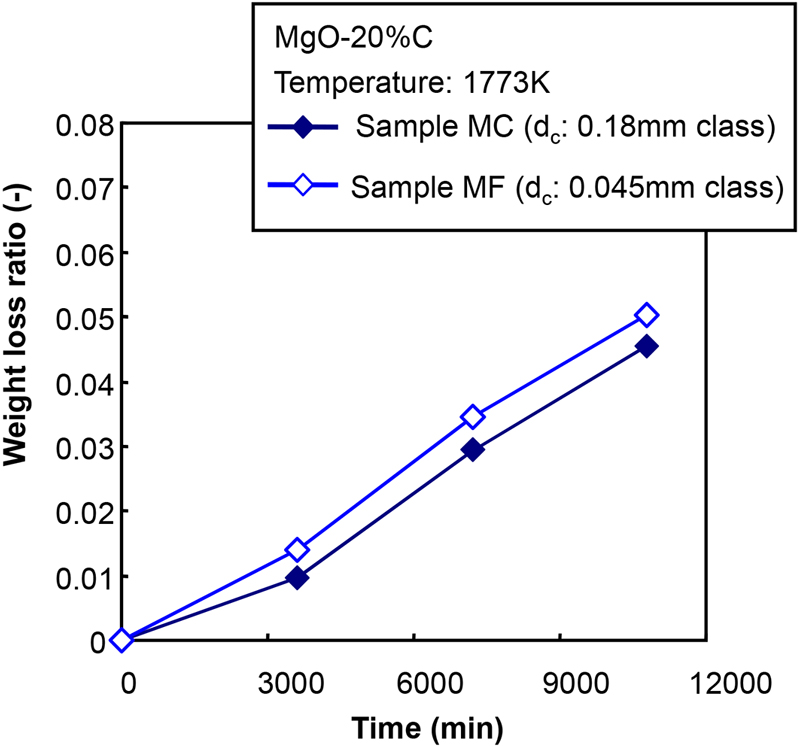
The changes of weight loss ratio with time at the conditions that the size of carbon. (Online version in color.)
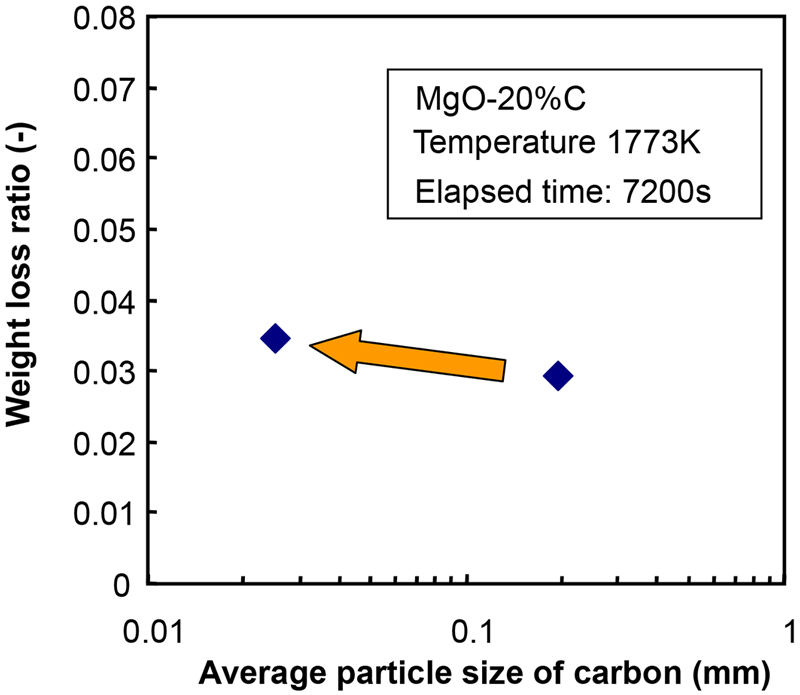
The relationship between weight loss ratio and average particle size of carbon. (Online version in color.)
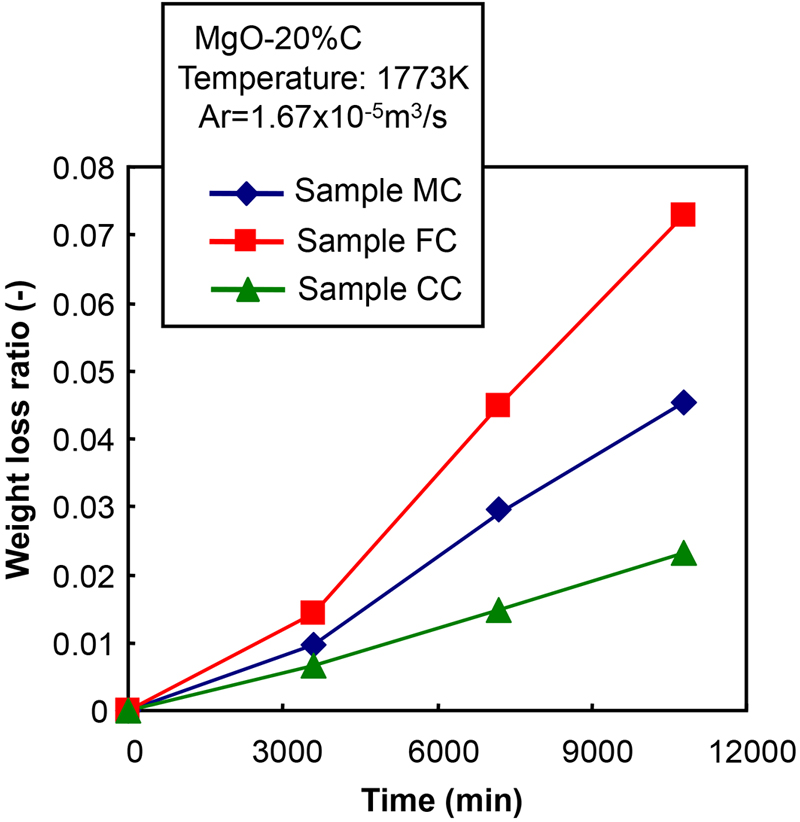
The changes of weight loss ratio with time at the conditions that the particle size distribution of MgO was changed. (Online version in color.)
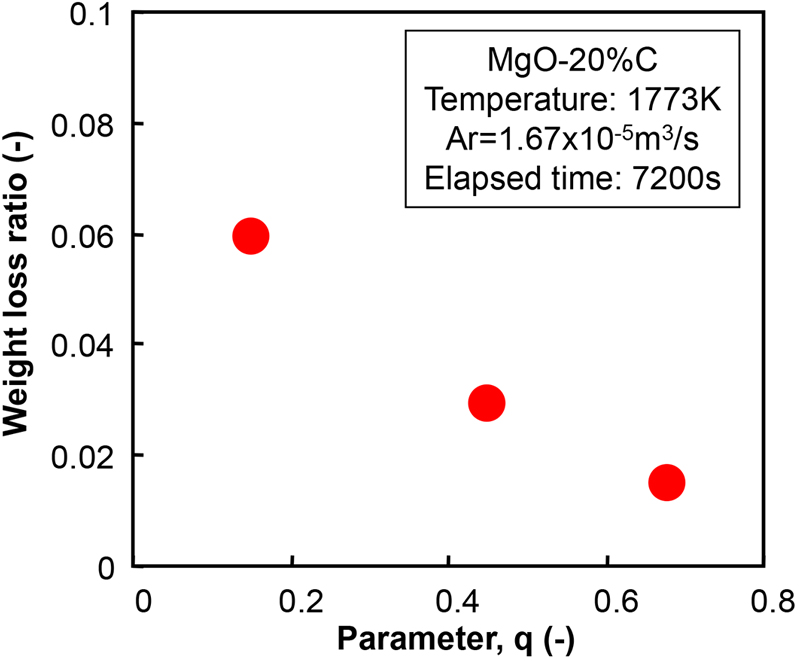
The relationship between weight loss ratio at the 2 hours of time passage and “q” value in Andreasen’s equation. (Online version in color.)
基本的には,本研究の反応モデルは前報にて提案したモデルを適用した(それゆえ,今回はモデルの詳細については割愛させていただくことにする)。一般的にMgO-C反応は式(2)で表される。
| (2) |
式(2)の反応は次の二つの反応に分けられる。すなわち,式(3)に示すCOガスによるMgOの還元,式(4)にて示されるCO2ガスによる炭素の酸化反応である。
| (3) |
| (4) |
Rongtiら22,23)および他の従来報告から,MgO-C反応は主として上記の二つの反応からなるものと考えることができる。本研究では,基本的には未反応核モデル24,25,26)を用いて,MgO-C反応挙動の解析を行った。式(3)と式(4)に基づく未反応核モデルの模式図をFig.6に示す。ここで,MgOと炭素粒子の形状は球状であると仮定した。前報における検討から,本研究の式(3)(4)の反応の律速段階は,2),6)に示される 反応界面(気体/固体)での化学反応の混合律速と考え,以降解析を行った。
4・2 反応速度式MgOの還元反応,カーボンの酸化反応速度は基本的に前報と同じであるため,反応速度の記述は概要のみとしたい。
4・2・1 MgO粒子径の減少式(3)の反応によるMgO粒子径の減少速度を考慮した。反応に伴うモル量の変化が生成物の量と等しくなるというマスバランスを考慮すると式(5)が成り立つ。
| (5) |
ここで,γMgO (mol/m3/s)はMgO粒子の反応速度,VMg(m3)は未反応核の体積,CMgO (Mol/m3)はMgOのモル量,rMg (m)はMgO粒子の半径である。式(5)を展開することによって式(6)が得られ,更に式(6)を展開することによって式(7)が得られる。
| (6) |
| (7) |
未反応核表面での反応は,上記の律速段階に関する仮定に従って,各プロセスについて定式化された。界面での化学反応が律速段階である場合,反応速度は式(8)で表される。
| (8) |
ここで,PCO2,PMg(atm)はCO2およびMgガスの分圧,aMgOはMgOの活量であり,本研究では1とする。式(3)の反応の平衡定数を計算すると,MgガスとCO2ガスの溶解度積は非常に小さい。式(8)の右辺第2項は無視することが出来,式(9)のように表される。
| (9) |
ここで,kMg(m/s)は,式(3)の反応速度定数を意味する。を代入する。式(9)を式(7)に代入してこの結果を積分すると,式(10)が得られる。ここで,RMg(m)は,MgO粒子の初期半径を意味する。
| (10) |
なお,耐火物試料中のMgO粒子数は,RMg,密度ρ(kg/m3)および初期試料の重量WMgO (initial) (kg)を用いて表すことができる。
| (11) |
したがって,時間Δt(s)後の重量減少量の変化は,式(12)のように算出することができる。
| (12) |
MgOの重量減少率変化の積算値は式(10)および式(12)を用いて算出した。
4・2・2 炭素の酸化反応炭素粒子径の減少速度もMgO粒子径の減少速度と同様に考えることができる。重量減少率は式(13)のように表される。
| (13) |
ここで,
| (14) |
である。最終的に,MgO-Cれんがの全重量減少率は,式(15)にて計算することができる。
| (15) |
これらの中で,化学反応の速度定数は式(16)で表されるArrheniusの式から導出した。ここで,k0およびEは,それぞれ速度定数および見かけの活性化エネルギーを表し,Table 3に示した著者らによる以前の研究結果より導出した値を本研究にも適用した。
| (16) |
| kMg | kc | ||
|---|---|---|---|
| Constant | k0 (mol/m2/s/atm) | 483360 | 29502 |
| Apparent activation energy | E (kJ/mol) | 348 | 296 |
前述したように,実際の耐火物は,Andreasenの式20,21)のような定義式で示されるように,mmオーダの凝集体からµmオーダの微粒子までの広い粒度分布である。従って,本研究では,粒径分布を考慮するためにMgO-C反応モデルを改良した。具体的には,改良モデルでは統計的分布関数を未反応核モデルと組み合わせた。
Gbor and Jia28)は,Co含有スラグ粒子のような粒子の拡散と反応速度への粒度分布の効果を調査した。粒子径分布を考慮した収縮コアモデルにガンマ分布関数を組み合わせた反応モデルを用いて反応挙動を解析した。その結果,未反応物質の割合は式(17)のように表される。
| (17) |
ここで,Dは粒径,f (D, t)は反応割合を表す関数,p (D)は確率密度関数である。本研究ではGborのモデルを参考にMgO-C反応モデルを改良した。この時MgOの反応速度(f (D, t))は,式(18)で表される。
| (18) |
Gbor and Jiaはこの確率密度関数にガンマ関数を適用したが,本研究では式(19)に示されるAndreasenの式を反応モデルに適用した。ここで,p (D)は累積確率関数である。
| (19) |
しかし,式(19)は累積分布を表すため,この式を確率分布式に置き換える必要がある。本研究では,式(20)の様に,累積分布をnセクションに分割して確率分布式とした。
| (20) |
式(18),式(20)を式(17)に代入し,式(21)を得る。
| (21) |
ここで,f (D, t)は,式(22)の様に置き換えることができる。ここで,Raveは,式(23)に定義される平均粒子径である。
| (22) |
| (23) |
最後に,MgOの重量減少率は式(24)で表される。
| (24) |
なお,式(4)に示す炭素の酸化速度についても同様の展開を行った。
4・4 改良反応モデルによる計算結果上記の実験条件とサンプル条件を改良反応モデルに適用して重量減少率を計算し,MgO-C反応挙動を解析した。
MgOの粒子分布を実際の分布に基づく4つのパートに分割した。したがって,セクション数はn=4となる。本研究では,MgOの粒子半径分布について,これらの4つのセクションの各々の中間半径を計算に適用した(R1:2.0 mm,R2:1.0 mm,R3:0.25 mm,R4:0.0375 mm)。ただし,計算結果がR4=0.0375 mmの条件下で実験結果と一致しない場合には,フィッティングパラメータとしてR4を変更した。炭素の粒子半径は,サンプルMC,CCおよびFCについてはRC=0.09 mmと仮定し,サンプルMFについてはRC=0.0025 mmと仮定した。ここで,式(3)(4)より,MgOの還元速度はCO消費速度に等しく,CO消費速度はCO2生成速度(=CO2消費速度)に等しい。更にCO2消費速度はカーボンの消費速度に等しいと考えることができる。これよりカーボンの消費速度(反応割合mol)はMgOの還元速度に相当すると考えることができる。
更に,本研究では4・3節での検討により,MgO,カーボンの総括的な反応速度は確率分布関数と反応速度の積で表されるとしており,その確率分布はAndreasenの式で示される。この確率分布は反応割合に相当するので,粒度ごとの反応割合はMgO,カーボンともAndreasen分布式に従うとして考察を進めている。以上の理由により,カーボンの反応割合はMgOの反応割合に相当すると考えた。
また,式(4)に示すカーボンの酸化割合は,各セクションのMgOの還元割合に等しいと仮定した。その他の計算条件は以前著者らが提案した反応モデルと同じとした。改良反応モデルを適用した結果として,それぞれサンプルMCとMFに対する計算結果と実験結果における重量減少率の比較をFig.7と8に示す。計算結果は実験結果と良く一致した。
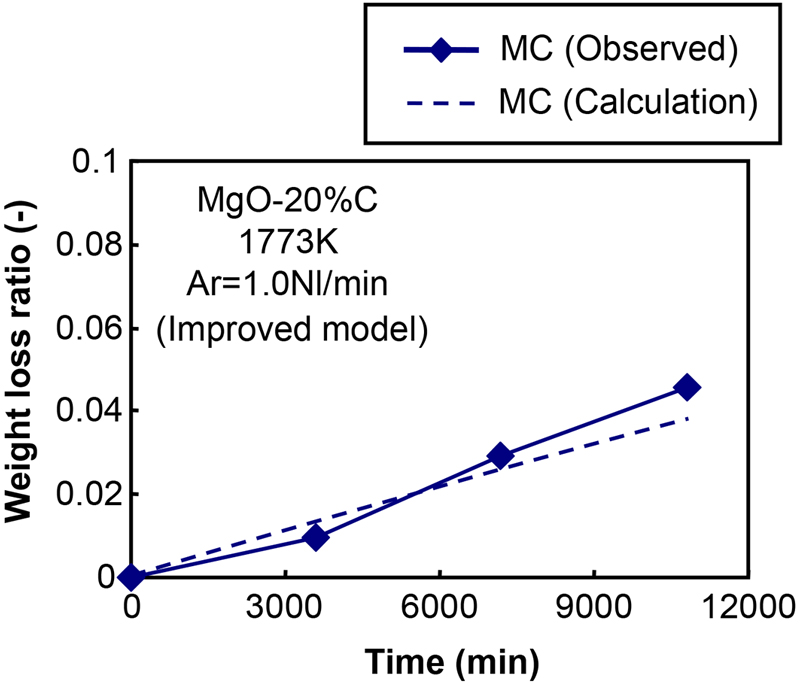
The comparison of weight loss ratio between calculation results and experimental results with regard to the conditions of “MC” as a result of applying to improved reaction model.. (Online version in color.)

The comparison of weight loss ratio between calculation results and experimental results with regard to the conditions of “MF”.
Fig.9に炭素の重量減少率と平均粒径の関係を示す。計算結果は実験結果よりわずかに低い値を示したが,計算結果における炭素粒子径の変化に対する重量損失比の変化の傾向は実験結果と全く同様であり,MgO-C反応に及ぼす炭素粒子径の影響はこの改良モデルを適用することによって定量的に説明できることを示した。さらに,改良した反応モデルによる計算結果から,MgO-C反応挙動に及ぼす炭素粒子径の影響は比較的小さいと予測される。例えば,炭素粒子径が1 mmから0.01 mmに減少しても,重量損失比の増加は高々25%である。この結果は前報で論じた計算結果とほぼ同様であった。
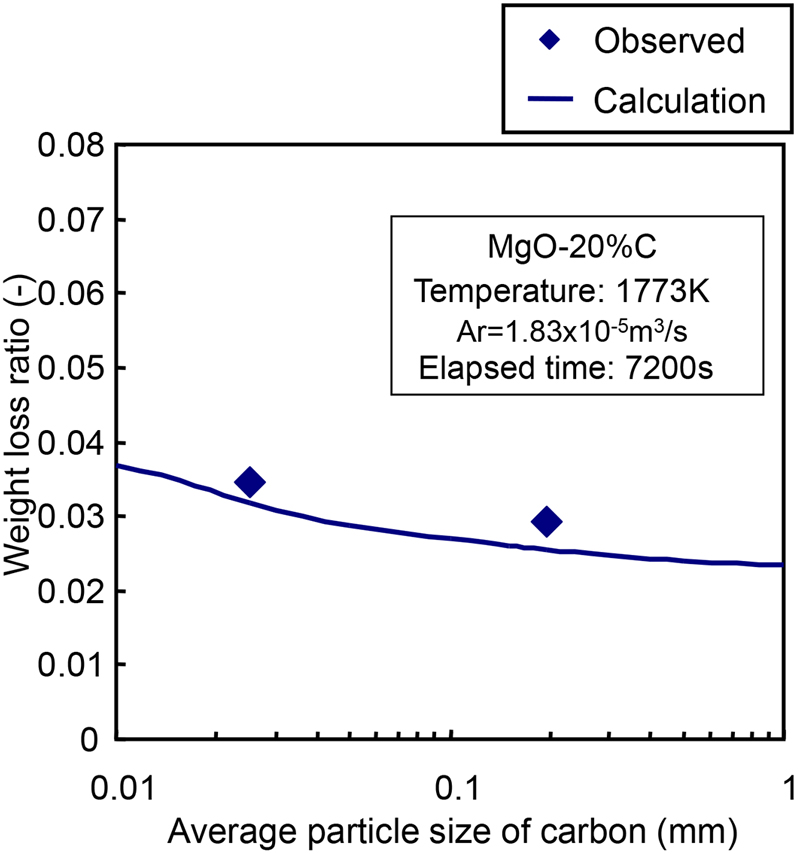
The relationship between weight loss ratio and average particle diameter of carbon.
Figs.10,11にそれぞれサンプルCCとFCについての計算結果と実験結果における重量減少率の比較を示す。計算結果はサンプルCCの実験結果(Fig.10)とおおよそ一致していたが,サンプルFC(Fig.11)の場合は計算結果が実験結果よりもはるかに大きくなった。そこで,微粒子半径R4の値をパラメータとして変えてパラメータフィッティングを試みた。その結果,R4の値を0.0875 mmと仮定した場合の計算結果が実験結果とよく一致することがわかった。

The comparison of weight loss ratio between calculation results and experimental results with regard to the conditions of “CC”.
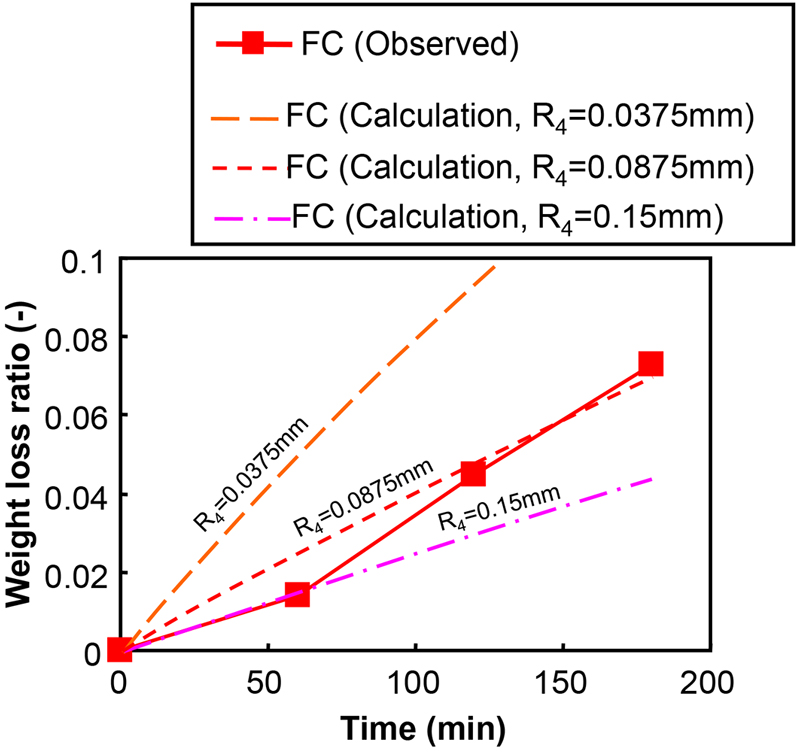
The comparison of weight loss ratio between calculation results and experimental results with regard to the conditions of “FC”.
この理由について以下の様に検討した。試料FCの微粒子含有率は58%と他の試料に比べて非常に高いため,1 773 Kでの加熱,および高温保持時に焼結により微粒子が凝集することにより,見掛けの微粒子径が増大する可能性がある。Fig.12に,1 773 Kで1時間加熱したサンプルMCおよびFCのSEM観察結果を示す。サンプルMCでは,小孔(small pore)と粒子間の狭い空間(narrow space)が観察された。また,MgO粒子も一部観察された。このことから,このサンプルではサンプルFCに比べると,MgOの焼結それほど進行していない,仮に進行していてもその可能性は低いと推定される。これは,サンプルMCのMgO微粉の割合がFCに比べると少ないため,焼結の駆動力である表面エネルギーが小さいためと推定される。

The result of SEM observation of sample “MC” and “FC”.
逆に,サンプルFCでは,Fig.12に示されている様に,MgO粒子の凝集が表面にて観察された。しかし,サンプルMCに見られるようなsmall poreやnarrow spaceや明らかなMgO粒子の存在はあまり観察されなかった。サンプルFCの反応表面積がMCよりも大きいため,表面エネルギーはMCよりも大きいと考えられる。これより,MgO-C反応の進行とともに,よりMgO微粉がお互い凝集して焼結が起こっていると推定される。
この現象は見掛けの微粒子径を増加させ,その結果,反応界面面積が減少し,実際の反応速度は反応モデルによって予測されたものより低くなったと推定される。
固体粒子からなるセラミックスの焼結挙動や焼結機構は広範に研究されており,種々の焼結モデルが提案されている29)。本研究で提案した改良MgO-C反応モデルは焼結挙動を考慮していないため,実験結果の一部を説明できない。従って,この反応モデルに焼結モデルを組み合わせて反応モデルをさらに改良することが今後の課題である。これには,反応モデルの再構築,焼結の駆動力の決定およびある性質の決定のような多くの課題が生じると予想される。さらなる議論は本研究の範囲を超えているが,これらの因子を明らかにする研究が今後期待される。
本研究では,MgO-C耐火物中のMgO-C反応挙動に及ぼすMgOと炭素の粒径分布の効果を4種類のMgO-Cサンプル耐火物を調査し,未反応核モデルを統計分布関数と組み合わせた改良MgO-C反応モデルを用いて反応機構を定量的に議論した。結果を以下に示す。
(1)MgO微粒子の割合が増加するとAndreasen式のq値は減少し,MgO-C反応速度は増加した。
(2)MgO-C反応速度は炭素粒子の微細化により増加したが,重量減少率の増加割合は14%程度であり,特に大きくはなかった。
(3)未反応核モデルと統計的分布関数を組み合わせた改良MgO-C反応速度モデルを構築した。改良モデルはMgO-C反応速度に及ぼす耐火物の粒径分布の影響を考慮し,MgO-C反応に及ぼす炭素粒径の影響を説明できる。
(4)MgO-C反応に及ぼすMgO粒径分布の影響もこのモデルを用いて検討した。MgO-C反応挙動は比較的大きな骨材比率の条件下ではモデル計算結果と実験結果はほぼ一致した。しかし,微粉の割合が大きい場合,モデル計算結果は実験結果よりもはるかに大きくなった。この理由として,加熱中に微粒子同士が焼結し,その結果,微粒子MgOの見かけの粒径が大きくなることが推定される。