2022 年 62 巻 3 号 p. 159-164
2022 年 62 巻 3 号 p. 159-164
原子間力顕微鏡(AFM)は1細胞から多細胞系へその計測対象を広げている.本稿では,単層細胞と初期発生胚を例にし,多細胞系のAFM力学計測の現状と課題について解説する.AFMは多細胞系の力学特性を1細胞レベルで捉えることができる.多細胞系のレオロジー計測に必要なAFM技術を整理する.

Atomic force microscopy (AFM) provides a less invasive approach to characterize mechanical properties of single cells and multicellular systems without any treatment. A variety of AFM nanoindentation techniques has been developed allowing to quantify the mechanical properties of cells and to explore the spatial and/or temporal dynamics of single cell stiffness in multicellular systems such as cell monolayer and developing embryo. This commentary addresses the reliability and limitations of the present AFM to obtain the universal and specific features of cell mechanical properties in multicellular systems.
原子間力顕微鏡(AFM)は,生細胞の形態観察や力学物性計測に広く用いられている.AFMは,1986年に発明され,その約6年後には,すでに1細胞の定量力学マッピング測定1)が実現された.現在,AFMの測定対象は1細胞から多細胞へと広がり,AFMは組織形成や胚発生のメカニクス(メカノバイオロジー)研究に不可欠なツールになりつつある.本稿では,1細胞研究を通じて培われてきたAFMの細胞力学計測法2)を述べた後,多細胞系のAFM力学物性計測の現状と今後の課題について述べる.
AFMは,空間位置とカンチレバーのたわみ量を高精度に制御・計測できる装置である.この特徴を利用して,様々な細胞力学計測法が提案されている.本節では,細胞力学計測用のAFMの利点や課題について整理したい.
AFMの細胞力学測定では,カンチレバーの自由端側に装着したプローブ(探針や微小球)を細胞に押し込み,その局所領域における押込み力Fと押込み深さδの関係から弾性率を導出する2),3)(図1a).ここで,Fは,カンチレバーのたわみ量dを用いて,フックの法則(F = kd,kはカンチレバーのばね定数)から決定する.カンチレバーのたわみ量は,カンチレバー背面に照射したレーザー光の反射角の変化を分割フォトディテクターで検出する方法(光てこ法)が広く用いられている.また,熱振動により生じるカンチレバーの振幅を測定し,そのバネの平均の位置エネルギーがエネルギー等分配則に従うことを利用して,カンチレバーのばね定数を決定することができる.
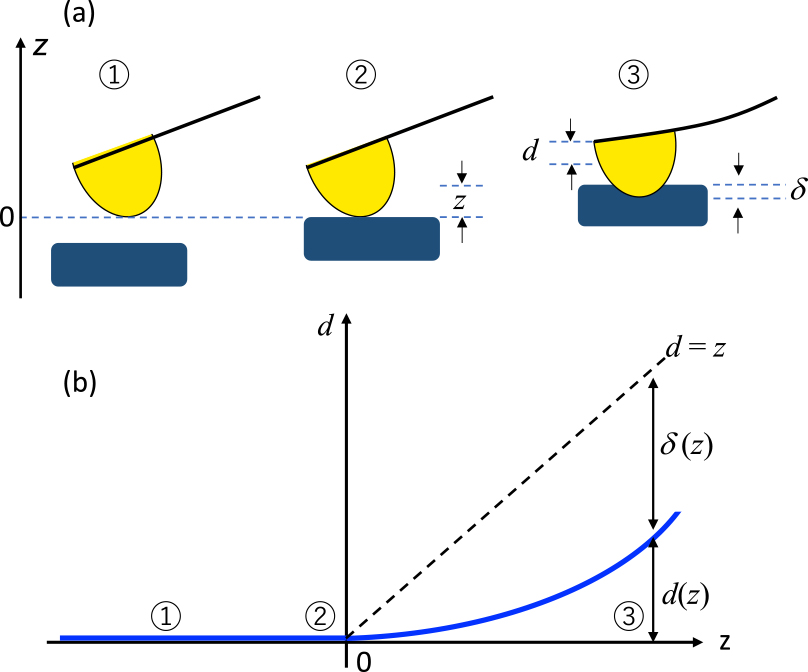
(a)AFM測定の原理.AFMはzピエゾの位置とカンチレバーのたわみ量を精密に計測できる装置である.(b)フォースカーブの模式図.
動物細胞では,通常,Fは1 nN程で制御され,そのプローブの押込み深さは1 μm程,プローブとサンプルの接触面積は数μmである.このような条件では,細胞への間欠的な押込みに対して,細胞の形態をほとんど変化させずに測定が可能である.つまり,細胞内骨格構造を大きく破壊することなく低侵襲な測定が可能である.また,先鋭化した探針を用いると,細胞表層近傍に存在するアクチン線維を弾性率像から可視化できる.このように,低い侵襲性と高い空間分解能が,AFMの大きな利点である.
zピエゾ(サンプル)の位置zとF(またはd)でプロットされる曲線をフォースカーブと呼ぶ(図1b).弾性接触理論を用いてFとδの関係を解析し,弾性率を導出する2),3).細胞は粘弾性体であるので,フォースカーブ測定で見積もられる弾性率は,AFMの測定条件(押込み速度等)に依存する.したがって,この“見かけ(apparent)”の弾性率(弾性率の中で,特にヤング率を算出することが多い)の値は,細胞本来の物性値ではないが,測定条件が同じであれば,相対的な比較は可能である.フォースカーブ測定は,その測定や解析の簡便さから,最も広く用いられている測定モードの1つである.
AFMで直接測定する量は,d(またはF)とzであるが,弾性率の解析に必要なδは,フォースカーブからプローブと細胞表面の接触位置を決定して初めて求まる値である.細胞のような柔らかいサンプルでは,プローブ・サンプル表面間の接触位置の決定に不確定さが含まれやすい.F = 0近傍の力信号(カンチレバーのたわみ量)がノイズ(カンチレバーの熱振動など)に埋もれやすいからである.この接触位置決定の曖昧さが,AFMによる細胞計測における主要な誤差の1つである.
細胞のような粘弾性サンプルでは,Fに対してδに時間遅れが生じ,押込みと引き戻しの往復のフォースカーブにヒステリシスが現れる.このヒステリシスを丁寧に解析できれば,細胞の粘弾性を導出できるはずである.この課題について,ボルツマンの重畳原理を往復のフォースカーブ解析に利用した手法が提案された2),4).緩和弾性率(時間に依存する弾性率)の関数形が既知であれば,往復フォースカーブの解析は原理的に可能で,実際,1細胞の粘弾性(レオロジー)解析に成功した4).この往復フォースカーブ測定法は,プローブと細胞表面の吸着力の影響が小さい場合に有用である.
弾性率の関数形を直接決定するには,時間領域または周波数領域の測定が不可欠である.時間領域測定として,応力緩和測定とクリープ測定がある.バルク材料の応力緩和測定は,サンプルのひずみ一定下(ε0)で応力σ(t)の時間変化を測定し,緩和弾性率E(t)(σ(t) = E(t) ε0)を求める.クリープ測定では,応力一定下(σ0)でサンプルひずみε(t)の時間変化を測定し,クリープコンプライアンスJ(t)(ε(t) = J(t) σ0)を求める.
AFMの時間領域測定もバルクのそれに似ている(図2)2).AFMの応力緩和測定では,一定の押込み深さでカンチレバーを停止し,その後,押込み力F(t)の時間変化を測定する.また,AFMのクリープ測定では,一定の押込み力で,押込み深さd(t)の時間変化を測定する.応力緩和測定は,押込み力が減衰する長時間領域の緩和測定の精度が落ちる.また,クリープ測定は,時間と共に押込み深さが増加し細胞への侵襲度が比較的大きくなる.これらの点に注意しながら,いずれかのAFM時間領域測定法が用いられている.
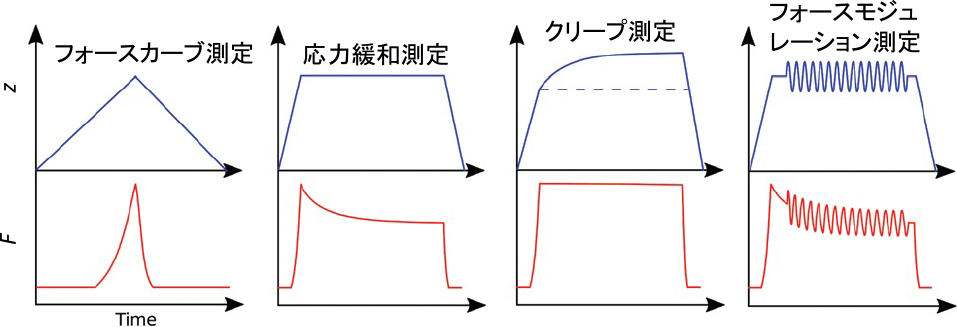
AFMの細胞力学計測方法.左から,往復フォースカーブ測定,応力緩和測定,クリープ測定,フォースモジュレーション測定のピエゾ位置(上段)と押込み力(下段)の関係.横軸は時間.
周波数領域のAFM測定法は,フォースモジュレーション法と呼ばれる.細胞に押込んだプローブを一定の周波数(カンチレバーの非共振周波数)で励振して,カンチレバーの振幅と位相変化から細胞の複素弾性率(周波数に依存する貯蔵弾性率と損失弾性率)を求める方法である2)(図2).励振周波数は,1kHz以下で行われることが多いが5),高速AFMを用いて高周波数領域の複素弾性率も測定されている6).動物細胞の複素弾性率の周波数特性を短時間で評価する方法も提案され,周波数に依存した弾性率のマッピング像を取得することも可能になってきた7),8).AFMで測定されるマイクロスケールの細胞レオロジーと細胞小器官の構造との関係など,未知な点が多く,今後の課題である.
細胞は,周りの力学的環境に依存して自身の力学物性が変化する.例えば,硬い基板(基質)上に播種した細胞は硬くなり,また,柔らかい基質上の細胞は柔らかくなる9),10).そして,そのような力学応答は様々な細胞機能と密接に関係している11).一方で,多細胞系の細胞と細胞の間に生じる力学応答は,1細胞と基質の間の力学応答に比べて不明な点が多い.例えば,多細胞系を構成する細胞ごとの硬さは隣接の細胞の硬さにどのような影響を及ぼしているのだろうか?このような基本的な問いに対して,広範囲マッピングが可能なAFMを用いて調べることができる12).
単層細胞(イヌ腎臓尿細管上皮細胞,Madin-Darby canine kidney cell)をAFMで測定すると,細胞の硬さは空間的に不均一性を有していて,その硬さ分布はランダムではなく,細胞サイズを超える長距離相関性をもつことが分かる(図3a).つまり,単層細胞内の個々の細胞の硬さは,隣接細胞の硬さを感じて,その値に近づく傾向をもち,結果的に,特徴的なサイズをもつ力学的なドメイン構造を形成するのである.
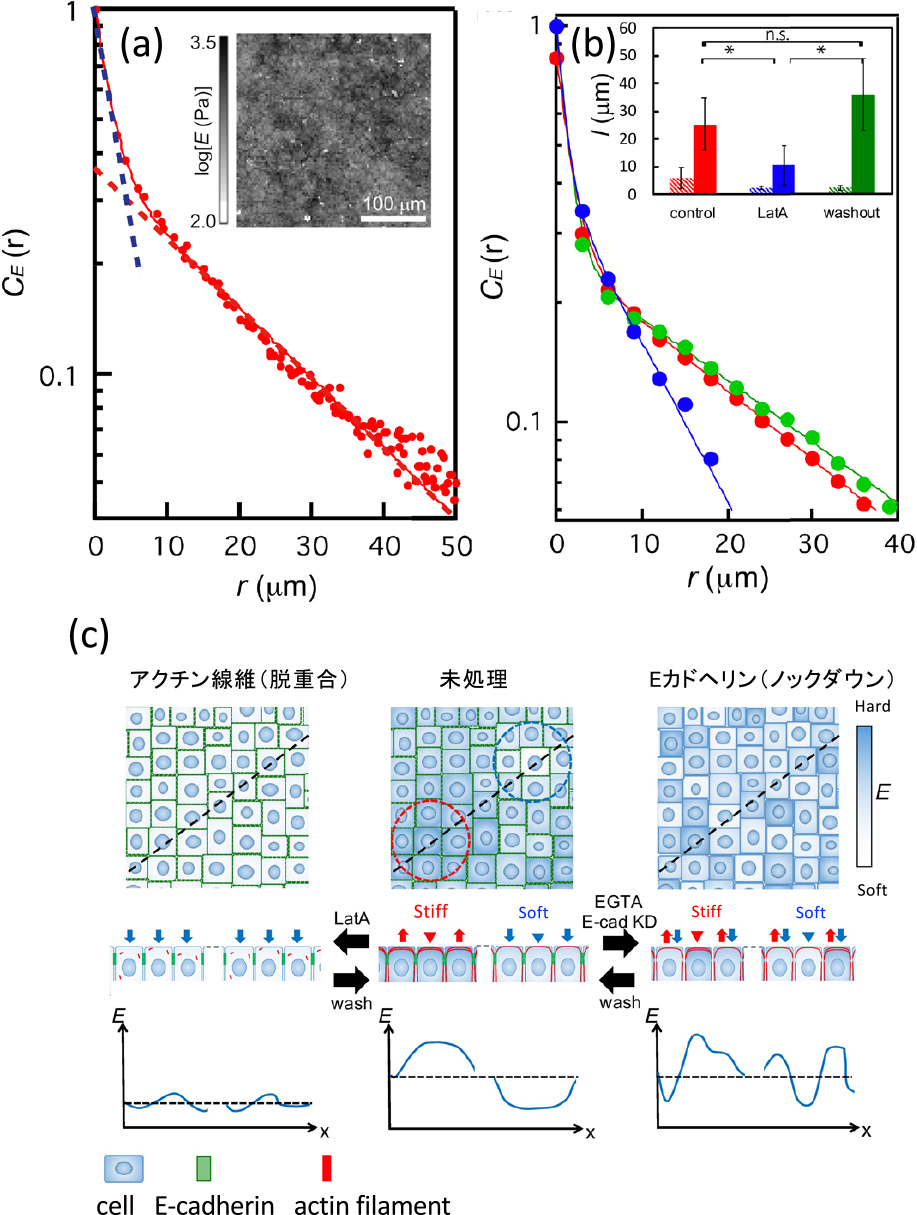
(a)単層細胞の弾性率の空間相関関数CE(r).点線は短距離および長距離の2つの指数関数の内挿曲線.挿入図はAFMによる弾性率マッピング画像.(b)アクチン線維脱重合(LatA)と再重合(washout)におけるCE(r).各条件において,左が短距離の相関長,右が長距離の相関長.短距離の相関長は条件に依存せず,長距離の相関長が変化する.(c)アクチン線維脱重合およびEカドヘリンノックダウンによる弾性率の空間特性の模式図.文献12より一部転載.
この細胞の硬さの空間相関性はアクチン繊維構造に関係していて,アクチン繊維を脱重合すると長距離相関性は消滅し,その後,アクチン線維を再重合すると長距離相関性が再生成する(図3b).これらの結果から,アクチン線維のネットワーク構造が力学的な長距離相関性を生み出し,その構造は自発的に形成されることが分かる.また,細胞間接着分子の1つであるEカドヘリンをノックダウンすると,この長距離相関性が有意に減少し,細胞間の長距離相関性は,主にEカドヘリンを介して制御されていることが分かる(図3c).
単層細胞内の細胞・基質間に働く牽引力から単層細胞の内部応力を解析する単層応力顕微鏡測定法がある13).この方法は,すべての細胞の弾性率が一定であるという仮定のもと,内部応力を解析するが,上述のAFM測定の結果のように,実際の単層細胞内の細胞の硬さは,空間的に不均一である(図3).したがって,AFMと単層応力顕微鏡法を相補的に利用できれば,多細胞系の内部応力の更なる精密測定が可能になると期待される.
単層細胞のように比較的平らなサンプルとして,スライスした組織14)のAFM測定例も報告されている.このような系においても,ここで紹介した広範囲測定が可能なAFMは有用であると考えられる.
3.2 発生胚胚の形成において,細胞の張力や弾性率が重要な役割をしていると考えられている15)-17).形態や内部構造が大きく変化する胚形成の力学メカニズムを解明するには,胚形成過程の力学挙動をリアルタイムで追跡することが求められる.
発生胚の張力を1細胞レベルで測定する方法として,レーザーアブレーション法18)が広く用いられている.この方法は,パルスレーザー光を細胞内や細胞境界に集光し,局所的損傷時の形態変化速度から張力の相対比較を高精度で行うことが可能である.一方で,本質的に損傷を与える計測方法であるため,発生過程の張力の長時間追跡は実現していない.
発生胚の弾性率を高い空間分解能で測定する方法として,液滴を用いる方法19)-21)が提案されている.この方法は,微小な油滴19)や磁性液滴20),21)を発生胚に注入し,前者では油滴の形状,後者では外部磁場に対する液滴形状の応答から,発生胚の弾性率を導出する20),21).液滴サイズや液滴数を制御できれば,1細胞内の弾性率や空間分布を測定できる可能性があるが,時空間測定は未だ実現していない.
AFMは,前述の通り,比較的低侵襲かつ高分解能で力学物性を計測できるので,原理的に発生胚の弾性率を追跡することが可能である.近年,AFMを用いて,スライス等をしない胚脳22),23)や初期発生胚24)の力学物性の時空間挙動を測定できることが報告されている.以下では,初期発生胚の測定結果をもとにAFM計測の現状と課題を述べる.
AFMを用いて発生胚の力学物性計測を実現するために,少なくとも3つの要素技術が必要とされる.1つ目は,正立型光学顕微鏡と一体化したAFM12)である.市販のバイオAFMは,培養ディッシュ上の細胞を測定できるように倒立型光学顕微鏡と一体化されているものが多いが,発生胚のように厚みのあるサンプルに対しては,AFM測定前後に,正立型光学顕微鏡でサンプルの上面を明視野観察や蛍光観察ができることが望まれる.これは脳発生の計測においても同様である22),23).
2つ目は,弾性率の測定値の補正25)である.AFMの弾性率測定では,平坦なサンプル表面に対して垂直にプローブを押し込む弾性接触理論が用いられるが,このモデルは,発生胚のように大きな表面傾斜が存在するサンプル(図4a)では破綻する.厄介なことに,柔らかいサンプルでは,フォースカーブの関数形は変化せず,弾性接触理論で計算した弾性率は過小評価される(図4b)25).この問題に対して,サンプル表面の傾斜角を直接測定し,弾性率を較正する方法が提案された25).AFMは,弾性率像と同時にサンプル表面の形状像を測定することができるので,形状像から表面傾斜角を算出し,その傾斜角を利用して弾性率を較正できる(図4c).
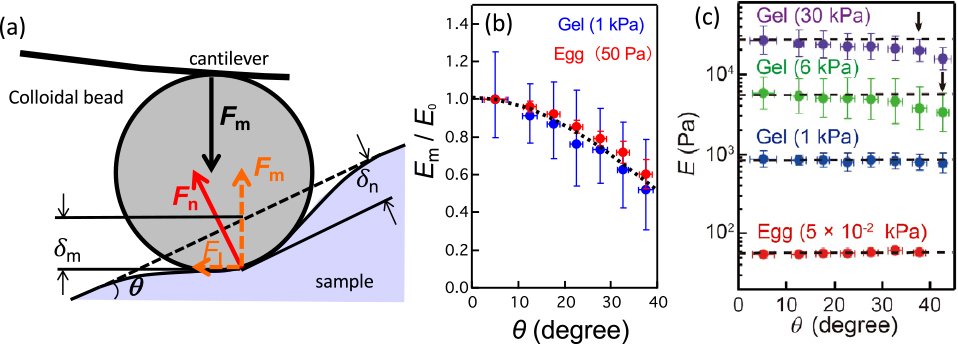
(a)表面傾斜が存在する場合の押込み力の模式図.(b)傾斜角θに対するHertzモデルで算出したヤング率(カタユウレイボヤの未受精卵(約50 Pa)とゲル(約1 kPa)).(c)傾斜角を考慮した解析式によるヤング率の較正結果.文献25より転載.
3つ目の課題も表面形状に関係するもので,カンチレバーとサンプルの立体障害に関する問題である.市販のカンチレバーの探針長は数μmである.したがって,それ以上の表面形状の凹凸をもつサンプルを測定するには,探針長を長くするなど工夫が必要になる.その解決方法の1つとしてマイクロビーズを直列化したカンチレバープローブ24)が提案された(図5a).これらの要素技術により,AFMの発生胚の力学物性を追跡することが可能になった24).

(a)ダブルコロイドプローブカンチレバー.(b)発生胚の光学顕微鏡写真・モデル図・形状像・弾性率像.(c)動物極側のAFMの形状像(H)とヤング率像(E).(d)動物極側の発生過程の弾性率変化の模式図.文献24より転載.
AFMによる初期発生胚の測定には,脊索動物のモデル動物の1つであるカタユウレイボヤ(ホヤ)が用いられた.AFMでホヤ初期発生胚のフォースマッピング測定を行ってみると,形状像と弾性像は,個々の細胞を明瞭に反映し,その細胞の形状は発生胚の表層細胞の形状とよい一致をする(図5b).つまり,AFMで測定される発生胚の力学特性は,AFMプローブを押込んだ表層細胞の弾性率を強く反映していることが分かる.
AFMプローブで押している細胞の周囲の細胞や組織も多少なりとも変形するであろう.したがって,サンプルによっては,その変形の影響を考慮した解析が必要になることもあろう.現在,このようなAFMで測定している周囲の変形を考慮した解析法は,1細胞と基質の変形において提案されている26).
AFMで測定される発生胚の力学物性は,in vitroの1細胞や単層細胞といくつかの点で類似の性質を示す.例えば,発生胚の弾性率は細胞の真上で測ったときよりも細胞境界で測ったときの方が硬く(図5c),単層細胞12)(図3a)と同様な分布をしている.細胞分裂の際,細胞全体および収縮環が硬くなり,細胞分裂後,細胞全体が柔らかくなる(図5c, d).これも,1細胞の細胞分裂の力学挙動27),28)と類似している.これらの結果は,AFMを用いて発生胚の割球の皮層アクチンの構造変化を捉えていることを示唆しており,実際,アクチン繊維を脱重合すると発生胚の有意な軟化が観測される24).
また,発生胚の微小管を重合阻害し,細胞分裂を停止しても,上記の細胞分裂時の細胞硬化と軟化の力学的振動現象は明瞭に計測され続ける.これも1細胞のダイナミクスで見られる現象と一致している29).
一方で,植物極側では,発生胚に固有の力学挙動がAFMで観測されている.非分裂時に細胞硬化が1細胞単位で起こり,その硬化が隣接細胞に伝播する現象である.具体的には,例えば,図6に示すように,植物極側の32細胞期において,隣接するA6.1細胞とB6.1細胞に着目すると,これらの細胞はほぼ同時に細胞分裂を起こす.しかし,細胞分裂後,A6.1細胞の分裂細胞(A7.1とA7.2)は速やかに軟化するのに対し,B6.1細胞の分裂細胞(B7.1)は分裂後も細胞の硬化を維持する(図6a, b).その後,発生ステージが進むにつれて,硬化を維持した細胞(B7.1細胞)に隣接する細胞(A7.1細胞),そして第2近接の細胞(A7.2細胞)へと細胞分裂を伴わずに1細胞レベルで硬化が伝播する(図6b).

(a)植物極側のAFMの形状像(H)とヤング率像(E).(b)植物極側の発生過程の弾性率変化の模式図.(c)細胞内局所領域から硬化が生じる過程のAFM像.文献24より一部改変.
この細胞硬化は,細胞内の局所領域から進行することがAFM測定で捉えることができる(図6c).このような植物極側の発生胚の空間挙動は単層細胞のそれと決定的に異なる.単層細胞では,空間的に不均一な弾性率分布12)を有するが,それは1細胞レベルではなく,複数の細胞を含むドメイン構造として存在していた(図3).
上記の非分裂期の植物極側において,頂端(apical)領域と基底外側(basolateral)領域にミオシンの集積が起こり,Rhoキナーゼ(ROCK)を阻害すると,頂端領域においてのみミオシンの集積が阻害されることが知られている30).このROCK阻害の状態において,AFMでは,発生胚の細胞が有意に軟化することが観測されている24).つまり,AFM測定では,頂端領域のミオシン集積の有無を選択的かつ非破壊的に測定しているのである.
興味深いことに,この細胞期において,染色画像のミオシン濃度は比較的均一30)に分布していることである.これらの結果は,AFMで観測される細胞硬化は,アクトミオシンの密度変化によるのではなく,その構造形成の変化に起因していることを示唆する.このように,AFMは発生胚の表層の力学特性を選択的に測定でき,蛍光顕微鏡計測と相補的な手法であると言える.
AFMはレオロジー計測が可能である(2章).今後,AFMを用いて発生胚のレオロジーの時空間挙動が1細胞レベルで明らかになるであろう.そのような力学物性の時空間情報は,発生胚のモデル構築に利用できると期待される.
AFMの細胞力学計測の基礎原理と,単層細胞および発生胚を例として,多細胞系のAFM計測の現状と課題について述べた.1細胞のAFMレオロジー計測技術は,この10年程で洗練されてきた.一方で,多細胞系のAFM力学計測は,まだ始まったばかりである.組織形成や発生胚を広範囲で計測できる高速化技術や,様々な表面粗さをもつ多細胞系サンプルを計測できる長針プローブ技術の開発は急務である.1細胞計測ではマイクロパターン基板を用いた技術が有用であるが,多細胞系のAFM計測に適したサンプル調製法・固定法の開発も重要な課題である.AFMは,表層のメカニクスを選択的に高精度に計測でき,他のメカニクス計測技術・観察技術と相補的な情報を提供する.1細胞から組織の生命機能の力学的メカニズムの理解に,AFMは益々重要な技術の1つになるであろう.
北海道大学・大学院情報科学研究院・細胞生物工学研究室のメンバーに感謝したい.本研究の一部は,藤田恭之教授(京都大),堀田耕司准教授(慶應大)との共同研究である.また,本研究は,日本学術振興会および文部科学省の研究支援により実施したものである.ここに深く感謝する.