2022 Volume 62 Issue 5 Pages 280-284
2022 Volume 62 Issue 5 Pages 280-284
真核細胞は細胞環境に応答し,ゲノムを内包する細胞核(核)のサイズを変化させる.では細胞は,どのように環境を感知し,核のサイズとその機能を調節しているのだろうか?本稿では,核内外の物理的環境に応答した核サイズ変化の特徴とその背後の制御機構や生理学的機能について,最新の研究成果を交えて紹介する.

The eukaryotic cells can change the size of the cell nucleus, including the genomic DNA, depending on the environment surrounding the cell nucleus. How cells can scale the nuclear size by sensing the environment has remained an enigma for over a century in the field of cell biology. Here, we found a general scaling rule of nuclear size to cell size among eukaryotes and another new aspect for size scaling to the chromatin status inside the nucleus. In this review, I describe the known mechanisms underlying these size scaling characteristics and discuss putative physiological significances for the size scaling.
真核細胞は遺伝情報であるゲノムDNAを細胞核(以降,核と呼ぶ)に格納する.核は,核膜と呼ばれる二層の脂質膜により,ゲノムDNAを細胞質から隔離することで,遺伝情報の複製やmRNAの転写のような機能に最適な場を作り出している.そのため,細胞周囲の環境変化に合わせて,細胞は,機能に直結する核の大きさ(サイズ)を適切に調節しなければならない.では,細胞は適切な核のサイズを知っているのだろうか.この問いに対して,1世紀以上も前から様々な生物種の核が観察され,大きな細胞は大きな核をもつ,という核サイズの特徴が示されている1).その後21世紀になり,分子生物学の手法により得られた酵母の細胞サイズ変異体が解析され,細胞体積の変化によらず,細胞体積に対して核は分裂酵母で8%,出芽酵母で10%の一定比率を維持する定量的特徴が示された2),3).この核と細胞の体積比率(以降,「N/C体積比率」とする)一定の法則性は,あたかも真核細胞が生物種特有の核の「黄金」比率を知っており,細胞環境に応答しながら核のサイズを調節するしくみを備えていることを物語っている.本総説では,真核生物種が有する核のサイズの特徴と,それを制御する分子機構について,筆者らの研究成果を中心に概説する.
真核生物の細胞分裂後の体細胞は,一般的に細胞全体のサイズに加え,核のサイズをも継続的に増大させる.例えば,酵母は,分裂後の間期に細胞と核サイズが同じ速度で増大するため,細胞周期を通してN/C体積比率が常に一定に保たれる2).また,近年筆者は,論文中に記載された測定値の収集や,掲載された細胞の画像を自ら測定することで得た,合計600以上の生物種や細胞種のデータを用いて,生物種横断的に間期の核と細胞のサイズの比較解析を行った4).その結果,真核生物種さらには核様体を有する原核生物種を含めた,多様な生物種において,核(および核様体)の体積は細胞の体積に対して正の相関関係を示すことが明らかとなった4),5).その一方で,核の体積は細胞の体積に対して,単純な比例関係ではなく,0.8-0.9乗に比例する「べき乗則」を示した4)(図1).この生物種間データの法則性は,細胞体積が増加すると,N/C体積比率を一定ではなく,少し小さくしながら,核サイズを増加させる,という核サイズの定量的特徴を示している.このように,細胞サイズに合わせて核サイズを制御する現象自体は,生物種横断的に広く保存されているが,N/C体積比率の値やその制御機構は生物種や細胞種ごとに調節されていることが想定される.
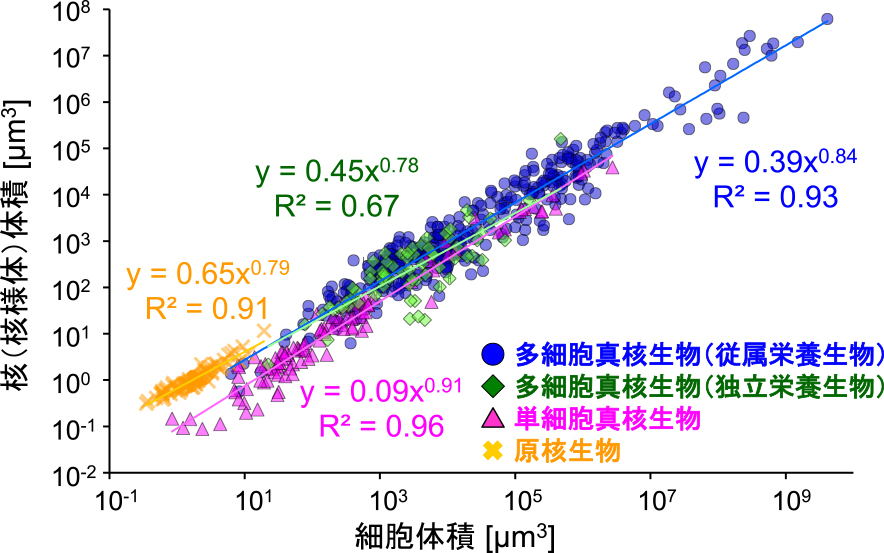
複数の生物種から収集した核体積と細胞体積の散布図と,それぞれの生物種グループごとの累乗近似による回帰線と近似式(文献4より改変).
では,真核細胞はどのように細胞サイズを「感知」し,核のサイズを制御するのであろうか.このしくみの理解には,アフリカツメガエルXenopus laevisの卵細胞質抽出液を用いた,核の無細胞再構成系による解析が大きく貢献してきた.この実験系では,X. laevisの未受精卵から間期の細胞質抽出液を分画し,精子クロマチン(精子を脱膜処理したもの)を加え培養する.精子由来のクロマチンは次第に膨潤し,培養開始約40分後には,クロマチンが核膜に包まれた核が再構成される(図2A).その後,核内のゲノムDNAは複製され,核は継続的に増大する(図2A).典型的な濃度の精子クロマチン(約200精子クロマチン/μl)を混合した細胞質抽出液を試験管内で培養すると,培養初期段階では,核のサイズは培養時間に比例するように増大する(図2B青).培養時間を長くすると,核サイズの増大速度は次第に低下し始める.そこで,筆者らは精子クロマチンを典型条件よりも高い濃度で培養したところ,培養初期の再構成核のサイズ増大速度が低下し,さらに培養継続に伴う増大速度の低下も通常より早期に検出されることを見出した6)(図2B緑).その反対に,精子クロマチン濃度を典型条件よりも低くすると,初期の再構成核のサイズ増大速度の上昇が観察された6)(図2B黄).
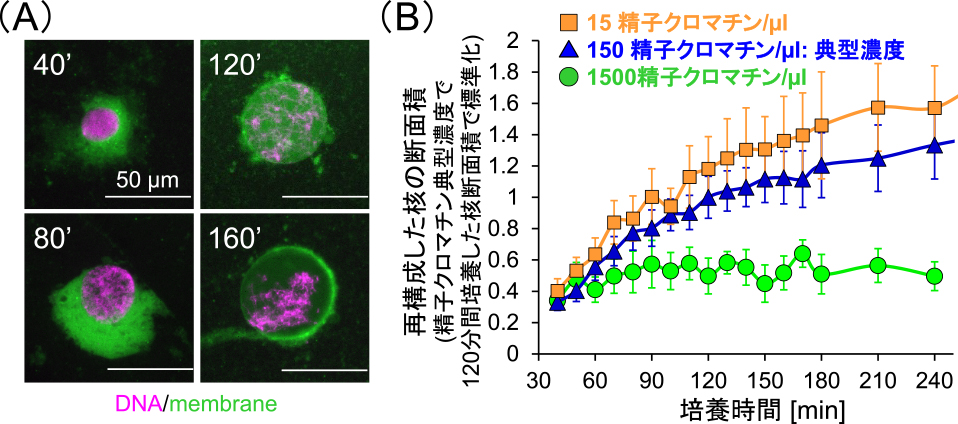
無細胞再構成した核の蛍光観察画像(A)と培養した精子クロマチンの濃度変化条件における核断面積の増大ダイナミクス(B)(文献6より改変).
このような細胞質中のクロマチン濃度と核サイズ増大速度との関係は,クロマチン間で生じる核膜の構成因子の収集過程の競合により説明可能である7).分裂後の間期には,細胞質に存在する核膜構成因子がクロマチンへと供給され,それにより核膜の面積,つまりは核のサイズが増大する.しかし,細胞質内の核膜構成因子の量は有限であるため,間期進行に伴い核サイズが増大すると,未供給の残余の構成因子の濃度は次第に低下し,核サイズの増大速度も低下する.また,細胞質中のクロマチン濃度が増加するほど,残余構成因子の濃度も急速に減少するため,核サイズの増大速度も早期に,大きく低下することとなる.これまでの生化学的解析により,核サイズの増大速度制御に関与する核膜構成因子が2種類同定されてきた.1つ目の因子は核ラミナを構成するラミンタンパク質で,核内へのタンパク質の輸送システムを介して,細胞質から核内へと供給される.そのため,核内のラミンの量は細胞質中のラミンの存在量や核内への輸送能力に依存して変化する8).ここで,ラミンの細胞内濃度や核内への輸送能力が細胞サイズによらず一定と仮定すると,細胞サイズの増加は核内へのラミン供給量の増加に繋がる.2つ目の因子は核膜を構成する脂質膜で,核の近傍に形成される小胞体構造を介して,細胞質から核膜へと供給される6),9).実際に,細胞質抽出液中で再構成した小胞体構造の中に人工構造物のマイクロビーズを挿入し,小胞体の実効体積を減少させると,核サイズの増大速度は通常条件よりも低下する10).一般的な体細胞では,小胞体が細胞内全体に広がっており,小胞体を介した核への脂質膜の供給量は細胞サイズに依存することとなる.このように,2種類の核膜構成因子の供給量を細胞サイズに合わせて制御することで,核と細胞サイズの「黄金」比率の制御を可能とする.
間期の進行に伴い,細胞サイズのみならず,DNA複製によるDNAの量や,転写活性に関与する核内クロマチンの凝縮度も大きく変化する.これまでの解析から,この核内部DNAの量やクロマチンの構造も,核サイズを制御する一因となることが徐々に明らかとなってきた.上述の細胞サイズの解析と同様に,DNAと核サイズの関係性を探索する生物種間の比較解析も古くから行われている11).近年筆者は,種により大きな多様性を示すゲノムサイズ(=細胞内DNA量)に着目し,数十種類の多細胞真核生物種において,ゲノムサイズと核サイズを比較したところ,両者が正の相関関係を示すことを見出した4)(図3).

複数の生物種から収集した核体積とゲノムサイズの散布図と,それぞれの生物種グループごとの累乗近似による回帰線と近似式(文献4より改変).
その一方で,これら生物種間データを見ると,ゲノムサイズは細胞サイズとも正の相関関係を示すため,これら2つのパラメータが核サイズに与える影響を区別して解析することができない.そこで近年筆者らは,無細胞再構成系を用いて,細胞サイズの影響を排除した実験条件で,DNA量が核サイズの増大に与える影響を検証した12)(図4A).この再構成系では,通常核DNAの材料としてX. laevisの精子クロマチンを用いるが,それに加えてゲノムサイズがX. laevisの約半分であるネッタイツメガエルXenopus tropicalisから調製した精子クロマチンを使用した.また,使用する核DNA材料の操作条件に加え,細胞質抽出液にDNA複製阻害剤を添加し,核内でのDNAの倍加を抑制した条件(DNA量が通常条件の半分)を組み合わせ,核内DNA量に摂動を与えた(図4A).この摂動の際には,細胞質抽出液中で培養する精子クロマチンの濃度(核当たりの細胞質体積)を一定にすることで,細胞サイズからの核サイズ増大制御への影響を均一化した.その結果,核内DNA量が多くなるほど,再構成した核サイズの増大速度が上昇する特徴が見出された12)(図4A).さらに,興味深いことに,核内DNA量に摂動を与えない条件でも,再構成した核内のクロマチンの分布や凝縮度を操作すると,核サイズの増大速度を変化させることが可能であった.過剰量のマグネシウムイオン(陽イオン)の添加を介した,クロマチン内の陰イオン反発力の低下,もしくはDNA同士のクロスリンク誘導剤添加による核内クロマチンの過剰凝縮を促すと,再構成した核サイズの増大速度が低下した12)(図4B緑・黄).これらの結果は,細胞サイズの影響とは独立し,DNAの量やクロマチンの凝縮度といった核内DNAの特性が核サイズ増大を制御することを示している.

核内DNA量の操作条件(A),核内クロマチンの分布と凝縮度の操作条件(B)で,再構成した核サイズ増大ダイナミクス(文献12より改変).
クロマチンの特性による核サイズ増大の制御経路として,核内部クロマチンの力学作用の関与が想定される.真核細胞から単離した核に対する微細ピンセットを用いた剛性測定の先行研究から,陽イオンや試薬の添加によるクロマチンの過剰凝縮の誘導により,核の剛性が上昇することが示されている13),14).この核の剛性は,負に帯電するクロマチン間の反発力により生じる,核内クロマチンの「バネ」様の特徴により制御される13).このクロマチンのバネ様の特徴は,核サイズの制御機構としても応用可能である.実際に,筆者らの無細胞実験系でも,再構成核の培養中に制限酵素を加え,核内DNAを切断すると,通常よりも核サイズ増大速度が低下した12).この結果はDNA切断を介した核内クロマチン構造の破壊により,クロマチンのバネによる核内部から反発力が減弱し,再構成系での核サイズの増大速度の低下に繋がったと解釈できる.また,DNA量の減少やクロマチンの過剰凝縮の実験条件で検出された核サイズ増大速度の低下も,クロマチンのバネからの反発力の減少を考慮することで説明可能である.
上述のクロマチンから核への力の効率的な伝達には,クロマチンと核膜との結合状態が大きく影響する.多細胞真核生物の多くの種では,核の内膜直下に核ラミナを構築する.核ラミナは中間径フィラメントのラミンや膜結合タンパク質により構成され,これら構成タンパク質の一部はクロマチンとの結合能を有している.筆者らが行った無細胞再構成系の実験では,核ラミナの構成タンパク質を操作し,クロマチンと核膜の結合点を増加させると,核サイズの増大速度が上昇することを見出した12)(図4B赤).また,筆者の行った生物種間の比較解析では,ラミン遺伝子を保持しない単細胞真核生物種や,核膜自体を保持しない原核生物種においては,ゲノムサイズと核(核様体)サイズの間の相関関係を検出することができなかった4)(図3黄・桃).このように,核膜と核内クロマチンの結合の強度や分布は,クロマチンにより核サイズ増大を制御する力学作用の調節要因となることが示唆される.
核膜とクロマチンのリンクを考慮すると,多細胞真核生物の核サイズ増大の過程では,細胞質からの核膜構成因子の供給と核内クロマチンからの影響の2つの制御経路は相互に作用し合うことが推定される.間期の初期段階では,核膜の供給と小さな核内に閉じ込められたクロマチンのバネの高い反発力は,どちらも核サイズの増大に作用する.その一方で,無細胞再構成系での間期が十分に経過した後では,核サイズの増大とともに,核内クロマチンの密度が低下することで,クロマチンのバネからの反発力は小さくなり,核サイズ増大への貢献度は次第に低下する.さらに,核膜構成因子の供給が十分であり,極端に核サイズが大きくなった場合は,バネは核サイズの増大に対して反作用的に,核を内側に引っ張り込むように作用する可能性も考えられる.実際に,筆者らの無細胞系において,通常よりもDNA量が少ない条件で再構成させた核の表面には,「しわ」のような構造が多数観察された12).これは,核膜構成因子の十分な供給に対し,DNA量の減少によるクロマチンからの反発力が相対的に低く,核膜を拡張しきれず,余剰な核膜が表面にしわとして出現したものと考えられる.また,このような核膜構成因子の供給とクロマチンバネの反発力の2つの作用のアンバランスは,図1の生物種間で見られる核サイズの特徴にも影響を与えうる.実際に使用した種間比較データには,ゲノムサイズはほとんど同じであるが,細胞サイズが大きく異なるデータが数多く含まれている.そのため,細胞サイズが減少した際にはクロマチン反発力は高く,細胞サイズが増大した際には反発力が低くなる状態が想定され,種間で検出された細胞サイズと核サイズのべき乗則に寄与する可能性も考えられる.
一般的に核内のクロマチンの凝縮度や分布は,mRNAの転写制御に代表されるクロマチン機能と密接な関係を示す.ここで,新たに検出された,クロマチンの凝縮度と核サイズ増大の間の関係性を考慮すると,転写活性と核サイズの機能的なリンクが見えてくる.実際に,転写活性が比較的高いとされる幹細胞やガン細胞では,通常細胞よりも大きな核を有することが経験的に知られている15).また,現時点で実験例は少ないが,後生動物の胚発生過程において,細胞質からの核膜構成因子の供給能を操作し核サイズに摂動を与えると,転写状態が変化することが報告されている16).また,核のサイズは転写や複製などのゲノム関連の機能だけでなく,ゲノムが直接関与しない細胞形質の制御への関連を示唆する知見も存在する.例えば,細胞の浸潤や移動に伴う細胞変形の際に,核は力学センサーとして機能することが知られており17),核サイズの変化はセンサーの感度や反応性に影響を与えることが予想される.特定のガン細胞種では,核サイズの肥大化(高いN/C体積比率)と悪性度や浸潤性との相関関係を示す病理的知見が存在し18),さらに近年,N/C体積比率の操作により細胞の浸潤性が変化する実験的証拠も示されている19).今後,核の「サイズ」がクロマチン機能に及ぼす物理学的作用の理解とともに,クロマチンの機能制御以外の生理学的な役割についても理解が進展することで,真核細胞の核のサイズ比率が細胞機能を発揮する上での「黄金」比率としてはたらくことを証明できるかもしれない.さらに将来的には,核サイズの操作を介したクロマチンや核の機能の間接的操作という,新たな細胞形質の改善・改良アプローチの創出に繋がる可能性も十分に期待できる.