2022 年 62 巻 5 号 p. 288-290
2022 年 62 巻 5 号 p. 288-290
アクチンは細胞骨格の構成因子として一般的に認識されているが,近年,核内での役割についても注目されている.しかし,その機能解析に必要な核内アクチン線維の可視技術については未だ課題が残っている.そこで本稿では核内アクチン研究の経緯と私たちが偶然発見した新しいタイプの核内アクチン線維について解説したい.

新しいアクチンプローブを開発している過程で未知の核内のアクチン線維を偶然目にしたことから,意図せず核内アクチン研究を進めることとなったのが5〜6年ほど前のこと.その当時,ひとまず“nuclear actin”とPubMedに入力して検索してみると既に半世紀にもわたり多くの論文が存在し,核内アクチンに関する様々な知見が蓄積されていることに驚かされた.
そこで本稿ではまず核内アクチン研究の歴史について簡単に解説し,続いて私たちが見つけた既存のアクチン染色法では検出できない核内アクチン線維の発見の経緯と現在判明していることについて紹介したい.
アクチンは細胞に存在する最も多いタンパク質の一つであり,モノマーアクチン(Gアクチン)が重合することで二重螺旋状の線維(Fアクチン)を形成し,多種多様なアクチン線維構造体を細胞内に構築する.一方で1960年代,筋肉以外の様々な非筋細胞においてもアクチンタンパク質が存在することが発見された当初,非筋アクチンタンパク質が細胞核にも存在することが生化学的に示されていたが,このことは一般には受け入れられてこなかったようである.その原因として,核分画のアクチンは細胞質に多量に存在するアクチンの混入によるものではないかという否定的な指摘があり,加えて70年代に入って開発されたファロイジンや抗体によるアクチン線維染色法では核内アクチンを検出できないという結果がこの疑念を支持していた.その一方で,核内アクチンがファロイジン等で検出されないのは,核内アクチンが細胞質のアクチン線維とは構造が異なるため,アクチンプローブが結合しないのではないかという推測もあったが,一般的には核内アクチンの存在について懐疑的に捉えられていた.
これまでの論争の経緯を改めて振り返ると,潮目が変わったのは,90年代後半にArps(Actin-related proteins)の核内への集積と,アクチンのタンパク質配列中に2つの核外移行シグナルが確認されたことであったように思える.ちなみに,アクチンの核内輸送に関しては,核移行シグナル(NLS)を有するコフィリンタンパク質がその役割を担っていることが後に明らかとなる.そして,2010年以降,核内アクチン線維を特異的に検出するプローブが開発され,ここでは詳述しないが,核内におけるアクチンの様々な機能が次々と明らかになった.
アクチンを検出するため古典的な手法としてファロイジン染色法や蛍光抗体法等が広く使われていたが,これらの染色法では核内のアクチンを検出することはできなかった.しかし,2000年頃から緑色蛍光タンパク質(GFP)とアクチンの融合タンパク質の発現プラスミドが市販され,さらにアクチン結合ドメイン(ABD)とGFPを融合したアクチンプローブの開発が端緒となり,その後,核内アクチン線維を標的とする黄色蛍光タンパク質(YFP)-actinにNLSを付加したプローブの開発が行われた.そして,このYFP-NLS-actinは,見事に核内のアクチン線維を可視化することに成功した.これに続いて,蛍光タンパク質とABDの融合タンパク質にNLSを追加した様々なタイプの核内アクチンプローブの開発も行われた1).
核内アクチンプローブによって核内のアクチン線維が可視化され,これにより核内アクチン研究も大きく前進した.しかし,これらの核内アクチンプローブによって可視化された核内のアクチン線維は必ずファロイジンで染色されるという一見不合理な結果(核内アクチンプローブを発現させないと核内アクチン線維はファロイジン等で検出できない)は,核内のアクチン線維形成は核内アクチンプローブの発現によって誘導されたのではないかという新たな疑念を生じさせた.
一方で90年代後半に開発されたGFP-actinは,蛍光ファロイジン染色と良く似た細胞質アクチン線維像を示すことから,様々な真核細胞において広く使われている.しかし,細胞質にはモノマーGFP-actinが大量に存在しているはずにもかかわらず,GFP-actin を含む細胞骨格がFアクチン特異的に結合するファロイジン像のように染色されるという矛盾について長年にわたって見過ごされていたことに私たちは気がついた(図1左).実際,GFP-actinを発現させた細胞のGアクチンとFアクチンの比率(F/G比)を調べたところ,予想通りGFP-actinはF(繊維)が過剰であることが判明した2).この結果を踏まえ,私たちは内在性のアクチンと同じF/G比を示す新しいGFP-actinの融合タンパク質の構築を目指した.

U2OS細胞に発現させた汎用型GFP-actin(左)とactin-GFP(中,右).Bar;10 μm.
私たちが知る限り,汎用されているGFP-actin融合タンパク質はすべて,アクチンのN末端にGFPが融合したものである(図1A).しかし,アクチンサブタイプ間におけるアミノ酸配列の多様性はN末端領域にあり,また,アクチンタンパク質のN末端領域は様々な翻訳後修飾を受ける機能的に重要な部位である.これを踏まえ,アクチンのN末端を細胞質に露出させるために,タンパク質融合の順序を変えてアクチンのC末端にGFPを融合させたactin-GFPを設計した.このactin-GFPを発現する細胞では,多量に存在するモノマーのactin-GFPの背景光によって細胞質内に形成されるアクチン線維は殆ど見ることができなかった(図1B左).ところが,細胞を固定して細胞質のGアクチンを洗い流すと,アクチン繊維が形成されていることが確認できることから,正常に機能する融合タンパク質であることが分かる(図1B右).実際,actin-GFPを発現する細胞におけるアクチンのF/G比を調べたところ,内在性のアクチンと同じ挙動を示すことが確認できた2).ところが,actin-GFPを発現させたU2OS細胞のトランスフォーマントの数%において,これまで見たことがないアクチン線維が核内で形成されていることに気がついた.この核内アクチン線維は,これまでに報告されてきたどの核内アクチン線維構造体とも全く異なる形態を示した(図2右).そして,核内をグルグルと展開している未知の長い繊維構造体は非常に目を引くものであった.一方で,核内アクチンプローブとして広く使われているNLS-GFP-actin,NLS-GFP-Lifeact(Lifeact:酵母由来の17アミノ酸から成るABD)等により可視化される核内アクチン線維は直線的で比較的短く,数多く核内に出現し,形状的に全く異なるものである(図2左).そして,この未知の核内アクチンの特筆すべき性質はファロイジンで染色されないことであったことから,私たちはこの核内アクチンをPHANIN(phalloidin negative intranuclear)アクチンと名付けた3).
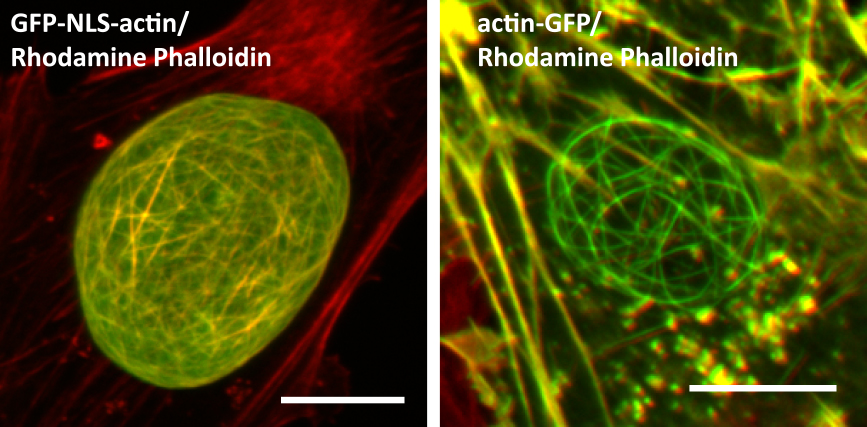
GFP-NLS-actin(左)とactin-GFP(右)を発現させたU2OS細胞をローダミンファロイジン(赤)で染色し,核領域を拡大.GFP-NLS-actinは核のみに局在し,核内アクチンはファロイジンで染色される.また,actin-EGFPの細胞質アクチン線維はローダミンファロイジンで染色されるが,核内アクチンは染色されない.Bar;10 μm.
さて私たちが偶然見つけたPHANINアクチンだが,面白いことにファロイジンが結合しないだけではなく,アクチン抗体,Lifeactにも結合しない.また,汎用されているmCherry-actinと共発現させると,actin-GFPにより形成されたPHANINアクチンが核内にあるにもかかわらず,mCherry-actinは核に共局在することはなかった3).すなわち,あらゆる既存のアクチン染色法を用いてもPHANINアクチンを検出することができず,私たちが構築したactin-GFPのみが唯一の検出法である.ところで,非筋アクチンを構成因子として核内で長いアクチン線維を形成し,既存のアクチン染色法で検出できないPHANINアクチンとは,これまで長年論争が続いていた核内アクチンの正体なのだろうか?
ファロイジン非染色性で,さらにLifeactでも染色できないアクチン線維といえばコフィリンアクチンロッドが知られている4).コフィリンはアクチン線維の脱重合に関与するアクチン結合タンパク質であるが,細胞がATP欠乏や熱ショック等のストレス条件下におかれると,アクチンとコフィリンが1 : 1で結合したコフィリンアクチンロッドを形成する.コフィリンアクチンロッドは棒状の凝集体であり,細胞質や核内に形成される.このコフィリンでフルデコレートされたアクチン線維はファロイジンに染色されないのだが,アクチン線維上のコフィリンがファロイジンの結合部位を競合的に排除しているのではない.コフィリンがアクチンに結合することによりアクチンサブユニットの立体構造が大きく変化し,その結果,ファロイジンの結合をアロスティックに阻害していると考えられている5).
コフィリンアクチンロッドは通常の一般的なアクチン検出法では染色できないため,検出にはコフィリン抗体が使われている.そこで,PHANINアクチンを発現する細胞をコフィリン抗体で染色してみたところ,PHANINアクチン線維はコフィリンを含む構造体であることが判明した(図3).この結果から,PHANINアクチンのファロイジンやLifeactに対する非染色性はコフィリン結合によるものだと考えられる.それではPHANINアクチンはコフィリンアクチンロッドの単なる一形態なのだろうか?しかし,図3にあるようにPHANINアクチンと桿状のコフィリンアクチンロッドの形態は全く異なる.さらに,Lifeact-GFP-NLSやGFP-NLS-actinで可視化された核内アクチン線維を含め,これまで様々な形態を示す核内アクチンが確認されているが,その形態と機能の関係については明らかになっていない.また,汎用されているGFP-actinでは核内アクチンを検出できない理由は不明なままである.そして,前述したがコフィリンはその配列内に存在するNLSを介してGアクチンを核内へアクチンを輸送することから,アクチンの核輸送とPHANINアクチン形成におけるコフィリンの関与も興味深い問題である.

actin-GFP(緑)を発現させたU2OS細胞(左)をコフィリン抗体(赤)で染色した.左と右は,それぞれ典型的なコフィリンアクチンロッド(矢印)とPHANINアクチン.両アクチン線維構造体ともactin-GFPとコフィリンを含むが,形態は全く異なる.Bar;10 μm.
生化学的には存在するが,アクチン染色では不可視であった核内アクチンの正体はPHANINアクチンなのだろうか?PHANINアクチンはU2OS細胞にactin-GFPを発現させたことによるアーティファクトである可能性も依然否定できないが,すくなくとも,画像としては確証が取れなかったという核内アクチンの不都合な点についてはコフィリンの存在によって説明ができるのかもしれない.また,今後,新たな核内アクチンプローブが開発され,核内アクチンの実体についてさらに明らかになることを期待したい.
最後に,5年以上にわたり物心両面から本研究の継続をサポートしてくれた産総研の中村史氏,戸井基道氏,加藤薫氏には心から感謝申し上げます.