2022 Volume 62 Issue 5 Pages 298-300
2022 Volume 62 Issue 5 Pages 298-300
筋小胞体カルシウムイオンポンプは代表的なP型ATPaseであり,ATP加水分解のエネルギーを用い輸送を担う.著者らは分子動力学法計算を基にした反応経路解析によりカルシウムイオンポンプによる輸送の分子論的なメカニズムを提唱した.膜タンパク質の構造変化とカルシウムイオン輸送の関係について述べる.
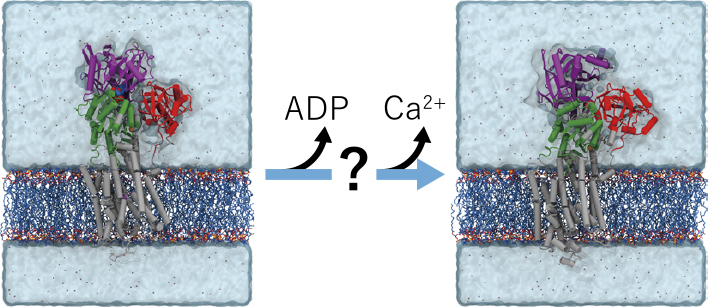
筋小胞体カルシウムポンプ(Sarco/endoplasmic reticulum Ca2+-ATPase; SERCA1a)は代表的なP型ATPaseの1つである.小胞体膜に存在する膜タンパク質であり,ATP加水分解のエネルギーを用いて小胞体内へカルシウムイオンの取り込みを行う.ATPを利用して膜の内外へ物質輸送を司るP型ATPaseは,広く共通した構造を持っているとされる.SERCA1aは3つの細胞質ドメイン(A, N, P)と10本の膜貫通ヘリックスからなる.ヌクレオチド結合部位は細胞質ドメインのN,Pドメインの間にあり,カルシウムイオン結合部位は膜貫通部位に存在する(図1A).
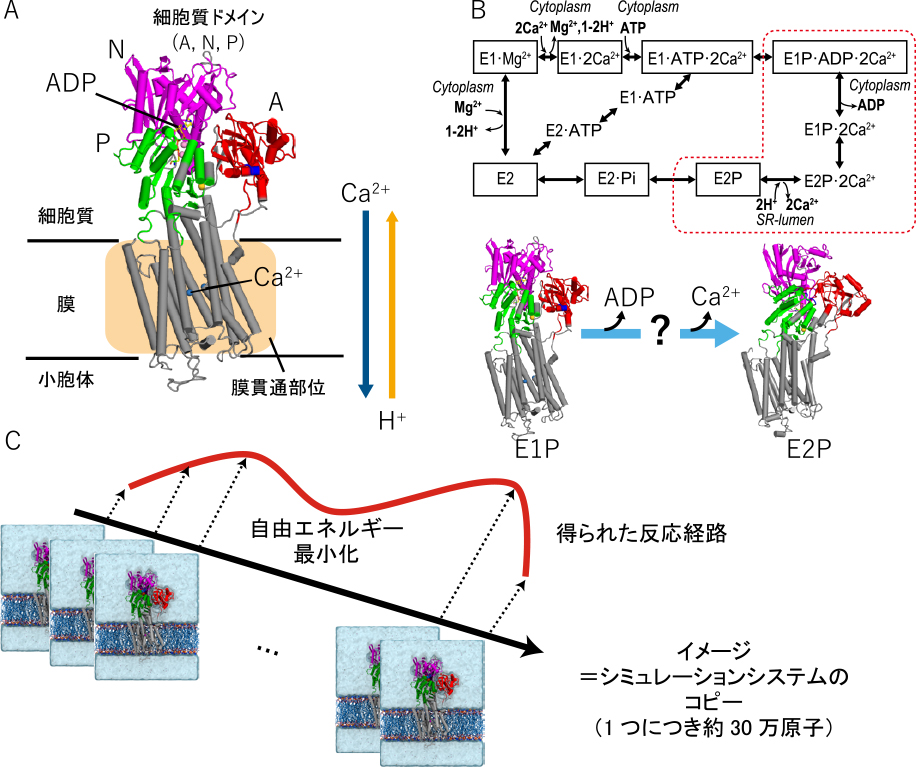
カルシウムイオンポンプ(SERCA1a).A.SERCA1aの構造.B.SERCA1aの反応サイクル(上,文献7から転載し,一部修正(Creative Commons Attribute license 4.0 (CC BY))とE1P/E2P転移(赤点線囲み).C.Mean-force string method法の概要.
これらのATPaseの輸送機構には古くからE1/E2理論が提唱され,カルシウムイオンの結合能の高いE1と結合能の低いE2という2つの構造の異なる状態を取り,これらの2状態間の構造変化によりイオンの能動輸送が達成されると考えられてきた.生化学実験などからATPの結合,加水分解,リン酸化など複数の反応を経る反応サイクルが示されている(図1B).SERCA1aの最初のX線結晶構造は2000年に解明された1).その後現在に至るまで,様々な化学条件下での結晶構造が解明されている.反応状態の構造間ではドメインの相対的な配置が異なることからSERCA1aにおけるカルシウムイオン輸送には大規模な構造変化が重要な役割を持つことが示唆されてきた.特にカルシウムイオンを小胞体内へ放出するE1P状態からE2P状態へのステップでは生化学実験から2つの中間状態の存在が示唆された2),近年では蛍光共鳴エネルギー移動によるドメイン運動解析3),クライオ電子顕微鏡法による構造解析4),5)の結果からもSERCA1aや他のATPaseの反応サイクル中の構造変化の様相が示されている.しかし,実験的な困難からSERCA1aの反応経路の構造変化,中間状態の構造などの分子論的詳細は明らかにされていなかった.
分子動力学(Molecular Dynamics; MD)法はニュートンの運動方程式に基づいて原子間に働く力から原子の運動を数値的に求める手法である.分子の構造や運動の詳細な解析が可能であり,近年の計算機や計算手法,アルゴリズムの発展から,計算可能な範囲は空間的時間的双方に広がっている.カルシウムイオンポンプの研究においてもこれまでもいくつかのグループ6)が複数の反応ステップに注目してMD計算を行っている.
著者らはE1PからE2Pへ至るステップに注目し,それぞれの状態でのMD計算を行い,さらに2つの状態をつなぐ経路を計算し,反応経路上の構造と自由エネルギー解析を行った7).
反応経路はMean-force string method8)により求めた.この方法では最初に2つの状態を結ぶ初期経路上にイメージと呼ばれるシミュレーションシステムのコピーを複数(本研究は最大64イメージを利用)置く.次にイメージ間を弱く結合させながらそれぞれの構造を同時にサンプリングすることで最も可能性の高い経路を得る方法である(図1C).この方法では従来のMD計算では困難だった比較的大きな膜タンパク質の構造変化の解析を可能にするが,複数のシミュレーションを同時に行うことから,通常のMD計算よりはるかに計算資源を必要とする.スーパーコンピュータの発展やさらにそれらの性能を最大化するプログラム9)の開発により比較的容易に実行可能となっており,様々なタンパク質の反応機構解析でも利用されている.また,このステップではカルシウムイオン結合部位へのプロトン移動が含まれるが,古典力場ではプロトン移動を直接観測することができないため,E2P状態では酸性残基のプロトン状態が異なる2つのシステムに対して計算を行った.
反応経路解析によりSERCA1aのE1P-E2P間の構造変化の様相を明らかにした.この経路は,5つのサブステートに分けられ,隣り合ったサブステート間には4つのサブステップが存在する(図2A).この図はサブステップ内の構造変化を色で示したものである.同じ色の部分は構造変化の単位としてのドメインを指しており,各サブステップの構造変化はこれらのドメインの配置変更によるものであることがわかる.最初のサブステップ(image10-23間)ではN,Aドメインが少し動き,細胞質ドメインのA,Nドメインの間の塩橋が切れる(図2B左).その結果中間的なステップではAドメインが自由に動くことが可能となり回転が見られ,さらにPドメインが膜貫通部位側に傾く.Aドメインと膜貫通部位の間のA-M1/A-M2ループが細胞質側に引き上げられる.この一連の動きは膜貫通ヘリックスの細胞質側の配置の変換となり,最後のサブステップでは膜貫通部位にあるカルシウムイオン結合部位の小胞体側のゲートを開放させることが明らかになった.
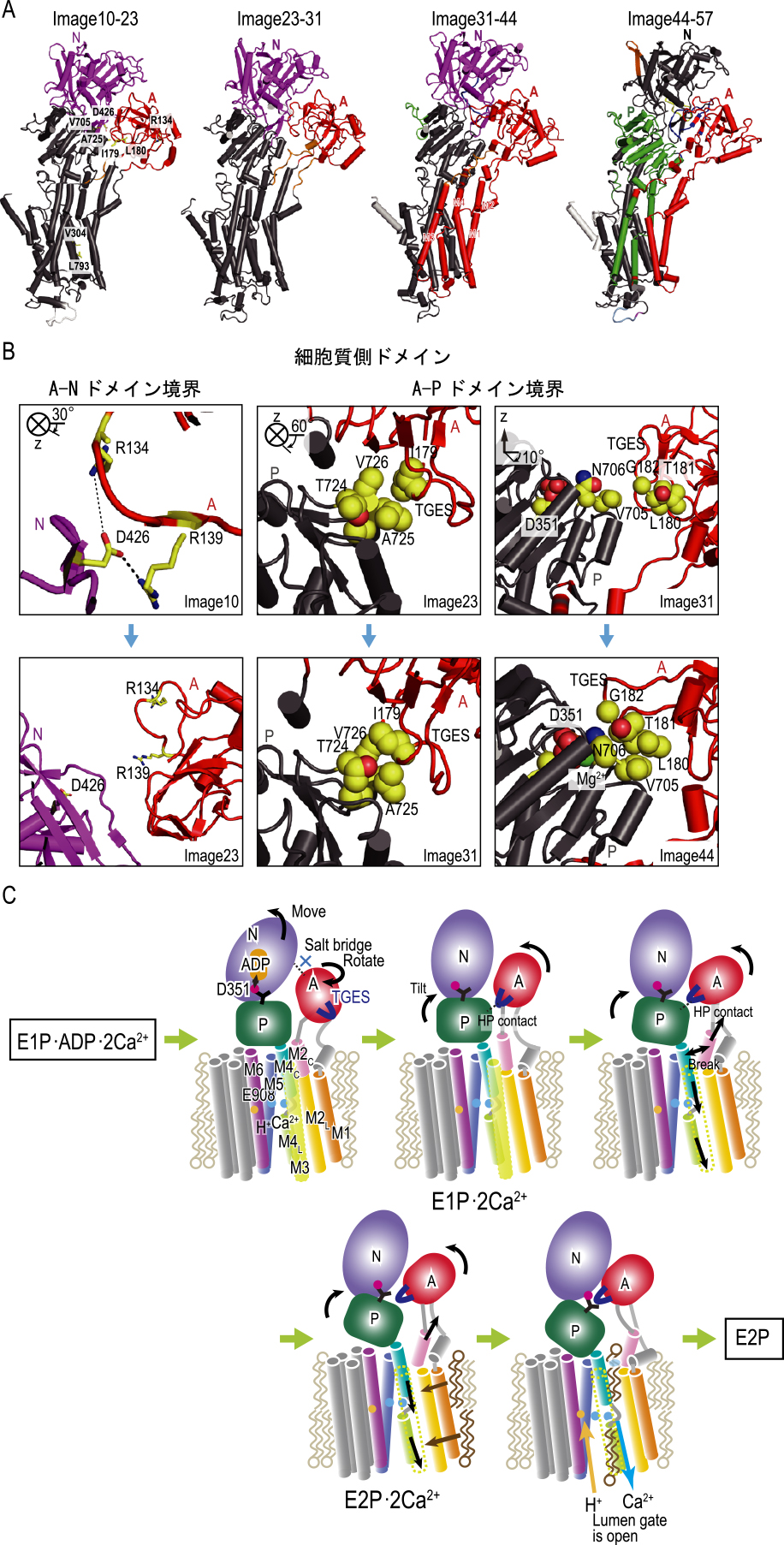
SERCA1aの構造変化.A.SERCA1aの経路上の代表的なイメージ(image10, 23, 31, 44, 57)間の構造変化.B.A-Nドメイン境界(左),A-Pドメイン境界(右)でのイメージ毎の相互作用を見たもの.C.E1P/E2P転移でのSERCA1aの分子的メカニズム.A-Cとも文献7から転載し,日本語の説明を加え,一部配置,図中の文字サイズ・配置を変更(Creative Commons Attribute license 4.0 (CC BY)).
さらに,各ステップでの構造変化を解析すると,中間状態である2番目,3番目のサブステップではA,Pドメイン境界において疎水性相互作用が過渡的に形成され,それぞれの中間状態を安定化させていることが判明した(図2B中央,右).さらに,膜分子と膜貫通部位の間でも水素結合が形成され,最終段階においては膜貫通部位の間隙に膜分子が挿入することでゲートが解放された構造を安定化することがわかった(図2C).
さらに,E2P状態におけるプロトン移動の影響を調べるため,カルシウムイオン結合部位において異なるプロトン状態のMDシミュレーションを行い,得られた構造を比較した.その結果,プロトン状態が変化することで水素結合ネットワークが形成されE2P状態を安定化することがわかった.このことはカルシウムイオンの解離後にプロトン移動が直ちに起きることで,カルシウムイオンの逆流を防ぎながら結合部位を安定化することを示唆している.このことはカルシウムイオン解離の後のステップへどうつながるかについて知見を与えている.
本研究では,MD計算を基にした反応経路解析により膜タンパク質による輸送の分子論的なメカニズムを提唱した.冒頭に述べたようにP型ATPasesの多くはSERCA1aと相似した構造を持ち,本研究で明らかにされた構造変化の様相は他のP型ATPaseでも適用可能と期待できる.その一方で,この研究では古典力場を利用していることに留意されたい.SERCA1aの反応サイクルにおいて,カルシウム結合部位におけるカルシウムイオンとプロトンの交換やそれによる小胞体ゲートの再閉鎖,さらにヌクレオチド結合部位からのリン酸離脱などが次のステップとして生じる.その議論を行うためにはカルシウムやプロトン,リン酸基とタンパク質間の相互作用をさらに正確に取り扱うことが必要となる.今後は力場の改良やQM/MM法などの量子化学手法を用いたより詳細な解析を予定している.
小林千草(こばやし ちぐさ)
理化学研究所計算科学研究センター粒子系生物物理研究チーム・技師
松永康佑(まつなが やすひろ)
埼玉大学大学院理工学研究科・准教授
Jaewoon JUNG(ジョン ジェウン)
理化学研究所開拓研究本部杉田理論化学研究室・専任技師
杉田有治(すぎた ゆうじ)
理化学研究所開拓研究本部杉田理論化学研究室・主任研究員