2023 Volume 63 Issue 1 Pages 33-37
2023 Volume 63 Issue 1 Pages 33-37
蛍光分子の2光子励起に代表される非線形光学現象には,それ以外にも様々な種類がある.これらは生細胞イメージングに適した特長を共有しつつ,それぞれ独自の情報を観測者に与える.近年の技術発展により応用性が拡大する種々の非線形光学顕微鏡の活用により,生細胞の可視化解析に新たな展開がもたらされると期待される.

生命現象の理解には,細胞・組織を生きた状態でそのまま見る生細胞イメージングが非常に重要である.この生細胞イメージングに大きな力を発揮するのが非線形光学顕微鏡である.非線形光学顕微鏡として生命科学で最もよく知られるのが2光子顕微鏡であり,更にそのほとんどは,蛍光色素・タンパク質の2光子励起を見る2光子励起蛍光顕微鏡である.1990年代に生命科学に導入された2光子励起蛍光顕微鏡は,特に脳科学分野にてその能力を発揮し,今や生物物理学全般に使用される基盤技術の1つとなった.しかし,非線形光学現象にはその他にもいくつも種類があること,そしてそれらが各々独自の原理に従って異なる情報を観測者に与えることはあまり知られていない.これらを知り,積極的に使うことで,これまで見えなかったものが見えるようになり,2光子励起蛍光顕微鏡がもたらした数々のブレークスルーに匹敵する成果が得られる可能性がある.本稿ではこれら蛍光以外の「その他」の非線形光学現象について,何がどのように見えるのか,長所・短所などについても概説する.
まず,非線形光学顕微鏡の一般的な特徴について述べる.そもそも非線形光学現象とは,1光子と1分子の相互作用による線形の反応ではない,非線形のものであり,2つ,3つの光子が物質と相互作用することで起こるものである.多くの場合,ここで用いられるのは近赤外光である.近赤外光の多光子現象においては,その時点でいくつかの重要な特長が出てくる.まず,組織深部への透過性である.これは,可視光に比べて近赤外光が組織内の物質による散乱や吸収が少ないことによる.これにより,組織深部に光を届けることができる.次に,高い3次元的空間分解能の実現である.これは,多光子現象が非常に起こり難いという,ともすればデメリットとなる性質によるものである.複数の光子が物質と相互作用する確率が非常に低いため,それが実際に起こるのは,光の密度が非常に大きい部位,つまり対物レンズの焦点部位に限局されることとなる.通常の1光子顕微鏡においても焦点部位で強いシグナルが発生するが,焦点面以外の部分でも容易に光化学反応が起こる.一方,多光子現象は焦点面以外ではほとんど起こらない.よって,その非常に限られた部位のみの現象が可視化されることとなり,これは即ち高い3次元的空間分解能の実現を意味する.そして,焦点以外での光化学反応が無いという特長は,余分な光化学反応に起因する色素分子の破壊による褪色や,細胞毒性などを防ぐことにも貢献し,それにより,低侵襲性を活かした生細胞の長期観測を同時に実現する.これから紹介する非線形光学現象は,全てこの長所を共有するものである.
もう1つ重要なのが,マルチモダリティである.これは,複数のモダリティ,つまり非線形光学現象のシグナルを同時に取得することで,生命現象の多面的な解析を可能にするものである.多くの場合,蛍光分子の多光子励起の励起スペクトルは1光子のそれに比べて非常に幅広いため,下に示す他の非線形光学現象を起こすための光で,同時に蛍光分子の多光子励起を起こすことができ,マルチモダル多光子顕微鏡解析が実現する.本稿では,このようなモダリティの内,非線形ラマン散乱と和周波発生について紹介する.
ラマン散乱は散乱の一種であるが,通常のレイリー散乱と異なり,光と相互作用した分子に存在する官能基の固有振動数に応じた振動数変化,つまり色の変化を起こすものである(図1).これを利用することで,視野内のどこにどのような官能基があるかを知る,ケミカルイメージングが実現する.しかし,ラマン散乱は蛍光に比べて圧倒的に発生確率が低いためシグナルが弱く,十分なシグナル対ノイズ比をもっての画像取得には長時間を要することから,なかなか生細胞イメージングに応用されてこなかった.これを克服したのが非線形光学現象を利用する非線形ラマン散乱顕微鏡である.主なものにはCARS(coherent anti-Stokes Raman scattering)とSRS(stimulated Raman scattering)があり,どちらの場合も対象とする振動数(エネルギーと捉えても良い)と同じ振動数差を持つ2つの光子を同時に照射することで,対象の振動を励起状態(ラマン散乱は分子の励起を伴わないので実際に励起するわけではない)に誘導し,起こり難いラマン散乱を起こり易くすることでシグナルの増強を実現するものである.CARSでは新たに生成する光子を,SRSでは片方のレーザーの変調が誘導ラマン散乱によりもう片方のレーザーの変調に転写されるのを検出することで,ラマン散乱シグナルを取得する(図1).これにより,高感度のシグナル検出,それによる高速イメージングが実現され,生命科学が対象とする多くの速い現象(ミリ秒~分のオーダー)を捉えることができるようになってきた.
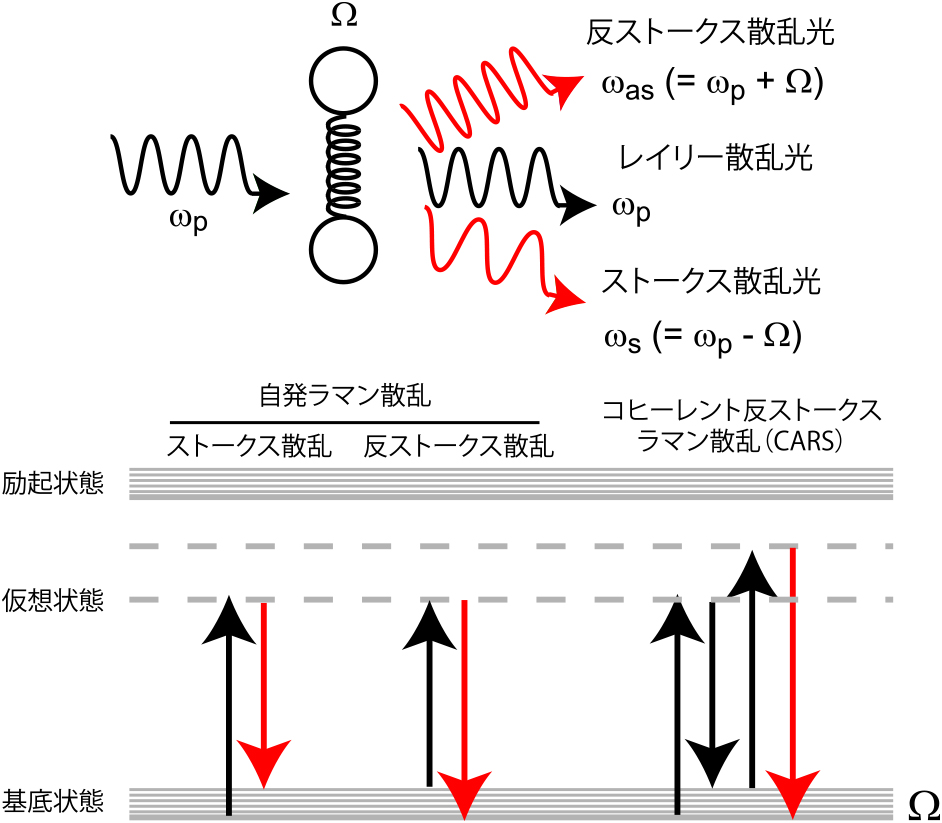
非線形ラマン散乱の概略図.下図では入射光を黒線,検出するラマン散乱光を赤線で示した.光と分子が相互作用している仮想の中間状態(基底・励起状態と異なり実際に分子がこの状態に分布するわけではない)を「仮想状態」として破線で示す.
通常,ラマン散乱は特定の分子の特異的な可視化を実現するものではなく,これは自家蛍光で特定の分子が見えるわけではないのと類似する.一方,蛍光と異なり,官能基に関しては特異的な情報を得ることができる.これを利用することにより,例えば,リン酸基が多いところとして核酸,アミド結合が多いところとしてタンパク質の存在が示唆されるというようなことが可能となる.細胞のラマン散乱スペクトルを見ると,様々なシグナルが混在している指紋領域に加えてC-H,O-Hの領域が特に強いシグナルを発している.そこで,例えばC-Hシグナルから脂質の情報を得ることで,脂質に満ちた脳組織内の髄鞘の非ラベルイメージングが可能となる(図2a).また,生体試料において水分子の存在比率が圧倒的に高く,よってO-H振動シグナルの大多数が水分子由来であることを利用し,生きた細胞の内外における水分子の分子状態のイメージング,ケミカルイメージングも可能となる1).これら特定の振動情報を抽出するイメージングに加え,スペクトル全体の情報を1つの情報として捉え,それを比較するというような解析も行われている.非線形ラマン散乱でこれを起こすには広帯域の超短パルスレーザーを使用することが必要となり,まだ一般的ではないが,このような無染色イメージングは,例えば非侵襲的組織診断などへの応用が期待されている2).これまであまり積極的に用いられてこなかったが,非線形ラマン散乱顕微鏡が,近赤外光の多光子現象を利用していることを鑑みると,これらの顕微鏡観察は組織深部における高い時空間分解能での観察を実現すると期待される.これらの特長を十分に活かすことで,非侵襲的な組織の無染色イメージング解析が実現する(図2).
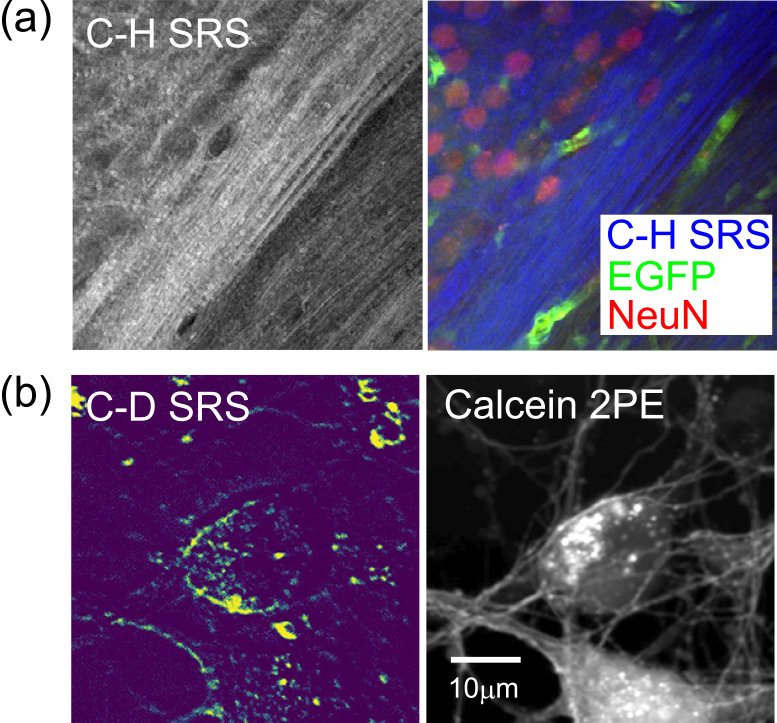
非線形ラマン散乱を用いた生体試料のイメージング.(a)固定脳組織における脂質のSRSと同時に取得された蛍光分子のマルチモダルイメージング画像.(b)生きた培養神経細胞における重水素ラベルされた麻酔薬プロポフォールのSRS画像と同時に検出した細胞構造の2光子蛍光画像(文献5より改変).
また,近年の展開として,これらの生体分子由来の内在性のシグナルではない,外因性のシグナルを導入する手法がある.これは,生体試料に存在しない官能基があれば,それを標識として捉えることができるはず,というもので,蛍光を発する蛍光色素によって特異的な可視化を実現するのと同じ考えである.この概念から,ラマンタグと呼ばれるものが提案され,応用されるようになってきた3).例えばアルキニル基や炭素重水素結合などがそれに相当し,これらは特異的なラマン散乱シグナルを出すことから,タグとして利用することができる.重要なことに,これらは蛍光色素のように大きな発色団を要さないことから,非常に小さなタグとなる.これは非常に重要な点で,これまではサイズの小さな対象には蛍光標識を付けることができず,よって可視化できなかったところ,この極小のラマンタグであれば付加,可視化が可能となると期待される.実際に我々はこの手法により生理活性物質の検出,イメージングに成功している4),5)(図2b).これは従来の情報抽出型の可視化方法と相補的な手法であり,内因性・外因性ラマン散乱を合わせることで,ラマン散乱顕微鏡の生命科学研究への応用範囲が格段に広がるものと期待される.
以上のように生細胞イメージングに大きな可能性を持つラマン散乱であるが,非線形ラマン散乱顕微鏡をもってしてもなお蛍光の検出感度とは大きな差があり,更なる感度の向上が望まれる.また,ラマンタグの導入により大きな変化を迎えるに至ったが,見えるものが限られていたことも更なる応用を阻んできた.これらのハード・ソフト面の改善により,これまで蛍光では可視化できなかったものの可視化研究が実現するものと期待される.
第2高調波発生(Second Harmonic Generation: SHG)や和周波発生(Sum Frequency Generation: SFG)については,ラマン散乱よりも更に知られていないと思われるが,これもまた観測者に独自の情報を与える強力な生細胞イメージングツールとなり得るものである.
SFGは,2つの光子が物質と相互作用した後,1つの光子へと変換される現象である.この際,エネルギー保存のため,変換された1つの光子は元の2つの光子のエネルギーの和を持ち,これは,出力光子の周波数が入力光子の周波数の和となることと同じであるため,このように名づけられている.ここで,元の光子の周波数が同じ場合,2つ,3つの光子から変換される光子の周波数は元の光子の2倍,3倍となり,これらは第2(SHG),第3高調波発生(Third Harmonic Generation: THG)と呼ばれる(図3).

和周波発生の概略図.入射光は黒線で,SFG,SHG,THG光は緑線で示す.また,SFGを起こす媒体分子の極性を模式的に赤矢印で示す.
特にSHGは,実は,超短パルスレーザーを用いた通常の2光子励起顕微鏡においては,条件さえ合えば,同時に発生するものである.SHGは,光が相互作用する物質が,光により分極され易く,かつそれらが中心対称性を欠いて存在するときに強く生じる(図3).この後者の必要条件が,このような配向依存性の無い蛍光分子の励起と大きく異なるところである.つまり,SHGは,特殊な分子の配向情報を観測者に与えることができる.また,SHGはラマン散乱同様励起を伴わない現象であり,励起後の分子の緩和によるストークスシフトが起こらないため,入射光のちょうど半分の波長の光が生成される.よって,SHGシグナルは,同時に起こる長波長シフトした蛍光シグナルと容易に分離し,独立に計測することができる.
上記の条件を満たせばSHGは自然に発生するため,これまでにいくつもの内在性のSHGシグナルが報告されてきた.最もよく知られているのはコラーゲン繊維であり,これはコラーゲン繊維の非常に規則的な分子構造に起因するものと考えられる.また,興味深いことに,生きた神経細胞の軸索も強いSHG源となり,これにより軸索や樹状突起が混在する組織の中で,軸索構造のみを特異的に可視化することができる(図4a).これは,軸索内の微小管構造が非常に強い方向性を持っていることに起因すると考えられる.これらの性質を利用することで,例えばがん組織におけるコラーゲン構造の変化や,神経細胞の軸索の変化を無染色で捉えることができる.また,上述の通り,SHGは分子の励起を伴わないため,励起に起因する光毒性が軽減されると期待され,これらを合わせることで,非侵襲的組織診断への応用が期待される.
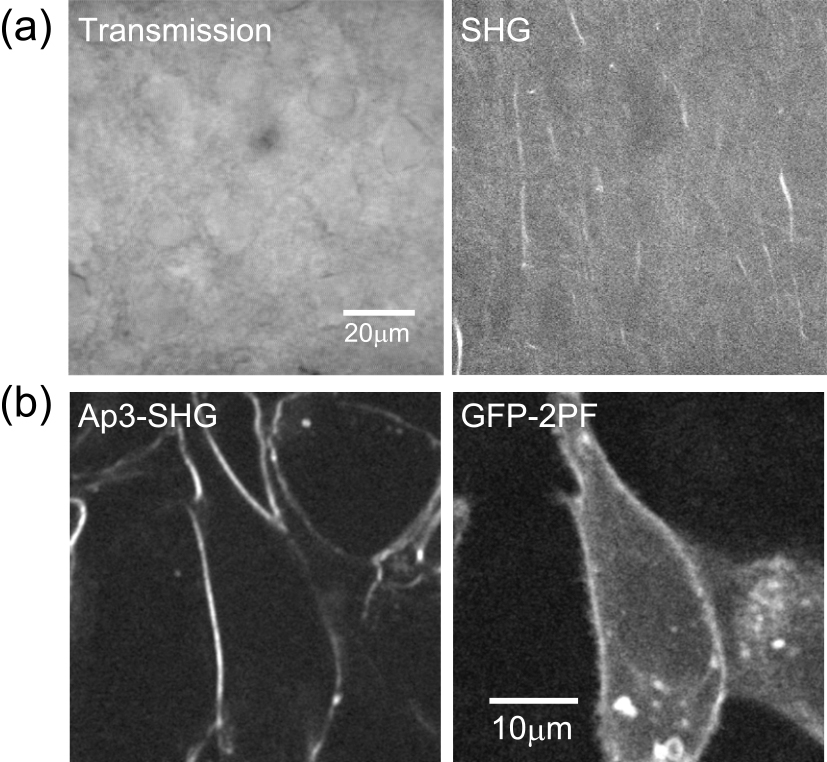
SHGを用いた生体試料のイメージング.(a)生きた脳スライス試料から得られる通常の透過光イメージとSHGイメージ.(b)SHG専用色素で染色した生きた培養細胞のSHGと2光子励起蛍光による細胞膜イメージングの比較(文献9より改変).
近年の展開として,SHGやTHGを利用した発見型の研究がある.コラーゲンや軸索などもそうであるが,光を照射してSHGシグナルを検出すると,条件を満たす生体構造が自然と浮かび上がってくる.非線形光学顕微鏡の観測対象の拡張により,既知のSHG構造に加え,これまで知られることのなかったSHG,THG源が発見され,それらは無染色イメージングの新たな対象となっている6).このような仮説を置かない発見型の観察には多くの展開が秘められており,今後の更なる探索が期待されるところである.
また,ラマン散乱顕微鏡と同様,生体試料由来の内因性のSHGのみならず,積極的にこれを起こすような外因性のSHGイメージングについても様々な試みがなされてきた.例えば我々は,細胞膜が油相と水相の界面であり,SHGに必要な非対称性を生むことに着目し,ここに両親媒性の色素を導入することで,SHGによる細胞膜の特異的なイメージングを試みてきた.重要なことに,このような細胞膜のSHGイメージングでは,色素が細胞膜における電位などの局所環境依存的な電子状態を示すため,それに応じたSHGのシグナル変化が得られる.つまり,それを利用することで,細胞膜の微細な環境変化の特異的なイメージングが可能となる7).SHG研究の短所として,これまでSHGに特化した色素が無く,分子励起を伴わないSHGであれば本来避けられる,色素の褪色や細胞毒性などが生じてしまうという問題があった.そこで我々はこの問題を解決すべく,無蛍光性SHG専用色素Ap3の開発を行った8).これにより,蛍光を発さず,褪色や細胞毒性も少ないSHGイメージングが実現するようになり,モダリティ間の干渉の無い,真のマルチモダル多光子イメージングが実現した.これを利用することで,蛍光では難しかった細胞表面の細胞膜だけの特異的な可視化が実現することも示された9)(図4b).
SHGの場合,装置的には多光子励起顕微鏡のシステムと同様であるため,装置の複雑さは問題ではない.一方,非線形ラマン散乱と同様,やはり感度の低さと応用性の少なさが依然大きな問題としてある.色素の応用はまだ細胞膜の可視化に止まり,かつてより提唱されている「SHGラベル」によるタンパク質の可視化も未開拓である10).今後の更なる観測対象の開拓と染色方法などの向上により,SHGの更なる展開が進むものと期待される.
このように,蛍光以外の非線形光学イメージングは,組織透過性や低侵襲性といった生細胞イメージングに適した性質を共有しながら,それぞれの原理に基づき,独自の情報の可視化を実現する.更に,これらは多光子顕微鏡システムで同時かつ独立に計測できるマルチモダルイメージングを実現するため,多次元的な可視化解析を実現できる.これらのイメージングの更なる展開に向けて必要なのは,応用の開拓と装置の発展であると考えられる.見えるものが増えればより多く使用されるようになり,一般化し,それが更なる応用を生み出す.同様に装置についても,一般化すればより汎用性の高い装置が生み出され,それが更なる導入を生み出す.非線形光学イメージングの多彩な可能性が認識され,より多くの研究者が応用を試みることで,このような好循環が生まれ,非線形光学イメージング技術の真の能力が開花し,生命科学研究の新たな光となることを願っている.