2023 Volume 63 Issue 5 Pages 276-280
2023 Volume 63 Issue 5 Pages 276-280
非膜オルガネラは,天然変性タンパク質同士の分子間相互作用により媒介された液-液相分離により形成される.本稿ではCAPRIN1を対象とし,溶液NMR法による静電ポテンシャル測定を活用することで,静電反発と分子間相互作用の均衡が相分離を制御する分子機構を明らかとした研究について概説する.

細胞はタンパク質,核酸分子の細胞内局在や物質輸送,酵素反応などを精緻に制御する機構として,膜を介さずに外界から区画化された「非膜オルガネラ」を形成することが知られている.細胞内環境に応じた非膜オルガネラの形成と解消は,多様な生理応答の分子実体であることが明らかとされ,生物学分野において近年大きな注目を集めている1).
非膜オルガネラの多くは,タンパク質や核酸が分子間相互作用により会合し,高濃度に集積した凝集相を形成することによって生じると考えられている.このような凝集相の形成過程は液-液相分離(Liquid-Liquid Phase Separation, LLPS)と呼ばれ,水と油の混合溶液,もしくはポリマー溶液が,化学ポテンシャルの釣り合った2相を形成することと同様のメカニズムにて理解される.LLPSにより形成された凝集相は,凝集相外部と分子の出入りが可能であることや,凝集相の形成と解消が温度やpH,タンパク質の翻訳後修飾などに応じて迅速かつ可逆的に生じることを特徴とし,細胞が環境の変化に鋭敏に応答するうえで適した性質を有すると考えられている.
LLPSを駆動する分子間相互作用は多くの場合,特定の立体構造を形成しないタンパク質の天然変性領域(Intrinsically Disordered Region, IDR)が担うことが知られている1).これらIDR同士の相互作用は弱く,かつ不均一であることから,典型的な生化学的,構造生物学的な手法によって解析することが困難であった.これに対して,溶液核磁気共鳴(Nuclear Magnetic Resonance, NMR)法は,IDR間の弱くかつ不均一な分子間相互作用を,残基レベルの分解能で解析できることを特徴とし,非膜オルガネラ形成の詳細な分子機構を理解するうえで重要な知見を与えてきた2).
本稿では,RNA結合タンパク質CAPRIN1を対象として,LLPS過程における静電相互作用の役割に着目した我々の研究について概説する3).
CAPRIN1は生体内においてストレス顆粒やP顆粒などの非膜オルガネラに局在し,RNA代謝の制御に関わるタンパク質である.CAPRIN1 C末端側のIDR(残基番号607-709,以下単にCAPRIN1と呼称する)は両端のアルギニンに富んだ領域(Arg-rich region)と,中央の芳香族アミノ酸に富んだ領域(aromatic-rich region)からなり,中性条件において電荷+13と高度に正に荷電した配列であることを特徴とする(図1a).精製したCAPRIN1はin vitroにおいて,高濃度(>500-600 mM)の塩化ナトリウム(NaCl),もしくはアデノシン3リン酸(adenosine triphosphate, ATP)の添加によって,CAPRIN1同士が会合しLLPSを生じることから,LLPSの分子機構を理解するためのモデルとして解析が進められてきた4),5).図1bにはATPの添加に伴うCAPRIN1のLLPSを,凝集に伴う液滴形成を反映する波長600 nmにおける濁度(OD600)の増大,および蛍光標識したCAPRIN1液滴の蛍光顕微鏡観察から検出した結果を示す.特筆すべき点として,ATP依存的なCAPRIN1のLLPSは2相性を示し,数mM程度の低濃度のATPは凝集形成を促進する一方,50 mM以上の高濃度では逆に凝集相を溶解する様子が見てとれる.

我々は,これらのin vitroにおけるCAPRIN1のLLPSがどのような分子機構によって生じるのか,溶液NMR法による解析に従事してきた.図1cには一例として,CAPRIN1がLLPSを生じずに均一に溶解した希薄混合状態(~300 μM),およびATPの添加により生じた凝集相(~33 mM)における,CAPRIN1主鎖アミド基の15N-1H相関2次元NMRスペクトルを示した.凝集相の解析では,ATP添加に伴い生じたタンパク質凝集相の液滴を,液滴同士の融合および比重の違いを利用してサンプル管の下部に集積させ,シグナル検出コイルが凝集相のシグナルのみを検出するように工夫している.各残基由来のアミド基1H,および15N核はそれぞれ近傍の化学環境の違いを反映し,特徴的な化学シフト値を示すため,2次元NMRスペクトル上において分離したシグナルとして観測される.したがって,NMRスペクトルを精査することで,CAPRIN1のどの領域の,どのような相互作用がLLPSにおいて重要であるかを同定することが可能となる.我々はこれまでに,凝集相におけるCAPRIN1分子間相互作用に着目した一連のNMR解析,および変異体解析を行い,Arg-rich region,aromatic-rich regionにおいてアルギニンや芳香族アミノ酸の側鎖,および主鎖の両方が関与する分子間相互作用が凝集相の形成に重要な役割を果たしていることを明らかとしてきた4).
NMR法を活用した解析から,CAPRIN1分子同士が直接の分子間相互作用を介して会合し,凝集相の形成を駆動するという分子的描像は得られてきたが,より遠位で作用することでLLPSを制御しうる静電相互作用の役割については知見が不足していた.CAPRIN1は生理的pH環境において正に荷電していること,NaClやATPの添加よる遮蔽効果によりLLPSが促進することを踏まえると,上述のようなCAPRIN1の引力性の分子間相互作用は,静電反発と均衡した状態にあることが予想される.LLPSを生じるIDRの多くは荷電性残基に富んでいること,および荷電性アミノ酸への変異がLLPS活性を大きく変調する例が多く知られていることからも,静電相互作用の定量的かつ部位特異的な理解は,LLPSの分子機構に関する普遍的な理解を得るうえで重要な課題であると考えた.
そこで我々は,岩原淳二グループ(テキサス大学医学部門)により開発された,溶液NMRによる部位特異的静電ポテンシャル測定法をCAPRIN1に適用することとした6).本手法では,不対電子に近接する1H核スピンのシグナルが,その距離依存的に広幅化する常磁性緩和促進効果(Paramagnetic Relaxation Enhancement, PRE)を利用する.図2aに示すように,負電荷をもつ3-カルボキシ2,2,5,5-テトラメチルピロリジン-N-オキシルニトロキシド(PROXYL),もしくは正電荷をもつ3-アミノメチルPROXYLのいずれかを添加したサンプルを調製し,タンパク質の各1Hシグナルに観測される広幅化の度合いを比較する.このとき,正に荷電した領域では,静電相互作用によって3-カルボキシPROXYLからのPREが顕著に観測される一方で,負に荷電した領域では逆に3-アミノメチルPROXYLからのPREが優位に観測される.PREによる広幅化の度合いは,観測1H核周囲のPROXYL誘導体の濃度勾配を反映することから,下記の式を用いることで部位特異的な静電ポテンシャルϕENSを計算することができる.

(a)NMR静電ポテンシャル測定の模式図.(b)CAPRIN1希薄混合状態のϕENS,およびアミノ酸配列に基づく電荷分布のプロット.図は文献3より一部改変して引用した.
ここで,Γ+,Γ–はそれぞれ3-アミノメチルPROXYL,3-カルボキシPROXYLからのPREによる広幅化を緩和速度の増分として定量した値,eは電子の電荷,kBはボルツマン定数,Tは絶対温度を表す.分母の2eは3-アミノメチルPROXYL(+1e)と3-カルボキシPROXYL(–1e)の電荷の差異に由来する.添え字ENSはPREが及ぶ分子表面の実効領域(effective near-surface, ENS)を意味し,ϕENSの値はENS内の各点における静電ポテンシャルの平均値と対応する.岩原らはタンパク質やタンパク質-DNA複合体において,本手法による算出されるϕENSの実験値が,結晶構造を用いてPoisson-Boltzmann方程式から計算される静電ポテンシャルの分布とよく一致することを示した6).この手法の利点は,静電ポテンシャルの値をde novoの実験値として算出可能な点である.特に,IDRのように特定の構造をもたない系において,さらにLLPSを制御する荷電性分子の存在下においても静電ポテンシャルを残基分解能にて評価できる点で,非常に強力な手法である.
図2bには,本手法を用いて希薄混合条件におけるCAPRIN1の残基毎のϕENSを算出した結果を示している.また比較として,前後10残基のアミノ酸配列から予想される平均電荷のプロットを併せて示した.配列から予想される通り,CAPRIN1のϕENSはArg-rich regionにおいて+20~+40 mV程度の高い値を示していることが分かる.興味深いことに,aromatic-rich regionでは,アミノ酸配列から予想される電荷分布は中性に近いものの,実験から得られたϕENSは+20 mV程度の正の値を示していることが分かった.これは,CAPRIN1のIDRとしての構造柔軟性のために,Arg-rich regionが分子内相互作用にてaromatic-rich regionに一過的に近接し,見かけ上正電荷が非局在化したことを反映していると考察している.
CAPRIN1のLLPSを誘起するATP存在下でのϕENS測定を行い,LLPS過程とϕENSの変化がどのように相関しているのかを調べた.図3aにはATP非存在下,LLPSを生じる直前のATP濃度である0.8 mMにおいてATP/CAPRIN1モル比が異なる2条件(ATP/CAPRIN1 = 2.66,もしくは16),CAPRIN1の凝集相が溶解する高濃度(90 mM)のATP存在条件で,希薄混合条件におけるCAPRIN1のϕENSを比較したプロットを示す.ATPの添加,およびATP/CAPRIN1モル比の増大に伴い,Arg-rich regionのϕENSは段階的に低下していることが分かった.これは負に帯電したATPがCAPRIN1のArg-rich regionに結合し,静電反発を解消していることを支持する結果である.また興味深いことに,凝集相が溶解する90 mM ATP存在下では,CAPRIN1の電荷が反転し,aromatic-rich regionがわずかに負に荷電していることが示された.これは高濃度に存在するATPがaromatic-rich regionと相互作用することで,負電荷同士の静電反発を生じさせ,また同時に芳香族アミノ酸側鎖が関与する分子間相互作用と競合することによって,分子同士の会合を抑制した状態を反映していると考えている.

(a)ATP濃度,およびATP/CAPRIN1モル比が異なるときのϕENSの比較.(b)ATP添加により形成された凝集相におけるCAPRIN1のϕENSのプロット.図は文献3より一部改変して引用した.
ここまでの解析は希薄混合条件,すなわちCAPRIN1のLLPSが生じていないか,凝集相がごくわずかにしか形成されていない条件で解析したものである.上述のようなATP依存的なϕENSの低下は,凝集相内部においてCAPRIN1が高度に中性化していることを示唆する.これに対する実験的な裏付けを得るために,3 mMのATPを添加することで形成したCAPRIN1凝集相を直接観測し,凝集相ではϕENSの値がほぼ0 mV,すなわちCAPRIN1の電荷がほぼ完全に中和されていることを示した(図3b).さらに,クロマトグラフィー解析により凝集相内部に含まれるCAPRIN1とATPの濃度を定量したところ,CAPRIN1は~33 mM,ATPは~162 mMと算出され,ATP/CAPRIN1モル比はおよそ4.9であることが分かった.これは,観測pH条件におけるCAPRIN1(+13)とATP(–3)の電荷の比,13/3~4.3とよく対応していることから,凝集相内部ではCAPRIN1が1分子あたり,4から5分子のATPを取り込むことによって効率よく電荷を中和し,分子間相互作用を維持していることが分かった.
以上の結果に基づき,我々は静電ポテンシャルの変化がCAPRIN1のLLPSを制御する機構を提唱した.ATP非存在下のCAPRIN1は分子全体が正電荷を帯びることで,静電反発によって自己会合が抑制された状態にある(図4I).ATPがArg-rich regionに結合するとCAPRIN1の正電荷が中和されることで,相対的にCAPRIN1同士の分子間相互作用が優勢となり始める(図4II).CAPRIN1の凝集相内部では,1分子のCAPRIN1あたり4~5分子のATPを取り込むことで電荷がほぼ完全に中和されており,分子間相互作用が安定に維持された状態となっている(図4III).そして,過剰量のATP存在下では,ATPがCAPRIN1のaromatic-rich regionに結合することでCAPRIN1を負に帯電させ,さらにATPによりCAPRIN1同士の分子間相互作用が競合的に阻害されることで凝集相の溶解が生じる(図4IV).このようにCAPRIN1のLLPSは,アルギニン側鎖や芳香族アミノ酸側鎖が関与する分子同士を繋ぎとめる分子間相互作用と,静電反発との均衡によって巧妙に制御されていることが明らかとなった.生体内においては,RNAや負に荷電した他のタンパク質が同様の機構で,CAPRIN1のLLPSを制御していると考察している.
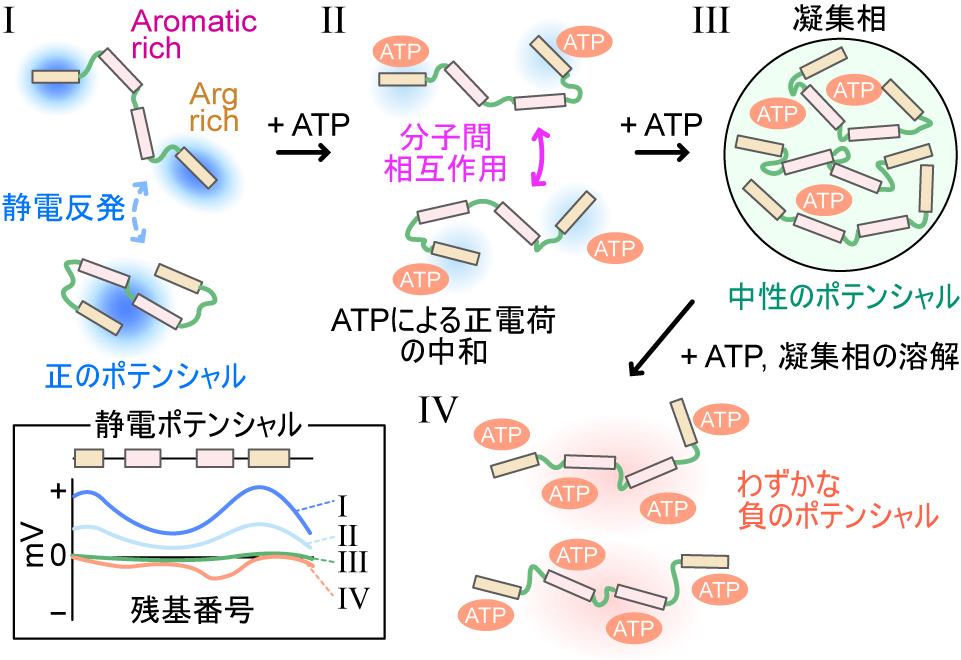
ATP依存的なLLPS過程におけるCAPRIN1の静電ポテンシャルの変化とLLPS分子機構の模式図.図は文献3より一部改変して引用した.
我々はのちに本研究の発展形として,高濃度のNaClにより誘起されるCAPRIN1凝集相と,ATP依存的に形成される凝集相の比較を行った7).その結果,NaCl添加により形成される凝集相では,CAPRIN1はやや正に荷電しており(ϕENS = +5~+10 mV),完全な電荷の中和は生じていないこと,および凝集相に含まれるCAPRIN1濃度は低く,分子の並進拡散,回転拡散が亢進していることが示された.これは,分子間相互作用と静電相互作用の均衡度合は,凝集相の組成と物性を決定するうえでも重要な役割を果たしていることを示唆する結果である.
本稿で一例を示したように,溶液NMR法はLLPSを制御する分子間相互作用やIDRの動的構造について定量的かつ部位特異性をもったユニークな情報を与え,顕微鏡観察や他の分光法から得られる知見を高度に補完するものである.今後も溶液NMR法を駆使することで,LLPSが関与する多様な生理現象の分子機構について,より深い洞察が得られることを期待したい.
本研究は,筆者がトロント大学Lewis E. Kay教授のグループに在籍時に実施したものである.Kay教授,および共同研究者のJulie D. Forman-Kay教授(トロント小児病院/トロント大学),Atul K. Rangadurai博士(トロント小児病院/トロント大学)に深く感謝申し上げる.本研究はCanadian Institutes of Health Research(CIHR),Natural Sciences and Engineering Research Council of Canada(NSERC)の研究資金,および日本学術振興会海外特別研究員制度,上原記念生命科学財団海外留学助成の支援のもとで行われた.