2023 Volume 63 Issue 6 Pages 310-312
2023 Volume 63 Issue 6 Pages 310-312
鉄依存的な脂質過酸化反応により,細胞内に過酸化脂質が蓄積すると,フェロトーシスと呼ばれる制御性細胞死が起きる.しかし,過酸化脂質のターゲット分子や,細胞死実行機構については,未だ不明である.本稿では,Piezo1/TRPチャネルによるメカノセンシングを介した本細胞死の新規制御機構をご紹介する.

鉄依存的な脂質過酸化によって引き起こされる制御性細胞死「フェロトーシス」は,2012年に発見された,細胞膜の破裂を伴う炎症誘導性の細胞死である1).細胞は恒常的に過酸化脂質を産生しており,脂質過酸化消去酵素GPX4がグルタチオンを補因子として過酸化脂質を還元・無毒化することによって,生存を維持している2).しかし,GPX4の活性が何らかの要因で阻害されると,過酸化脂質が蓄積し,フェロトーシスが引き起こされ,神経変性疾患,虚血性心疾患,腎・肝障害などの様々な病態の発症・増悪に繋がることが知られている3).近年,新規創薬ターゲットとして非常に着目されているが,現時点でその臨床応用には至っておらず,その大きな要因として,脂質過酸化から細胞死に至るまでの分子機構が未だに全く不明なため,本細胞死特異的な分子標的やバイオマーカーが存在しないことが挙げられる3).
本研究ではまず,細胞内のどこで脂質過酸化が起きるか調べるため,過酸化脂質を特異的に検出可能な蛍光プローブBODIPY 581/591 C11を用いた細胞イメージングを行った.本解析には,スピニングディスク共焦点顕微鏡を利用し,励起光の強度・照射時間を最小限に留めることで,励起光によるバックグラウンド蛍光を極力抑えた条件下でイメージングを行った.代表的なフェロトーシス誘導剤の1つ,RSL3(GPX4阻害剤)をマウスマクロファージ様細胞株RAW264.7細胞に処置したところ,細胞全体で過酸化脂質産生が起きていたが,特に細胞膜で顕著な産生が起きていることを見いだした(図1).この時細胞は,形態変化(収縮)を起こしていたことから,コールターカウンターにより細胞体積の変化を測定したところ,予想に反して,体積が増加していた(図2a).そこで,細胞膜を特異的な標的とし,細胞膜の張力の変動に応じて蛍光寿命が変化する蛍光プローブFlipper-TRを利用した蛍光寿命イメージングを行った.

過酸化脂質の細胞イメージング(蛍光プローブBODIPY 581/591 C11を利用).RAW264.7細胞にRSL3(GPX4阻害剤,2.5 μM)処置時に産生された過酸化脂質の細胞内分布(青色).文献4の図を改変して引用.
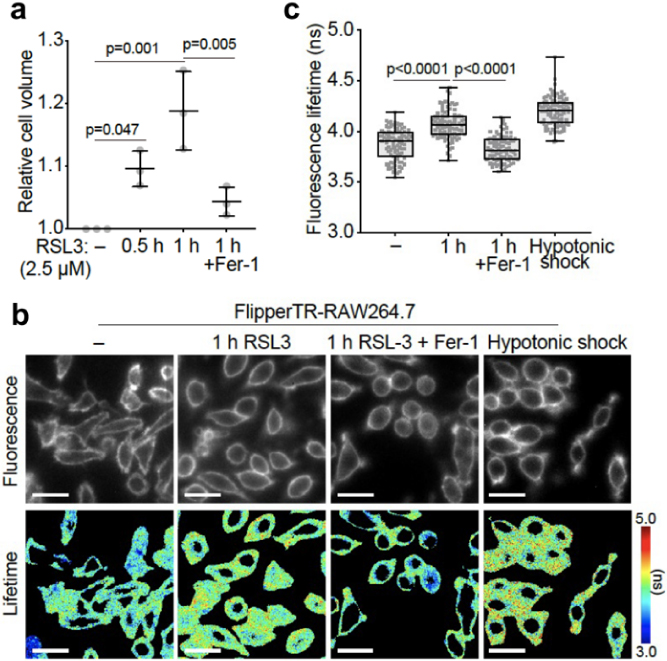
脂質過酸化に伴う細胞体積(a),細胞膜張力(b, c)の変化.(a)コールターカウンターによる細胞体積の測定.Fer-1:Ferrostatin-1(過酸化脂質消去剤).(b, c)Flipper-TRを利用した蛍光寿命イメージング(b),蛍光寿命の細胞ごとの平均値(c).細胞膜の張力増加に伴って,蛍光寿命が長くなる.文献4の図を改変して引用.
その結果,RSL3処置によって細胞膜張力が増加したこと,過酸化脂質消去剤Ferrostatin-1(Fer-1)により,その増加がキャンセルされたことから,実際に,脂質過酸化によって細胞膜の張力が増加することが分かった4)(図2b, c).
上記の結果を踏まえ,機械刺激受容体Piezo1に着目した.Piezo1は,細胞膜の張力増加を直接感知して開口し,細胞内外のイオン濃度勾配に応じてNa+イオン流入やK+イオン流出を引き起こす,非選択的カチオンチャネルである5).CRISPR/Cas9システムによりPiezo1欠損細胞を樹立し,RSL3処置によりフェロトーシスを誘導したところ,Piezo1欠損により細胞死が抑制された(図3a).そこで,この時の細胞内のNa+/K+イオン含有量の変化を,原子吸光法により測定したところ,野生型細胞では,細胞膜が破裂する(細胞死が起きる)以前に,劇的なNa+イオン流入,K+イオン流出が起きていたが(図3b),Piezo1欠損細胞ではいずれも有意に抑制された(図3c, d).Na+/K+イオンの細胞内外の濃度勾配は,主に,細胞膜上のトランスポーターNa+/K+-ATPaseによるATPを利用した能動輸送によって形成されているが,脂質過酸化時の本トランスポーターの酵素活性を調べたところ,大きく減少していた.以上の結果より,脂質過酸化時には,Na+/K+-ATPaseの活性抑制,および細胞膜張力増加に伴うPiezo1の開口が起きること,両者の相乗的な効果による劇的なカチオン流出入が起きることが明らかになった4).

Piezo1,TRPチャネルによる協調的なフェロトーシス促進作用.(a)Piezo1野生型(WT)・欠損細胞(KO,2ライン)のRSL3を4時間処置後の細胞致死率(LDH release).(b-d)原子吸光法による細胞内カチオン量の変動解析.(e)細胞外液のNa+(NaCl)をNMG+(NMGCl)またはK+(KCl)に置換し,RSL3を3時間処置後の細胞致死率(LDH release).(f)Piezo1 WT・KO細胞に2-APB(広範なTRPチャネルの阻害剤)をRSL3(2.5 μM,5時間)と共処置した際の細胞致死率(LDH release).文献4の図を改変して引用.
カチオンの流出入は,細胞膜が破裂する以前に起きていたことから,フェロトーシスの実行に何らかの寄与を果たしていることが想定された.そこで,細胞外液中のNa+を別のカチオン(NMG+:細胞膜を透過できない),もしくはK+に置換してカチオン流出入を阻害したところ,RSL3誘導性の細胞死は有意に抑制されたことから,カチオン流出入はフェロトーシス促進的に働くことが示唆された(図3e)4).
Piezo1の欠損細胞では,野生型細胞と比較して,カチオン流出入が約半分に抑制されたが,完全には抑制されなかったことから,別の機械刺激受容チャネル・TRPファミリー分子にも着目した.約30の分子で構成されるTRPファミリーは,温度・浸透圧・pHの変化などの物理・化学的刺激を感知して開口する非選択的カチオンチャネルであり,機械刺激にも応答して開口することが知られている6).そこで,広範なTRPファミリー分子の阻害剤2-APBのフェロトーシスへの影響を調べたところ,RSL3処置時の過酸化脂質の蓄積には2-APBの有無で変化が認められなかった一方で,カチオン流出入および細胞死は顕著に抑制された.特に,細胞死については,Piezo1欠損または2-APB単独処置では,RSL3を長時間(5時間)処置した際の細胞死はほとんど抑制できなかったが,両者を組み合わせることで,大きな抑制が認められた(図3f).これらの結果から,Piezo1およびTRPチャネルは,過酸化脂質蓄積に伴う細胞膜張力の変化を感知して開口し,協調的にカチオン流出入を引き起こすことで,フェロトーシスを促進することが示唆された4).
我々は,GPX4阻害時の脂質過酸化が,特に細胞膜上で顕著に起きること,それに伴って細胞が膨張し,細胞膜の張力が増加することで,機械刺激受容体Piezo1・TRPチャネルが開口し,劇的なカチオン流出入を引き起こすことによってフェロトーシスが促進されることを明らかにした.なお,分子動力学シミュレーションにより,生体膜の脂質過酸化によって,膜が薄くなり,膜曲率が増大することが報告されていることから,細胞膜の張力増加に加え,脂質過酸化自体も,これらのチャネルの開口に寄与していることが想定される7).今後は,TRPチャネル分子の中で,具体的にどのファミリー分子が本機構に寄与しているか,特定を進めていきたい.また,カチオン流出入がどのようにしてフェロトーシス促進に寄与するのかについては,現状全く不明であり,今後の重要な課題である.本研究をさらに進めていくことで,フェロトーシス実行機構の全容解明,および関連疾患の治療戦略の開発に繋げていきたい.なお,本研究遂行にあたり,カナダ・トロント小児病院(The Hospital for Sick Children)のSpencer A. Freeman助教,Sergio Grinstein教授に,多大なるサポートをいただいた.この場を借りて,厚く御礼申し上げたい.