2023 Volume 63 Issue 6 Pages 313-315
2023 Volume 63 Issue 6 Pages 313-315
胚発生や生体組織の恒常性維持に重要なWnt/βカテニンシグナルを開始するWnt-Frizzled-LRP6複合体の形成機構を,タンパク質工学,クライオ電子顕微鏡単粒子解析,X線結晶構造解析,および細胞機能実験を組み合わせて明らかにした.得られたシグナル複合体の描像は新規Wntシグナル拮抗薬・作動薬の開発に繋がると期待される.
Wntはホヤからヒトまでを含む多細胞生物の進化に決定的な役割を果たした因子の1つで,胚発生や組織の恒常性に重要な分泌糖タンパク質である1).Wntは幹細胞の維持・増殖に深く関わるとともに,そのシグナルの異常活性は癌,低下は組織変性といった疾患に繋がる2).そのため,Wntシグナルを人工的に制御することで,幹細胞からオルガノイドと呼ばれるミニチュア臓器を培養して利用するという基礎研究への応用や,組織を形づくる再生医療を志向した研究が行われている.また,このシグナルを生体中で抑制することにより大腸癌をはじめとした悪性腫瘍の,逆に活性化することで骨粗鬆症などの治療法を開発する試みも活発に進められている.
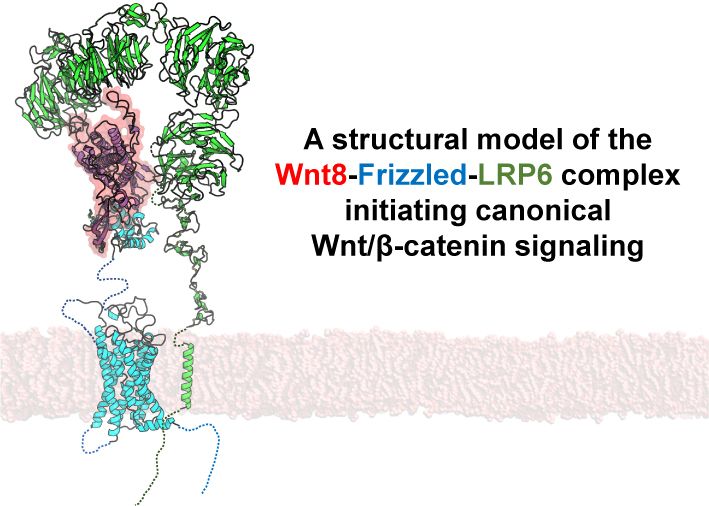
Wntは全身のあらゆる組織で様々な膜局在型受容体と結びつき,多彩な細胞内シグナルを介してその機能を発揮する2).その中でも最も詳細に研究されてきたのが古典的Wnt/βカテニン経路である.この経路はWntが細胞外で7回膜貫通型受容体Frizzled,および1回膜貫通型受容体LRP5もしくはLRP6へと同時に結合することで活性化され,細胞増殖に関わる遺伝子の発現を亢進する.
医薬研究・開発のためにこのシグナルを任意に活性化するには組換えWntタンパク質が利用可能であるが,Wntは脂質修飾されているため水に溶けづらく,その用途が制限されてきた.またWntを含む細胞培養液は精製タンパク質と比べ安定なため広く利用されるが,品質の問題から実験の再現性に難があった.そこで近年では,Wntに結合してその可溶性を改善するアファミン(αアルブミン)とWntの複合体試薬3)に加えて,Wntの主要な受容体であるFrizzledとLRP6を二重特異性抗体で強制的に近づけることでβカテニンシグナルを特異的に活性化する「代理Wnt」4)が開発されている.
Wntシグナルを人為的に活性化するこれらの「ツール」を合理的に改良するためには,Wntタンパク質が受容体に結合してシグナル伝達を開始する様子を可視化する必要がある.しかしながら,WntがFrizzledの細胞外ドメインに結合した2者複合体構造は解明されていたものの5),6),これにLRP6が会合した真のシグナル複合体構造は明らかでなかった.
Wntの細胞外シグナル複合体は細胞表面の擬似的な2次元空間で形成される.一方で,物理化学的な解析のためには溶液中の3次元空間で安定な複合体を形成することが望まれるが,Wntの水溶性とWnt-LRP6間の結合親和性がこれに不十分であるため研究が妨げられていた.このような問題を解決するため,酵母提示法を用いた指向性分子進化によって複合体界面に変異を導入し,低親和性タンパク質-タンパク質相互作用を安定化する試みが行われている7).しかしながら,Wntの分泌と機能には多細胞生物のみが有する脂質化酵素に加えて専用の細胞内輸送タンパク質が必要であり1),酵母細胞上への提示が困難である.そこで本研究では,浮遊系HEK293F細胞にWnt変異体を提示し,LRP6へ強く結合するクローンを選択することで安定なWnt-Frizzled-LRP6複合体の精製と構造解析を目指した8).
標的としてはヒトで19種類あるWntのうち良好な組換え発現を示すWnt8を選択した.さらには,タンパク質の安定性が高くヒトFrizzled5/8下流のβカテニンシグナルを強く活性化するアフリカツメガエルのオルソログを用いた(ヒトWnt8a/bとの配列一致度>70%).ヒトWnt3やマウスWnt3aなどではWntタンパク質を構成する2つのドメインを繋ぐリンカー領域がLRP6との結合に重要であるとされていたため6),9),この領域に部位特異的な組合せ変異を導入したプラスミドライブラリを作成した.続いて,Wnt8変異体遺伝子を内包するレンチウイルスを作成し,Wnt提示のために設計したHEK293F細胞株に感染させることで約100万種類の多様性を有する細胞ライブラリを作成した(naïve library).LRP6のWnt結合領域は中心に漏斗状の窪みを有する球状ドメインが4つ連なった形をしており,Wnt8は他の多くのWntと同様に最初の2つのドメイン(LRP6E1E2)に結合する.そこで,Wnt8変異体を提示する細胞ライブラリを蛍光標識したLRP6E1E2で染色し,より強い結合を示す細胞をFACSで選り分けたのち増殖させるというサイクルを計3回繰り返した(図1).選択後のライブラリから良好な発現を示すクローンを選抜し,LRP6への結合親和性とβカテニンシグナル活性化能の改善を確認した.

Wnt8のLRP6E1E2に対する親和性成熟8).Wnt変異体はFrizzled-1TM(1回膜貫通ドメイン)からなるキメラタンパク質を発現するHEK293F細胞に提示した.
作成した変異型Wnt8を用いて,Wnt8-Frizzled8-LRP6E1E2からなる細胞外シグナル複合体を組換え発現して精製した.そしてクライオ電子顕微鏡による単粒子解析法により,低分解能ながらその立体構造を得た(図2左上).この構造中でWnt8は既報通り「親指」と「人差し指」でFrizzled8をつまみ上げ5),6),その対極に位置する「手首」でLRP6と会合していた.具体的には,Wnt8のN末端ループと変異導入したリンカー領域が,それぞれLRP6E1E2の2つのドメインの中心に位置する窪みに突き刺さり,吊り下がるように複合体を形成していた.実際に野生型Wnt8のN末端ループとリンカー領域をそれぞれ欠失させると,LRP6E1E2への結合が減弱した(図2左下).またその効果は後者でより顕著であった.

Wnt8-Frizzled8-LRP6E1E2の構造解析8).
得られたクライオ電子顕微鏡構造はアミノ酸側鎖同士の相互作用を可視化するには精度が不十分であったため,最も重要であると考えられたWnt8のリンカー領域とLRP6E1E2との共結晶構造を解明した(図2右).結晶化は当初難航したが,変異体のリンカー領域ペプチドをジスルフィド結合で環状化した上で,Wnt8のN末端ループと競合する抗LRP6抗体(Fab重鎖)へと融合したサンプルを用いることで良質な結晶を得た.最終的に1.7 Åの分解能で結晶構造を決定し,野生型Wnt8で重要であると考えられるアミノ残基,および変異導入によって安定化された相互作用がそれぞれ明らかとなった.野生型アミノ酸の中でも,特にアスパラギン(N226: hWnt8b,以下同)とアルギニン(R231)は,LRP6とそれぞれ水素結合,およびcation- π相互作用を形成していた.また,新規に導入されたバリン(A228V)は相互作用界面の中心でLRP6の疎水性ポケットに深く突き刺さっており,アルギニン(G232R)は窪みの外側で新たな静電相互作用を形成していた.さらにリンカー領域ペプチド非結合型のLRP6構造10)との比較から,LRP6の窪みを形成する複数のループが大きく構造変化してペプチドを捕える誘導適合機構が示された.局所的な相互作用が詳細に解明されたため,今後Wntのリンカー領域を改変する上で,より効率的なライブラリ設計や,アミノ酸配列の直接的な最適化が可能となった.
本研究で重要性が再認識されたリンカー領域は,Wntサブタイプ間ではアミノ酸配列が大きく異なるが,同じサブタイプであれば生物種間で良く保存されており,各Wntサブタイプの機能に大きな役割を果たしていると考えられる8).そこで,この領域を用いた機能実験を行った(図3).

リンカー領域を用いた機能実験の結果8).
まず環状化したリンカーペプチドがLRP6に結合する拮抗薬として利用できないか検討した.その結果,環状ペプチドは基となったWntと同じLRP6ドメイン選択性を有するWntタンパク質の下流シグナルを阻害した.さらには,得られた構造を基にリンカー領域を入れ替えたキメラWnt設計した.例えば,Wnt3aはWnt8と異なりLRP6の3番目と4番目のドメイン(LRP6E3E4)に結合するとされるが,Wnt8のリンカー領域を移植することでWnt3aのLRP6ドメイン選択性が切り替わった.また「非古典的Wnt」であるWnt5aはLRP6を介したシグナルを活性化できないが,LRP6E1E2に結合するWnt1のリンカー領域をWnt5aに移植することで,βカテニンシグナルを活性化できるようになった.これらの知見はアファミンなどの結合タンパク質と組合せて,将来的にWnt骨格を有する新規作動薬の創出に繋がると考えられる.
また代理Wntとして知られる作動薬は高い用量効果を示す一方で最大効果がWntタンパク質に劣る.今回得られた内在性Wntによるシグナル複合体の構造は,受容体間の立体配置をWnt複合体に近づけるといった方法で代理Wntの効果を最適化するのに役立つ可能性がある.
本研究ではWnt8による古典的βカテニンシグナルの開始機構を提案したが,これが全ての古典的Wntに共通するとは断言できない.例えばWnt8のリンカー領域はループ構造を取るが,大多数のWntはこの部分にβヘアピン構造を有する.また,これらはN末端ループの直前にWnt8には見られない小さなサブドメインを有する.さらには,Wnt3のようにLRP6E1E2ではなくLRP6E3E4に結合するものも存在する.そのため,各Wntのシグナル複合体構造を研究することは重要である.しかしながら,WntのN末端ループとリンカー領域の距離,LRP6の窪み間の距離,およびLRP6に対するドメイン特異的抗体を用いたWnt-LRP6の結合阻害実験などから,これらシグナル複合体の相互作用様式は類似していると仮定できる.
一方でWnt/βカテニンシグナルの構造生物学研究には大きな課題が残る.すなわちクラスA型GPCRなどで達成されているように,全長Wnt-Frizzled-LRP6にDishevelledなどの細胞内シグナル因子が結合した「膜貫通型複合体」の構造を明らかにする必要がある.これらの達成と非古典的Wntシグナルの開始機構の解明によって,医薬応用のためのWntシグナル阻害剤・活性化剤の改良がさらに加速すると期待される.