2024 年 64 巻 1 号 p. 21-24
2024 年 64 巻 1 号 p. 21-24
ドッキングシミュレーションは化合物とタンパク質の複合体構造を高速に予測する計算手法である.しかし,膜タンパク質について脂質膜の存在をあらわに考慮していないという問題があった.我々は分子の疎水性指標であるlogPを用いてドッキングスコアを補正する手法(LoCoMock)を考案した.

タンパク質はそれぞれが固有の立体構造をとり,他のタンパク質や化合物と結合することで機能を発揮する.そのため,タンパク質に化合物が結合する際の位置や化合物の向きを解明できれば,タンパク質の機能を理解できる.生体内で作られる化合物の他にも,医薬品の多くはタンパク質に結合して機能を調節することで効果を発揮する.理想的には,医薬品となる化合物は,標的となるタンパク質に対してより強力に結合して作用するか,あるいは特異性が高く副作用が少ないことが期待される.しかし,数億種類におよぶ化合物の候補から目的の薬効を示す化合物を実験的に探索するには膨大なコストがかかる.そこで,タンパク質と化合物の結合性を効率的に評価するため,コンピューターを用いたドッキングシミュレーションが活用されてきた.本稿では,ドッキングシミュレーションを脂質膜の中に埋め込まれた膜タンパク質に対しても活用できるように拡張した計算手法について概説する1).
まず,一般的なドッキングシミュレーションの仕組みについて簡単に紹介する(図1).ドッキングシミュレーションは配座探索とスコア計算の2つの過程からなる.配座探索は2つのステップからなり,タンパク質と化合物からなる複合体を生成する.まず,化合物単体がどのような立体配座をとりうるかを計算する.立体配座を探索する方法はプログラムによって異なるが,回転可能な結合をある程度細かい角度で回転させ,総当たり的に構造を生成する.生成構造から安定な構造に絞り込むことで総数を減らし,計算コストを抑える.次に,タンパク質と化合物を3次元上のグリッドとして組み合わせて複合体を作成する.このような方法により比較的低コストで複合体の親和性を予測できる利点がある.計算の高速化を優先する場合は,タンパク質の構造は結晶構造などの静的なものを使用するが,存在する結合ポケットの形状に結果が大きく左右されてしまう.この問題を解消するため,分子動力学計算を利用して構造を揺らがせ,タンパク質の構造にバリエーションをもたせて多対多のドッキングを実行する手法も存在する2).

一般的なドッキングシミュレーションのワークフロー.化合物とタンパク質の複合体生成と妥当性評価の2つの過程から構成される.
細胞は脂質二重層からなる細胞膜に覆われており,細胞の外と内を空間的に隔離している.あるいは,細胞小器官も脂質膜によって区画化されることで独自の機能を発揮する.脂質膜も重要な生命現象が生じる場であり,多数の膜タンパク質が存在している.脂質膜に埋め込まれた膜タンパク質は膜の内外を結びつける役割を担っている.例えば,細胞の内外で物質をやり取りしたり,細胞外に放出された化学シグナルを受け取って細胞内に伝達したりするなど多様な生命現象に関わっている.そのため,膜タンパク質は疾患の原因となることもあり,医薬品開発における重要なターゲットである.
ところが,創薬シミュレーションの多くで脂質の存在をあらわに考慮できていないという問題があった.化合物の結合における外部環境の影響は重要であり,水が存在することによる溶媒効果は様々な種類のシミュレーションで考慮されている.ドッキングシミュレーションにおいても水の影響を取り入れることで性能の向上が図られてきた3).しかし,膜タンパク質はその外部環境が水のみならず,脂質に囲まれた領域が存在している.単純に考えれば,配座探索のグリッド計算において空間を水と脂質に分割して計算すればよい.しかし,脂質の存在下での化合物と標的タンパク質との結合性についての実験データは少なく,どのようなパラメータを用いればよいのか決められない.また,計算する上でも条件分けが複雑になり,計算速度が低下してしまう.このように,ドッキングシミュレーションにおいては脂質の存在をあらわに考慮できてないため,膜タンパク質に対する利用に制限があった.
膜タンパク質に対してもドッキングシミュレーションを可能にするために,我々は脂質膜の存在をあらわに考慮することで既存のドッキングスコアを補正する手法を提案した.本手法では3つのステップを経て,スコアの補正値を計算する(図2).

本手法の概要.仮想的な脂質膜への埋め込みにより,化合物の位置を正しく評価できる.
まず,膜タンパク質が脂質膜にどのように埋め込まれているかを計算する.インターネット上に公開されている配向予測サーバーであるPPM(Positioning of Proteins in Membrane)server(https://opm.phar.umich.edu/ppm_server)にPDB形式のファイルをアップロードすることで膜への埋め込み位置や向きが計算できる4).PDBに登録されている構造の一部については,あらかじめ膜への埋め込みを計算したものがOPM(Orientations of Proteins in Membranes)データベース(http://opm.phar.umich.edu/)に登録されている.膜タンパク質同士のドッキングシミュレーションにおいては,膜に対する位置関係を拘束した条件でドッキングする手法が考案されている5).
次に,通常のドッキングシミュレーションを行いタンパク質と化合物の複合体構造(ドッキングポーズ)を得る.このとき,脂質膜の存在はまだ考慮されておらず,タンパク質と化合物は水中に存在すると仮定されたまま親和性が評価される.実用的なコツとしては,なるべく多様な構造を取得しておくという点がある.水溶性タンパク質に対するドッキングシミュレーションではスコアがよい複合体が得られればそれでよいが,膜タンパク質の場合,脂質膜の存在を考慮した上で最終的な評価を行う必要がある.このため,この段階では高く評価されないが,最終的に高く評価される可能性のある複合体を取りこぼしてしまう可能性を防ぐ必要がある.
ここまでの過程で得られたタンパク質と脂質膜,タンパク質と化合物の位置関係を合わせると,化合物が脂質膜のどの位置に配置されたかを知ることができる(図3).

タンパク質の膜への埋め込みと通常のドッキングシミュレーションから脂質膜と化合物の位置関係を間接的に求める.
化合物とタンパク質の複合体の候補が得られたのち,化合物の脂質膜の中での位置の妥当性を評価する必要がある.その評価に,分子の疎水性指標であるオクタノール/水分配係数logPを用いることを考える.医薬品の経口吸収性を予測するリピンスキーの法則ではlogPが5以下,つまり疎水性が高すぎないことが好ましいとされている6).このlogPを計算によって予測する様々な方法が考案されてきた.その1つに,原子の種類に応じたlogPを経験的に求めておき,それを積算することで分子全体のlogPを予測する手法がある7).ここでは,この手法を活用して得られる原子ごとのlogPをそのまま用いる.例えば,ある原子のlogPが大きく,疎水性であった場合,疎水的な脂質中に存在するのが好ましい.逆にlogPが小さく,親水性の原子が脂質中に存在していれば,エネルギー的にペナルティを受けるべきである.原子ごとのlogPに,原子の位置に応じた重み関数をかけて積算すると,そのドッキングポーズにおける重み付きのlogPを算出できる.脂質の疎水性については,脂質膜における炭化水素の分布についての実験値をもとに,折り返したシグモイド関数として重み関数をモデル化した(図4)8).

脂質膜中の位置と疎水性を示す重み関数.
このとき,logPと溶媒和自由エネルギーの間には式1のような関係にある.
| (式1) |
ここで,ΔGwatは水についての溶媒和自由エネルギー,ΔGoctはオクタノールについての溶媒和自由エネルギー,Rは気体定数,Tは絶対温度を表す.ここに,重み付きlogPを代入すると水中にあった化合物を脂質中に移動させる自由エネルギー(kJ/mol)を得ることができる.このように自由エネルギーが得られると,ドッキングスコアが結合自由エネルギー(kcal/mol)として提供される様々なドッキングプログラムと互換性が生まれる.その結果,ドッキングスコアに補正項を加えたものをlogP-corrected membrane docking score(LoCoMockスコア)として得られる.LoCoMockスコアを用いることで,これまで困難だった,脂質膜を考慮した膜タンパク質と化合物の複合体予測が可能となる.
実際に,LoCoMockスコアの性能を評価するため,既知の膜タンパク質と化合物の複合体を23種類選択し,ベンチマークセットとした.そのうち16構造について,従来のドッキングシミュレーションより正解構造に近いドッキングポーズを提案することに成功した(図5).脂質をあらわに考慮しない場合は親水性の官能基が脂質膜中に存在することが許容されてしまうが,LoCoMockスコアによってペナルティを課すことができるためこれを阻止できる.計算コストは単純な重み付きの積算処理であるため,ドッキングシミュレーションにかかる時間を考慮すると非常に少ない.現時点における問題点として,タンパク質の形状や性質を立体的に考慮しなければ,正解が得られない場合が存在する点が挙げられる.これについては膜に垂直な方向についての1次元的な重み関数ではなく,立体構造を考慮した3次元的な重みの計算へ発展させることで解消されるであろう.また,原子ごとのlogPを計算する上で機械学習などを応用した精度の向上が期待される.
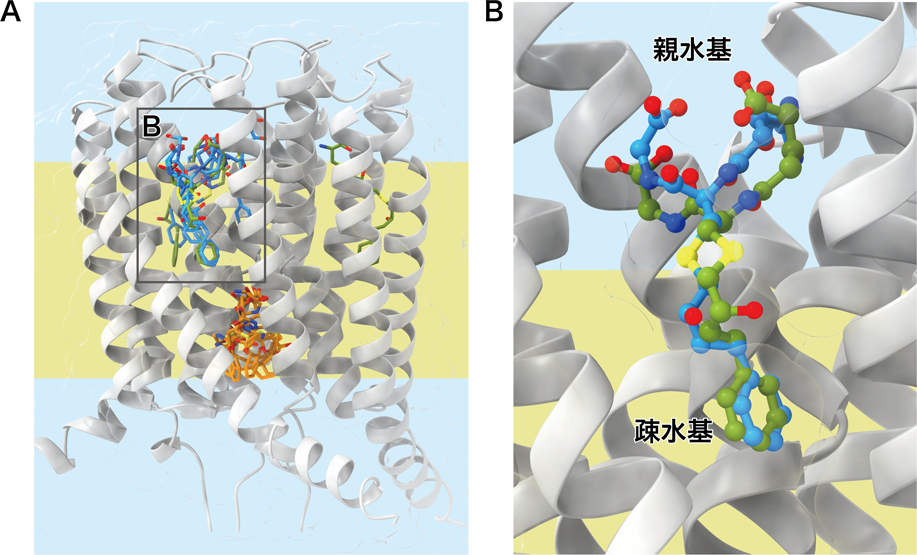
ドッキングシミュレーションの結果(PDB ID: 4J7Y).黄色の領域が脂質膜に相当する.緑は実験により得られた正解ポーズ,オレンジは従来法,水色はLoCoMockを使用し,得られたドッキングポーズ.
本稿では膜タンパク質に対してドッキングシミュレーションを行う手法について概説した.近年,AlphaFold 2に代表される機械学習を利用したタンパク質の構造予測が開発され,様々な分野で盛んに利用されている.このような方法においても,膜タンパク質を取り囲む環境については明示的に考慮されていない.学習したデータセットに含まれている,脂質環境中で得られた実験構造から暗黙のうちに膜タンパク質の形状を予測しているに過ぎない.シミュレーションの種類に応じて外部環境を考慮することで,より適切な結果が得られることが期待される.