DNAナノチャネルは,緻密な配列設計や化学修飾により,チャネルタンパク質の機能模倣に成功している一方で,その膜挿入効率は低いため,応用展開は制限されている.本稿では,DNAナノチャネルを物理的に膜挿入することで,膜挿入効率を従来の3倍に向上させた「DNAナノチャネルプローブ技術」について紹介する.
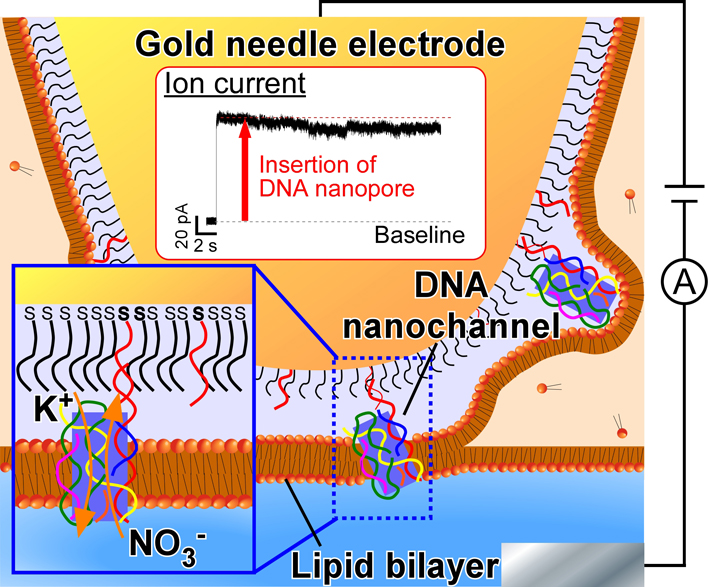
イオンや栄養素を選択的に輸送するチャネル膜タンパク質は細胞膜を介した物質輸送を担い,細胞機能,ひいては生命活動を維持する重要な役割を担っている.一方,天然分子の性質を調べるのではなく,チャネルタンパク質の構造や機能を人工的に再現した合成ナノチャネルに関する研究が盛んに行われており,細胞機能の制御や疾患治療への応用が期待されている.さらに,天然のチャネルタンパク質にはない機能を有する合成ナノチャネルも開発されつつあり1),人工細胞や分子ロボット2)創製に向けた基盤技術となり得る.
1980年代に最初の合成イオンチャネルが報告されてから今日に至るまで様々な合成ナノチャネル3)が開発されているが,我々は構造DNAナノテクノロジー技術によって構築されるDNAナノチャネル4)に着目している.DNAナノチャネルは,設計・作製が容易であり,様々な形状・サイズのチャネルを構築することが可能である.さらに,人工核酸やDNAアプタマを用いることで外部刺激に対する応答性を付加することが可能であるため,バイオセンサやドラッグデリバリーシステムなどへの応用が期待されている5).
しかしながら,細胞膜への挿入効率が低いことが課題となっており6),DNAナノチャネルの応用展開は非常に限定的である.親水性のDNAナノチャネルを細胞膜に挿入するためには,コレステロールなどの疎水性アンカーを修飾する必要があり4),本分子が疎水性相互作用による構造体の凝集を引き起こすことも課題の一つとなっている.そのため,疎水性アンカーを用いない新たな膜挿入手法が求められてきた.
そこで我々は,疎水性アンカー未修飾のDNAナノチャネルを高効率に膜に挿入可能な「DNAナノチャネルプローブ技術」を開発した7).本稿では,その原理と膜挿入効率評価の結果について概説する.
DNAナノチャネルプローブは,先端に脂質二分子膜を形成可能なPEG修飾金ニードル電極8),9)の先端にDNAナノチャネルを固定化することで構築される(図1a).本プローブを用いて脂質二分子膜を形成することで,修飾されたDNAナノチャネルが脂質二分子膜に押し付けられることで物理的に膜に挿入される(図1b).
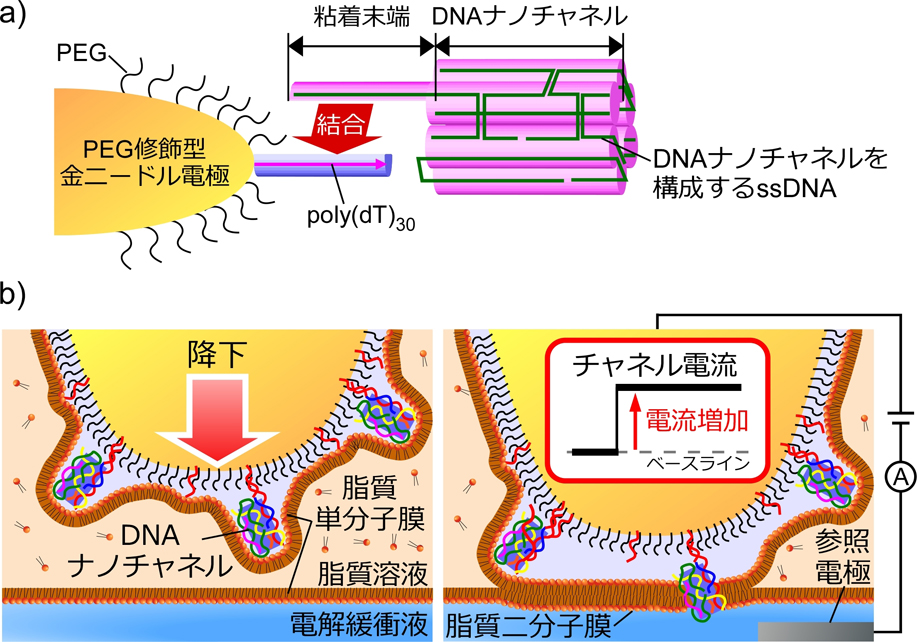
DNAナノチャネルプローブ技術の概要図.a)金ニードル電極へのDNAナノチャネル固定化方法およびb)DNAナノチャネルプローブを用いたDNAナノチャネルの物理的膜挿入モデル.
上記手法による膜挿入を実現するために,金電極に固定可能なDNAナノチャネルを設計し,電極に固定化することでDNAナノチャネルプローブを作製した.まず,6本の二本鎖DNAを筒状に束ねた長さ14 nm,外径5 nm,内径2 nmのDNAナノチャネル構造(6HB)の端部に,粘着末端として一本鎖DNA(ssDNA)を追加したDNAナノチャネルをデザインした.また,DNAナノチャネルと脂質二分子膜との相互作用を高めるために,ホスホロチオエート(PPT)を修飾した.上記DNAナノチャネルを金ニードル上に固定化するために,粘着末端と相補的な塩基配列を有するssDNA(poly(dT)30)を金電極に修飾し,粘着末端とハイブリダイゼーションさせることでDNAナノチャネルを金電極上に固定化した.
従来研究において報告されているように,先端にPEGを修飾した金電極を,リン脂質を含む有機溶媒溶液(脂質溶液)と電解緩衝液が層になった浴溶液に挿入することで,電極先端に脂質二分子膜を形成することができる.DNAナノチャネルが電極表面のPEG層から突起するようにデザインすることで,形成された脂質二分子膜にDNAナノチャネルが押し付けられ物理的に膜に挿入されると考えられる(図1b).
次に,上記メカニズムによりDNAナノチャネルが膜に挿入されていることを調査するために,脂質二分子膜を介したイオン電流計測を実施した.本手法では,電解緩衝液に挿入した参照電極および金電極間に膜電位を印加することで,脂質二分子膜を介したイオン電流を計測することが可能である(図1b).イオンなどの極性分子は脂質二分子膜を通過することができないため,脂質二分子膜中にナノチャネルが存在しない状態では,イオン電流は0 Aとなる.一方,脂質二分子膜にナノチャネルが挿入されると,ナノチャネル内をイオンが通過できるようになるため,ナノチャネルの形状やサイズに起因した一定の電流値が得られる.つまり,得られた電流波形を解析することでどのようなチャネル分子が挿入されたのかを考察することが可能である.
イオン電流計測を実施した結果,脂質二分子膜を形成した後にナノチャネルの膜挿入を示唆するステップ状の電流上昇シグナルが観察された(図2a左).さらに,電流上昇シグナルからチャネルコンダクタンスを計算した結果,0.37 nSと0.82 nSの二つのコンダクタンスピークが得られた(図2a右).本結果がDNAナノチャネル由来であることを確認するために,ナノチャネルを円筒形状として仮定しチャネル形状とコンダクタンスの関係を表すHilleの式を用いて単一DNAナノチャネルの理論コンダクタンスを算出し実験値と比較した.その結果,本研究で用いたDNAナノチャネルの理論コンダクタンスは0.46 nSであり,実験的に得られたコンダクタンスの一つ目のピーク(0.37 nS)と同等であることが確認された.さらに,二つ目のコンダクタンスピークは一つ目のコンダクタンスピークの約2倍であることから,本実験にて得られたステップ状の電流波形は,単一または二つのDNAナノチャネルが膜に挿入されたことを示していることがわかった.
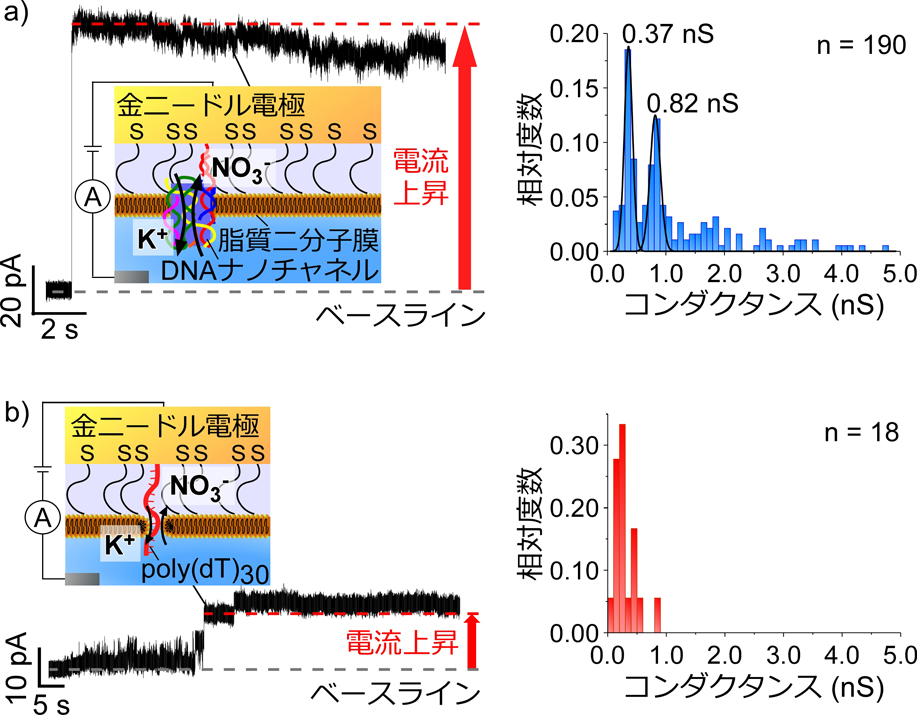
a)DNAナノチャネルプローブおよびb)poly(dT)30修飾金電極を用いて計測されたイオン電流シグナルおよび各電流シグナルから得られたコンダクタンスのヒストグラム.
また,興味深いことに,分子量が小さいPEGおよびpoly(dT)30を修飾した金電極を用いて膜形成およびイオン電流計測を行った結果,DNAナノチャネル修飾時よりも小さな電流上昇が確認された(図2b).そこで,分子動力学シミュレーションを用いてssDNAが脂質二分子膜中に挿入されることによる膜のイオン透過性を確認した.その結果,ssDNAが脂質二分子膜中に挿入されることで水分子およびイオンの通り道が形成されることが示唆されたため,本電流上昇がssDNAの膜挿入によって引き起こされたと考えられる.研究を始めた当初は,剛直性のないssDNAは脂質二分子膜に挿入されないと考えていたが,上記の結果は本技術を用いることで様々なDNA構造体を脂質二分子膜に挿入できる可能性を示唆しており,本プローブ技術が合成DNA膜分子の応用展開を加速させると信じている.一方,ssDNAのような剛直性のない構造体が膜に挿入されるメカニズムに関しては更なる調査が必要であり,今後実験およびシミュレーションの両観点から検証していく予定である.
上記のように,本技術によりDNAナノチャネルの膜挿入を実現することができたので,DNAナノチャネルの膜挿入効率を評価した(図3).具体的には,本DNAナノチャネルプローブを用いて脂質二分子膜を形成後5分以内にDNAナノチャネルの膜挿入イベントが発生する確率を調査した.また,比較実験として,従来研究と同様にDNAナノチャネルを金電極に固定化せず,浴溶液に加えた場合の挿入イベント発生確率も同様に調査した.脂質二分子膜を形成した回数および形成した脂質二分子膜に対して5分以内にDNAナノチャネルの膜挿入イベントが確認された回数を用いて膜挿入効率を求めた.その結果,DNAナノチャネルを金電極に固定化しなかった場合,52回の膜形成の内,膜挿入イベントが6回で,膜挿入確率は11.5%であった.一方,DNAナノチャネルプローブでは,63回の膜形成の内,膜挿入イベントが23回で,膜挿入確率は36.5%であり,従来手法と比較して3倍以上の膜挿入効率を有することが明らかとなった.
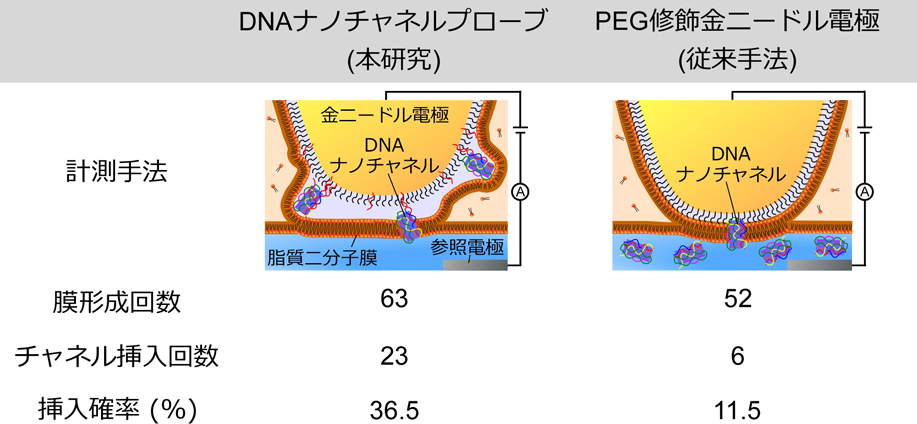
DNAナノチャネルプローブと従来手法におけるDNAナノチャネルの膜挿入効率.
さらに,PPT未修飾のDNAナノチャネルを固定化したDNAナノチャネルプローブの膜挿入効率を評価することでPPT修飾の影響を調査した.その結果,PPT未修飾のDNAナノチャネルの場合,膜挿入確率は36.1%であり,PPT修飾したDNAナノチャネルを固定化したDNAナノチャネルプローブ使用時と同等であることが確認された.
さらに,DNAに対する疎水性アンカーの修飾が不要になることで,疎水性相互作用による構造体凝集の改善やDNAナノチャネルの合成コスト削減が見込まれる.よって,膜挿入効率が高く疎水性分子の修飾を必要としない本DNAナノチャネルプローブ技術は,疎水性アンカーを用いた従来の膜挿入手法に代わり,DNAナノチャネルの膜挿入のための基盤技術となることが期待できる.
DNAナノチャネルは,設計・作製が容易であることから,合成ナノチャネルの中でも特に目覚ましい進歩を遂げている.特に,温度,分子や光などの外部刺激に応答して構造変化を引き起こす機能性を有したDNAナノチャネルは,今後ますます,化学センサや創薬などの分野において重要な役割を果たすようになることが予測される.しかしながら,DNAナノチャネルは膜挿入効率が低く,こうした応用展開を制限するボトルネックとなっていた.今回我々が開発したDNAナノチャネルプローブ技術は,この膜挿入効率の低さを大幅に改善し,DNAナノチャネルの応用展開を加速度的に進めることが期待できる.
現在,我々の研究グループでは,DNAナノチャネルプローブを精密に位置制御することで,任意の細胞や巨大リポソームに対してDNAナノチャネルを挿入可能なシステムの構築を目指している.本システムは,DNAナノチャネルによる単一細胞の機能制御や細胞内計測,合成ナノチャネルの膜挿入数を任意に制御した人工細胞構築の実現の可能性を有しており,DNAナノチャネルが医療や合成生物学などの分野で幅広く利用される足がかりになると確信している.
最後に,本稿で紹介した研究は,共同研究の成果であり,東北大学の馬淵拓哉先生と高橋潤さんに心より御礼申し上げたい.
赤井大夢(あかい ひろむ)
長岡技術科学大学大学院工学研究科先端工学専攻材料工学分野博士後期課程1年
小岩滉宜(こいわ ひろき)
長岡技術科学大学大学院工学研究科先端工学専攻材料工学分野博士後期課程1年
井澤幸広(いざわ ゆきひろ)
長岡技術科学大学大学院工学研究科工学専攻機械工学分野修士課程1年
庄司 観(しょうじ かん)
長岡技術科学大学技学研究院機械系准教授