2017 年 59 巻 8 号 p. 1653-1662
2017 年 59 巻 8 号 p. 1653-1662
近年の技術革新によって内視鏡技術の進歩は著しく,1,000倍の倍率によってリアルタイムに組織を観察しうる“optical biopsy”の時代に突入しつつある.筆者は2014年より共焦点内視鏡による消化管診断について研究を行ってきた.まず最初に,共焦点内視鏡に不可欠と考えられていたfluoresceinの静脈投与ではなく,ごく少量の滴下にてほぼ同等の画像を得ることに成功し,これを“fluorescein dripping method”として報告した.
胃においては共焦点内視鏡所見は非常に多彩で,未だ診断学は確立されていないが,胃癌の組織型類推は比較的容易に可能であり,生検の代替法として十分成立すると考える.現行の通常観察・拡大観察では鑑別が困難な十二指腸上皮性腫瘍の鑑別において,筆者は極めて有用な“ABC-C classification”を提唱している.今後は,欧米で盛んに行われはじめている共焦点内視鏡を用いた分子イメージングの研究に期待が寄せられる.
近年,消化管腫瘍に対する内視鏡診断技術の進歩には目覚ましいものがある.高解像度の通常白色光内視鏡観察に加えて,拡大内視鏡観察や,Blue Laser Imaging(BLI)やNarrow band imaging(NBI)に代表されるImage-enhanced endoscopy(IEE)の普及によって,消化管の腫瘍性病変の画像診断能は飛躍的に向上してきた.
一般的に市販され,広く普及しつつある拡大内視鏡は約100倍の拡大率を持ち,消化管粘膜の腺構造や微小血管を観察できるが,さらに,1,000倍の拡大率で消化管粘膜の細胞レベルでの観察を可能にした共焦点内視鏡(Confocal laser endomicroscopy;CLE)が市販されるようになった.CLEは,消化管粘膜の一定深度の細胞を水平断で,生体標本の病理診断と同等レベルでリアルタイムに観察し,“optical biopsy”を可能にし得る新たなモダリティーである.内視鏡診断学をさらに飛躍させる可能性を秘めてはいるが,国内での導入施設は2017年2月現在で11施設とまだ少なく,普及のためにはいくつか超えるべきハードルがあるのも実情である.
本稿では,CLEを行う前の準備からCLEの使い方,実際の観察方法,診断の仕方等について解説する.さらに,今後の展望についても述べたい.
現行で市販されているCLEはプローブタイプのみである.このprobe-based CLE(pCLE;Cellvizio:Mauna Kea Technologies,Paris,France)(Figure 1)の使用方法について解説する.
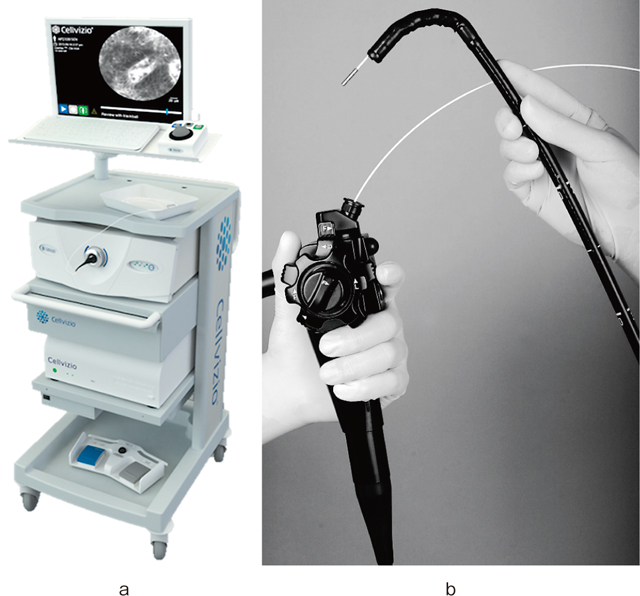
共焦点内視鏡【提供:Mauna Kea Technologies,Paris,France】.
a:Cellvizio®システム本体:Mauna Kea Technologies,Paris,France.
b:通常内視鏡の鉗子口から挿入されたプローブタイプの内視鏡.
pCLEは粘膜の一定深度を水平断で観察できるが,可視深度(焦点深度)は使用するプローブのタイプによって決まっており,焦点深度の自由な変更はできない.プローブのタイプは数種あるが,上部消化管用のGastroFlex-UHDと下部消化管用のColoFlex-UHDの焦点深度は,いずれも55-65μmに設定されている.
気管支・肺胞領域では肺の構成物質であるエラスチンやマクロファージなどが自家蛍光を有しており,pCLEを目的部位に当てるだけで画像を得ることが可能であるが,pCLEによる消化管組織の視覚化には,蛍光色素剤による染色が必須である.蛍光色素剤としては当初,核染色も可能なacriflavine等も試用されたが,安全性の問題もあり,現在欧米で一般的に行われているのは10% fluorescein 2.5-10.0mLの静脈投与である 1),2).画像が最も鮮明に得られるのは10% fluorescein 5.0mLで,それ以上の投与は輝度が明るくなり過ぎてしまうという報告もある 2).
Fluorescein静脈投与自体は,眼科領域の外来診療では本邦においても一般的に行われているが,欧米では眼科領域同様に消化管領域でもfluorescein静脈投与は比較的安全に使用可能と考えられている.2010年のWallaceらの報告では,fluorescein静脈投与によって消化管CLEが施行された16施設,2,272人の対象のうち,副作用を起こした症例が1.4%で,いずれも軽い副作用であったとされている 3).しかしながら,極めて稀ではあるがショックなどの重篤な副作用の報告があるのも事実である 4),5).内視鏡検査時のfluorescein静脈投与は日本では保険収載されておらず,蛍光色素剤の静脈投与自体にも抵抗があり,pCLE普及の最大の妨げとなっている.
われわれは,fluorescein(フルオレサイト®静注500mg,日本アルコム)(Figure 2)極少量を粘膜表面に滴下することにより,静脈投与と同等に良好な消化管粘膜のpCLE画像を得ることに世界で初めて成功し,報告している 6),7).われわれはこの方法を“Fluorescein dripping method(フルオレセイン滴下法)”として提唱しているが,数滴のfluoresceinを観察したい粘膜表面あるいは病変表面に滴下するのみであるので(Figure 3),一般的にCLEで行われている10% fluorescein 2.5-10.0mLの静脈投与と比べてより安全に検査が行えるのではないかと考えている.仮に数滴のfluoresceinを胃内の病変に滴下した場合,その後洗い流すように胃内に広げれば,胃から十二指腸まですべての粘膜面でプローブを当てただけで充分に評価しうるCLE画像が得られる.滴下後,特に粘膜内への浸透を待つ必要はなく,滴下に使用した色素撒布チューブを鉗子孔から速やかに抜去し,プローブを鉗子口から挿入して観察部位に到達した時点ではすでに画像が得られる状況になっている.ちなみに,内視鏡治療後の切除標本にfluoresceinを滴下してプローブを当ててもCLE画像を得ることが可能である.

蛍光色素剤.
fluorescein(フルオレサイト®静注500mg,日本アルコム).
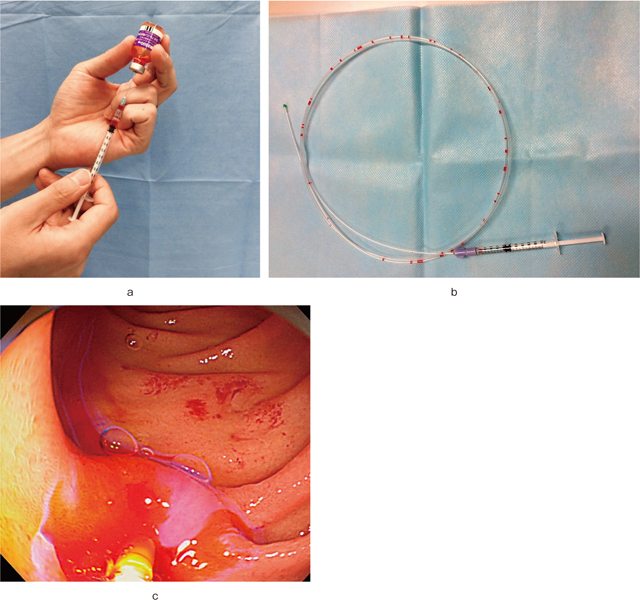
Fluorescein dripping method.
a:蛍光色素剤(フルオレサイト®静注500mg)1ml弱を注射器に準備する.
b:注射器に準備していた蛍光色素剤を撒布チューブ内にとおしておく.実際に滴下して使用するのは,撒布チューブ内の数滴のみである.
c:十二指腸粘膜に蛍光色素剤を2滴滴下した直後の通常内視鏡所見.
動物実験においてはfluorescein静脈投与後20秒ほどで画像が得られ,投与後8分以内が最も鮮明な画像が得られたと報告されている 8).筆者は粘膜滴下・静脈投与ともに,投与後30分以上経過後も評価に値する鮮明な画像が継続して得られることを経験している.
筆者はpCLE導入後から現在までに170例以上の症例においてfluorescein dripping methodで検査を行っているが,fluorescein静脈投与では必発である尿の黄染も含めて副作用の出現を経験していない 9).また,fluorescein dripping methodの妥当性のため,fluorescein静脈投与後および滴下後の消化管粘膜内におけるfluoresceinの分布を解析したところ,短時間でほぼ同等の粘膜・細胞内分布を示すことを確認している 10).一方,fluorescein dripping methodのデメリットは静脈投与と比較して血管の描出が弱いという点であるが(Figure 4),粘膜表層から55-65μm程度の深度に存在する微小血管の評価はNBI併用拡大観察で容易に行えることを考えると,あえてリスクを冒して静脈投与にこだわる必要はないのではないかと筆者は考える.勿論,内視鏡検査時のfluoresceinの静脈投与のみならず粘膜滴下も保険収載されていない現状では,日常検査時のfluorescein使用自体が困難であることにはかわりない.Fluorescein使用によるpCLEの実施に関しては,今後,多施設での症例の蓄積と安全性の確認が必要である.
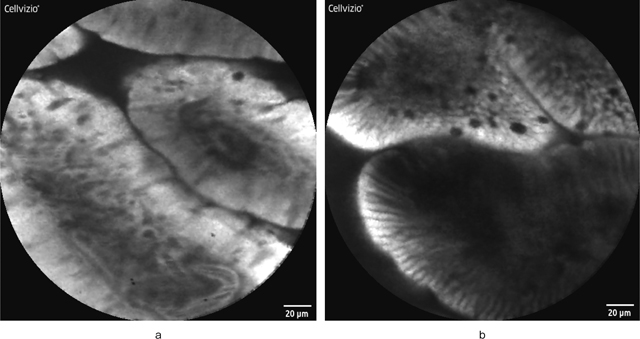
Fluorescein投与法と共焦点内視鏡画像.
a:fluorescein静脈投与後の十二指腸正常絨毛の共焦点内視鏡所見.間質内の微小血管内を蛍光色素剤が流れることによって,血管の輪郭が白色明調に描出され,血管内を流れる暗調の赤血球がリアルタイムに観察される.
b:fluorescein粘膜滴下後の十二指腸正常絨毛の共焦点内視鏡所見.絨毛構造自体の画像はaとほぼ同等であるが,aと比較して血管の描出が悪い.
蛍光色素剤滴下によって通常観察時の微妙な色調変化を来す可能性があることや,プローブの接触によって出血を来すとNBI観察が困難になるため,pCLE検査は一連の内視鏡検査の最後に行うべきである.必要な一連の検査終了後,GastroFlex-UHD(焦点深度55-65μm,視野範囲240μm2)を鉗子口から挿入し,目的部位(病変・粘膜)に軽く接触させる.pCLE検査自体は,粘膜表面からの,ある一定の焦点深度面を観察しているため,粘膜表面の粘液や血液の影響は受けないという特徴がある.
pCLE検査は,蛍光色素剤投与後に観察したい領域・病変の表面にプローブを当てるだけの非常に簡便な検査法であるが,拡大倍率が高いので,プローブのわずかな動きで画像も不安定となる.安定した良好な画像を得るためのコツとしては,透明のアタッチメントを長めに装着して,内視鏡先端を粘膜に固定してプローブを目的部位に当てることである.蠕動が強い場合,当院では積極的に鎮痙剤を使用してpCLE検査を行うようにしている.
プローブの粘膜への押し付ける力の強弱で多少の観察深度の変化はありうるが,実際にプローブを強く押し当てても粘膜表層から100μm付近までリンパ腫細胞浸潤を認めている十二指腸濾胞性リンパ腫の症例でリンパ腫細胞浸潤を観察することはできなかった(Figure 5).

十二指腸濾胞性リンパ腫.
a:通常白色光観察において,十二指腸下行脚に白色小顆粒状隆起の集簇を認めた.
b:病変部位をNBI拡大観察施行すると,周囲の正常十二指腸絨毛と同様の所見であった.
c:共焦点内視鏡所見も,周囲の正常十二指腸絨毛と同様の所見であった.
d:リンパ腫細胞の浸潤を認めたが,表層より100μm以内にはほとんどリンパ腫細胞浸潤を認めなかった.
組織像をリアルタイムに観察しうるpCLEの画像は,プレパラートで観察する病理組織像に類似しているが,通常の病理組織標本が粘膜表面に対して垂直方向の断面をみているのに対して,pCLE画像はレンズ面と平行な水平方向の断面をみている画像であることに注意して診断することが必要である.さらに,粘膜表面を観察している超拡大内視鏡であるEndocytoscopyと異なり,粘膜表面から一定の深度面の粘膜組織を観察しているということも念頭において診断をする必要がある.また,得られるのは輝度情報のみのため,個々の細胞は白黒コントラスト画像で描出される.既存の病理診断学に基づいた組織形態の基本的理解が必要なことは言うまでもないが,pCLE画像の白と黒がいったい何を表しているのかを理解することなしにpCLEを用いた内視鏡診断を行うことは不可能である.まず,蛍光色素剤が存在する領域が白色明調に描出され,反対に蛍光色素剤が存在しない領域が黒色暗調に描出されることを理解することが大前提となる.fluoresceinは核に取り込まれないため,基本的に核の形態は観察し得ない.上述のような特徴から考えても共焦点内視鏡による消化管診断学は,病理医が細胞異型と構造異型を併せて診断する既存の病理診断学とは分けて考えるべきなのかもしれない.
胃は部位による組織学的な相違やH. pylori感染の有無によってNBI拡大観察所見が多彩であるのと同様に,CLE所見も非常に多彩で診断が容易ではない.消化管領域において現在広く使用されている診断分類は2011年に欧米から報告されたMiami分類であり 11),この分類ではnormal stomach,gastritis,gastric dysplasia,gastric adenocarcinomaに区分されているが,病理学的にも詳細な観察は行われておらず,組織型によるCLE画像の違いも記載がないのが実情である.Zhangら 12)がCLE画像と病理組織像を検討しており,未分化型腺癌であれば腺構造が消失して異型細胞がびまん性に観察され,分化型腺癌であれば異常な腺構造が出現すると報告している.
筆者が経験した胃の特徴的なCLE画像を提示する(Figure 6).H. pylori陰性の正常胃底腺領域ではFigure 6-aのような円形の腺窩を認め,幽門腺領域ではFigure 6-bのような腺構造を認める.腸上皮化生粘膜では明瞭な腺構造の中に,粘液を有した杯細胞が黒色暗調の細胞として散在して観察される(Figure 6-c).分化型癌では黒色暗調の不整な腺構造が認められ(Figure 6-d),未分化型癌では腺構造を認めなくなり,大小不同の黒色暗調細胞をびまん性に認めるようになる(Figure 6-e).胃MALTリンパ腫においては均一な細胞が密に存在した画像として観察される(Figure 6-f).
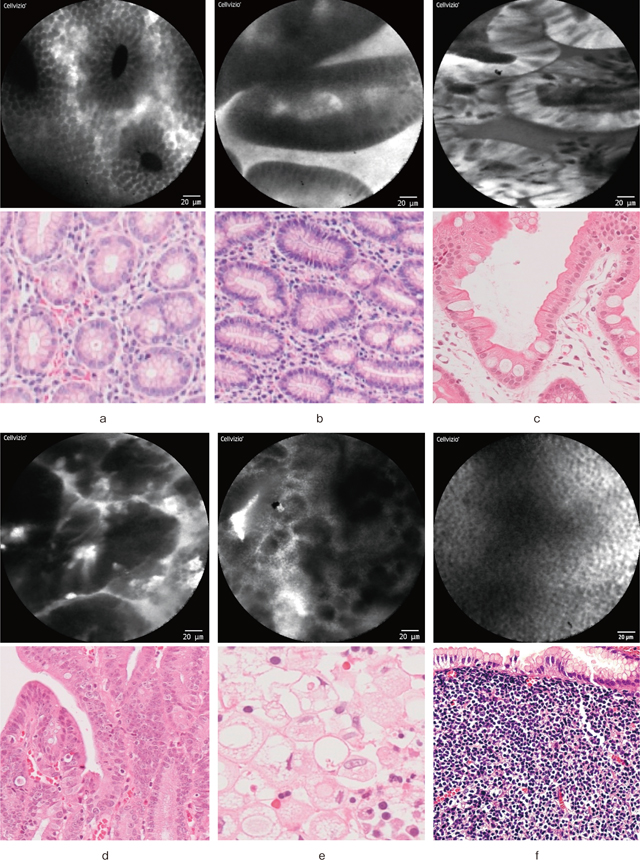
胃の共焦点内視鏡所見と対応する組織所見.
a:正常胃底腺粘膜.
b:正常幽門腺粘膜.
c:腸上皮化生.
d:分化型腺癌.
e:未分化型腺癌.
f:胃MALTリンパ腫.
Figure 6のaからeについては,「胃と腸」51(5):634-640,2016 Figure 6より一部改変して転載.
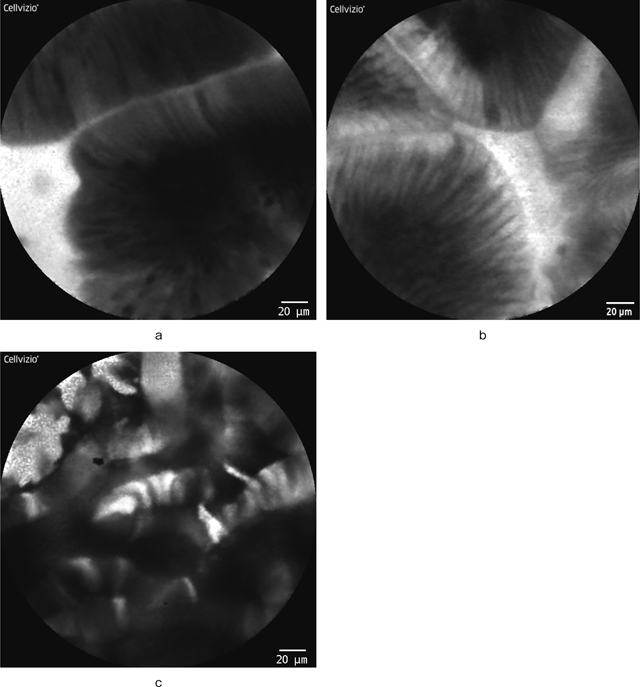
十二指腸は他の消化管と比較して,CLE画像が最も鮮明で確実に描出される臓器である.まずはじめに正常十二指腸絨毛のpCLE画像を提示するが,白色で明るい均一な上皮細胞が観察され,絨毛の辺縁は整で明瞭である(Figure 7-a).粘液を有した杯細胞は,黒色暗調の細胞として描出される.
十二指腸の共焦点内視鏡所見.
a:十二指腸正常絨毛.
b:十二指腸腺腫.
c:十二指腸癌.
世界で初めて筆者らが十二指腸におけるCLE画像と病理学的所見の解析を行い,報告している 9).その中でわれわれは非常にシンプルな2つの所見を“apical-basal connecting(ABC)sign”,“chaos sign”として提唱している.まずABC signについて解説する.正常十二指腸絨毛や低異型度腺腫をpCLEで観察すると,辺縁が整な明瞭な腺構造を呈し,円柱状の規則正しく配列した明るい上皮細胞が観察できる(Figure 7-b).われわれはこのように細胞が規則正しく配列して,細胞間と想定される黒色暗調のラインとfluoresceinを含んだ細胞質と想定される白色明調のラインが交互に規則正しく配列したイメージをABC signと呼んでいる.次にchaos signについて解説する.十二指腸高度異型腺腫や十二指腸癌を観察すると,腺構造は不鮮明化し,fluoresceinの溜まりと想定される大小不同の白色明調領域が不規則に散在し,個々の細胞も白色明調と黒色暗調の濃淡が様々で,それらが混在したような,全体的に暗めの画像所見となる(Figure 7-c).われわれは白黒の混在した,この全く規則性の存在しない混沌としたイメージを“Chaos sign”と呼んでいる.さらに,この2つのsignの組み合わせから成る4つの範疇をABC-C classificationとして提唱し(Figure 8),ABC-C1であれば正常あるいは低異型度の腺腫,ABC-C2から4であれば,高度異型腺腫あるいは十二指腸癌と非常に高い感度・特異度で鑑別できることを報告している 9).
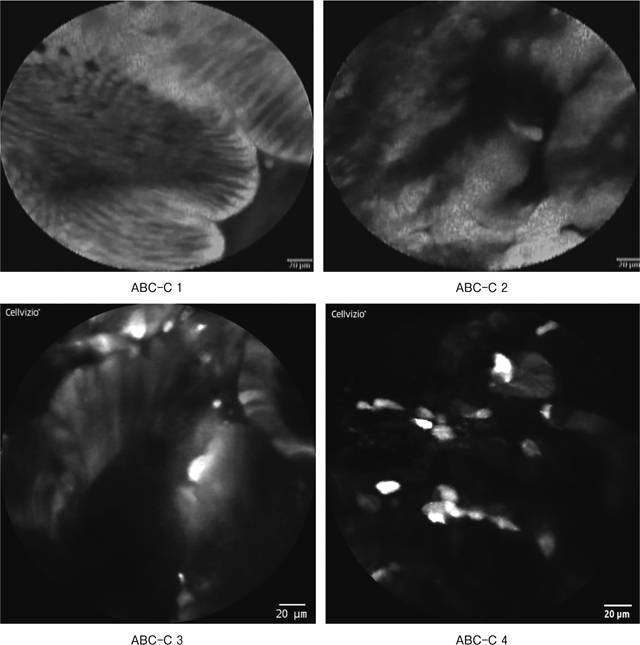
十二指腸上皮性腫瘍の診断基準(ABC-C classification).
ABC-C1:“Chaos sign”陰性,“ABC sign”陽性.
ABC-C2:“Chaos sign”陰性,“ABC sign”陰性.
ABC-C3:“Chaos sign”陽性,“ABC sign”陽性.
ABC-C4:“Chaos sign”陽性,“ABC sign”陰性.
Nonaka K, et al. Development of a new classification for in vivo diagnosis of duodenal epithelial tumors with confocal laser endomicroscopy : A pilot study. Dig Endosc 28:186-193,2016 Figure 7より一部改変して転載.
十二指腸濾胞性リンパ腫のpCLE画像もすでに報告しているが 13),リンパ腫細胞が深部より上皮直下(表層から55μ程度)まで浸潤を来すと,胃MALTリンパ腫のpCLE画像と同様に均一な細胞が密に存在した画像を描出できる.
欧米においては,分子イメージング(molecular imaging)という生体内での分子プロセスの可視化,共焦点内視鏡を用いて行う基礎的・臨床的研究が進んできている.Atreyaら 14)は共焦点内視鏡を用いた分子イメージングによってIBD患者における抗TNF抗体の治療効果予測の有用性を報告している.Foerschら 15)やGoetzら 16)はex vivoではあるが消化管癌で過剰発現したVEGFなどを可視化することに成功している.今後本邦でもmolecular imagingに期待が寄せられている.
胃・十二指腸におけるCLE開始前の準備から,実際の検査方法,実際のCLE画像について筆者らの経験を含めて解説した.今後は単なる超拡大内視鏡としてのみならず,molecular imagingを含めた革新的な診断学としての発展が期待される.
本論文内容に関連する著者の利益相反:なし