2018 年 60 巻 12 号 p. 2519-2529
2018 年 60 巻 12 号 p. 2519-2529
Helicobacter pylori(H. pylori)感染は胃癌などの疾患リスクと関連しており,内視鏡観察時にはH. pylori感染状態に合わせた好発疾患・好発部位に注意する必要がある.内視鏡によるH. pylori感染診断は未感染・現感染・除菌後(自然除菌含む)の3つの状態に特徴的な胃粘膜所見を用いて行い,その局在と頻度は“胃炎の京都分類”にまとめられている.H. pylori未感染の診断は胃角までのRAC(regular arrangement of collecting venules)が有用であり,現感染診断はびまん性発赤・内視鏡的萎縮,除菌後診断には地図状発赤などの所見を用いて診断する.一方,内視鏡による感染診断の注意点として,PPI(proton pump inhibitor)などの薬剤により未感染例でもRACが不明瞭化すること,現感染例・除菌後例でも体部の集合細静脈がみられる例があること,びまん性発赤の判定が難しい例があることなどが挙げられる.内視鏡的なH. pylori感染診断は一つの所見にとらわれずに総合的に判断する必要がある.また,H. pylori感染診断のみに注視しすぎて内視鏡本来の目的である病変発見を忘れないように,バランスのとれた内視鏡観察を行う必要がある.
内視鏡機器の進歩に伴い詳細な胃粘膜の観察が可能になった.この様な時代においても漫然とした内視鏡観察をせずに,“患者ごとの疾患リスクを考慮しながら内視鏡観察を行う”という基本姿勢を忘れてはならない.Helicobacter pylori(H. pylori)感染は,胃潰瘍・胃癌などの疾患リスクと深く関連しており,H. pylori感染者は未感染者に比べて疾患リスクを有することから,H. pylori感染状態を考慮しながら内視鏡観察を行う必要がある.
H. pylori感染診断には,血清抗体法・尿素呼気法・便中抗原などの種々の検査法があり,内視鏡検査のみでH. pylori感染を診断するわけではない.しかし,内視鏡前にH. pylori感染が分からない時でも,胃粘膜の状態からH. pylori感染を予測し,感染状態にあわせた好発疾患・好発部位に注意しながら内視鏡観察を行うことは“意義がある”ことである.
2014年に“胃炎の京都分類”が提唱され 1),H. pylori現感染・未感染・除菌後(自然除菌含む)における胃粘膜の内視鏡的特徴が示された.この分類では内視鏡所見がみられる頻度・局在を3つのH. pylori感染状態に合わせてまとめており,以前のSydney分類などに比べて本邦の内視鏡医にも使いやすい内容となっている(Table 1).

胃炎の京都分類(文献1より引用).
本項では胃炎の京都分類に沿った内視鏡によるH. pylori感染診断とその注意点について述べる.
内視鏡医は検査施行前に,被験者のH. pylori関連情報を確認しておく必要がある.(1)H. pylori感染診断を受けたことがあるか,(2)その診断方法と結果,(3)H. pylori除菌歴があるか,(4)その判定方法とその結果,について問診しておく.そのほか,胃・十二指腸潰瘍などのH. pylori関連疾患の既往や,PPI(proton pump inhibitor)・NSAIDs・バイアスピリン・直近の抗生物質などのH. pylori感染と胃粘膜へ影響を与える薬剤の内服状況についても確認しておく.
H. pylori未感染者(正常胃粘膜)の内視鏡像の基本は,RAC(regular arrangement of collecting venules)とよばれるヒトデ型の集合細静脈が胃底腺領域に規則的にみられることである 2)(Figure 1).同部位を拡大内視鏡で観察すると,円形構造を取り巻く血管網と,血管網に連続した集合細静脈がみられる(Figure 2-a).これは酸・ペプシン分泌を行う円形の胃底腺開口部,胃底腺を取り巻く細動脈の上皮下血管網(subepithelial capillary network;SECN),さらにSECNと連続する太い集合細静脈(collecting venule;CV)と組織学的に関連している.一方,前庭部の幽門腺領域では粘液分泌を行う腺開口部が溝状に連続しているため集合細静脈はみられない(Figure 2-b).一般的に胃底腺領域は胃角付近までだが,幽門輪近くまでみられる例もある.その他,H. pylori未感染例でみられる所見として,線状発赤(稜線状発赤:red streak)・黒色付着物(ヘマチン:hematin)・幽門輪付近の隆起型びらん(raised erosion)・正色調の亜有茎性ポリープ(胃底腺ポリープ:fundic gland polyp)などがある.

H. pylori未感染者にみられる規則的な集合細静脈(RAC).
a:体部.
b:胃角小彎.

胃粘膜の拡大内視鏡像・組織像・シェーマ.
a:胃底腺領域.
b:幽門腺領域.
H. pylori未感染患者の疾患リスクは,十分な酸分泌を保つことによる逆流性食道炎,それに続くBarrett食道・Barrett食道癌が挙げられる.胃癌についてはH. pylori陽性患者より低リスクであるが,近年,H. pylori未感染例にみられる胃癌の特徴(噴門部癌・印環細胞癌・胃型形質をもつ癌など)が報告されており注意が必要である 3).
RACはH. pylori未感染診断に感度・特異度とも高い所見であるが,集合細静脈自体は未感染粘膜以外に観察されることから注意が必要である.H. pylori現感染でも十二指腸潰瘍などの前庭部優位胃炎がみられる例は,体部胃炎が目立たないため集合細静脈が観察されることがある(Figure 3).また,体部胃炎が目立つ現感染例においても変形した集合細静脈がみられることがある 4)(Figure 4).一方,H. pylori除菌例でも炎症の改善に伴い体部の非萎縮域に集合細静脈がみられることがある(Figure 5).八木らはH. pylori未感染の診断では体下部~胃角小彎まで集合細静脈が規則的にみえることが重要と報告しており 2),H. pylori感染診断においては集合細静脈の分布・形状,特に胃角小彎の所見に注意して行う必要がある.また,H. pylori未感染染の内視鏡診断にはRACの存在のみではなく,内視鏡的萎縮や粘膜発赤の有無を含めた総合的な判断が必要である.

H. pylori現感染(十二指腸潰瘍症例)にみられた体部の集合細静脈.C-2の内視鏡的萎縮を伴っていた.
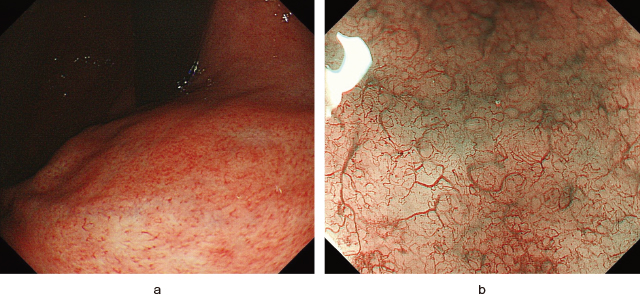
a:H. pylori現感染例にみられた不均一な分布を伴う変形した集合細静脈.
b:NBI拡大内視鏡では不規則な微小血管の走行と集合細静脈がみられ,炎症の影響が考えられた.

a:H. pylori除菌例の体部(非萎縮域)にみられた集合細静脈.
b:拡大内視鏡にて集合細静脈が観察される.
近年PPIなどの薬剤投与による胃粘膜の肥厚がみられる機会が増えてきている.このような例ではH. pylori未感染例でも粘膜肥厚に伴い集合細静脈がみられないことがあり,PPI中止やH2受容体拮抗薬(histamine type 2 receptor antagonist)変更後に粘膜肥厚の改善とともにRACがみられる例がある(Figure 6).H. pylori感染診断には薬剤による胃粘膜の変化についても覚えておく必要がある.

a:H. pylori未感染例のPPI長期投与による粘膜肥厚・ひび割れ所見・RAC不明瞭化.
b:同症例はH2RA変更後にRACがみられた.
H. pylori感染が生じると胃粘膜固有層に炎症細胞(好中球・リンパ球)浸潤がみられ,持続的な炎症により腺萎縮・腸上皮化生がみられる.H. pylori現感染の胃底腺領域を拡大内視鏡で観察すると,規則的な血管網・集合細静脈がみられない例が多い.また,組織学的腺萎縮や偽幽門腺化生がみられる部位では,胃底腺本来の円形な腺開口部の形状が変化し,幽門腺様の管状・顆粒状構造がみられることがある 5)(Figure 7).

H. pylori感染に伴う組織変化と拡大内視鏡像の変化.
H. pylori現感染の通常内視鏡観察では,炎症関連の所見(粘膜全体のびまん性発赤(diffuse redness)・点状発赤(spotty redness)・皺壁腫大・蛇行(enlarged fold)・白濁粘液(sticky mucus))がみられることが多い(Figure 8-a).前庭部のびまん性小結節隆起(鳥肌:nodularity)は高度炎症に伴うリンパ濾胞と関連があり,未分化型癌と関連する報告がみられるため注意が必要である 6).脂質を貪食した組織球の集簇である黄色腫(xanthoma)もH. pylori感染患者でみられる所見である.

H. pylori現感染状態の内視鏡像.
a:びまん性発赤・点状発赤・皺壁腫大・白濁粘液.
b:内視鏡的萎縮.
一方,慢性炎症の持続により腺萎縮が生じた部位には内視鏡的萎縮(atrophy)がみられる(Figure 8-b).木村・竹本らは内視鏡的萎縮を前庭部から体部小彎〜大彎まで段階的にC-1~O-3まで分類している 7).また,前庭部を中心とした萎縮域に灰白色の粘膜変化がみられることがあり,組織学的腸上皮化生と関連する所見である 8).灰白色粘膜変化はH. pylori感染粘膜にみられる特徴的な所見であるが,組織学的腸上皮化生は灰白色部位以外にも散見されることが報告されており 9),通常内視鏡による組織学的腸上皮化生の診断には限界がある.
H. pylori感染者における疾患発生リスクは感染の分布によって異なることが報告されている.前庭部中心に炎症がみられる“前庭部優位胃炎”では十二指腸潰瘍例のリスクが高い.また,炎症が前庭部から体部に広く及ぶ“pan-gastritis”では胃潰瘍や未分化型癌のリスクが高くなる.未分化型癌は萎縮境界〜非萎縮域に褪色病変としてみられ注意が必要である.さらに,萎縮が高度になり“体部優位胃炎”となると萎縮域に発赤調としてみられる分化型癌のリスクが高くなる.
H. pylori現感染では炎症に伴うびまん性発赤の所見が重要であるが,以前からその診断能が問題とされてきた 10).これについては,初学者より熟練者の診断能が高いことから,熟練者は初学者に対し適切な画像を用いたトレーニングを指導すべきである 11).一方,H. pylori現感染例のなかには熟練者であってもびまん性発赤の判断に苦慮する例がある 12).実際,胃底腺領域をNBI併用拡大内視鏡にて観察すると,びまん性発赤が目立つ例では微小血管密度の増加とBrown色調が強くみられるが(Figure 9),びまん性発赤が目立たない例では血管走行の不整が目立つものの密度が低くBrown色調が弱い例がある(Figure 10).このような例では熟練者においても判断が難しく,術者間の一致率も低下すると考えられる.一つの所見のみでは判断が難しい限界例が存在することから,H. pylori現感染診断においては点状発赤・皺壁腫大・白濁粘液・内視鏡的萎縮などの所見を総合的に判断する必要がある.

a:びまん性発赤の目立つH. pylori現感染例.
b:NBI拡大内視鏡ではBrown色調の変化が目立つ.

a:びまん性発赤の目立たないH. pylori現感染例.
b:NBI拡大内視鏡では血管走行の不整はみられるがBrown色調の変化が目立たない.
また内視鏡的萎縮の判定において,H. pylori未感染者の中に前庭部のわずかな萎縮様変化(C-1程度)がみられることがある(Figure 11).これは幽門腺組織の粘膜固有層の厚さが胃底腺粘膜より薄いことと関連していると思われ,H. pylori感染診断時にはC-2以上の内視鏡的萎縮を積極的に捉えるべきと考えられる.

H. pylori未感染例でも幽門腺の組織学的特徴により前庭部にC-1程度の萎縮様変化がみられることがあり注意が必要である.
H. pylori除菌により胃粘膜の組織学的胃炎は改善がされるが,組織学的腺萎縮や腸上皮化生はその多くが残存する.そのためH. pylori除菌後の内視鏡所見は,びまん性発赤・点状発赤・皺壁腫大・白濁粘液などの所見が改善するが,内視鏡的萎縮・灰白色粘膜など所見は持続してみられる(Figure 12).

a:H. pylori現感染例.
b:同症例の除菌後の内視鏡像では,びまん性発赤・白濁粘液の改善・地図状発赤がみられるが,内視鏡的萎縮は残存する.
一方,除菌後に特異的な所見として体部~前庭部にみられる“境界明瞭・陥凹した発赤”がみられることがあり,地図状発赤(map-like redness)として認識される(Figure 13).同部位からは高率に腸上皮化生がみられることから除菌前に存在した組織学的腸上皮化生部位との関連が考えられている 13).

a:H. pylori除菌例にみられた境界明瞭・陥凹した発赤(地図状発赤).
b:前庭部では地図状発赤は斑状にみえることが多い.
H. pylori除菌後の疾患リスクは潰瘍・胃癌ともに軽減されるが,除菌後の発癌も多数報告されており引き続き注意深い観察が必要である.特に近年,境界不明瞭な除菌後胃癌の特徴が報告されている.また,Nawataらは除菌後にみられる萎縮域と非萎縮域の“色調逆転現象”に関して,本現象がみられた例に除菌後胃癌が多くみられたことを報告 14)しており,今後注意すべき所見と考えられる.
内視鏡的萎縮はH. pylori現感染・除菌後のどちらにも存在することから,萎縮所見のみで両者を診断することは難しい.そのため非萎縮域のびまん性発赤・皺壁腫大・白濁粘液などの炎症関連所見とあわせてH. pylori除菌後状態を診断する必要がある.一方,境界明瞭な地図状・斑状発赤はH. pylori除菌後に特異的であり,同所見がみられる場合には除菌後状態と積極的に診断して良いと考えられる.
H. pylori現感染状態の診断で述べたように,H. pylori除菌後の判定にもトレーニングを要することや,熟練者でも判断が難しい例が存在するため,各所見を用いて総合的に判断する必要がある.
“胃炎の京都分類”で記載されている内視鏡所見は,すでに多くの内視鏡医が経験的に熟知している内容であると思われるが,改めて内視鏡所見を体系的にとらえて分類し,内視鏡所見・用語を統一することで,施設間での均てん化が図られる.また,同分類は初学者の指導にも有用性が高いと思われる.
内視鏡によるH. pylori感染診断は通常内視鏡による白色光観察が基本であり,本項で述べた拡大内視鏡観察をルーチンに行う必要はない.しかし,H. pylori感染と関連する組織学的変化や,胃粘膜の微小血管・構造の変化を覚えることにより,通常内視鏡像に対する理解が深まり,しいては診断力を高めると思われる.
一方,H. pylori感染診断は疾患リスクを判定するのに重要であるが,感染診断に注視しすぎて胃癌などの病変を見逃すことがあれば本末転倒である.内視鏡観察は“H. pylori感染状態”と“病変の発見”をバランスよく行わなければならない.
本邦のH. pylori感染率は年代とともに低下しており,さらに2013年の「H. pylori除菌適応拡大」に伴い除菌療法が急速に広がっていることから,今後は現感染状態の胃粘膜所見の減少,未感染・除菌後状態の増加が予想される.時代背景の変遷はあるが,いままで積み重ねられてきた基本事項を熟知しながら内視鏡で“よく視る”必要がある.
本論文内容に関連する著者の利益相反:なし