2017 年 34 巻 2 号 p. 88-92
2017 年 34 巻 2 号 p. 88-92
近年,白血病やリンパ腫,種々の固形癌の診断や治療の選択に遺伝子検査が用いられるようになってきた。甲状腺腫瘍でも,これまで遺伝子変異に関する研究は数多く行われており,それぞれの組織型と関連が深い遺伝子異常(BRAF変異,RAS変異,RET再構成,PAX8/PPARγ再構成)などや腫瘍のプログレッションに関係する遺伝子異常(TERT変異,p53変異)などが報告されてきた。これらの遺伝子変異は甲状腺癌の形態診断の限界ともいえる判定困難領域(WDT-UMP,FT-UMP,NIFTP)に有用な情報をもたらすものであり,また,腫瘍の悪性度を形態像とは異なる面から推定できる可能性がある。本稿では,甲状腺腫瘍の組織型と遺伝子異常の関係を述べ,遺伝子異常からみた新しい分類を提唱した。さらに従来の形態診断に遺伝子診断を併用する可能性について記した。
現在,日本における甲状腺結節の術前診断は,超音波検査と細胞診の2つがゴールデンスタンダードとなっている。細胞診による術前診断は,甲状腺癌取扱い規約,甲状腺結節ガイドライン分類,ベセスダシステムなどの基準に従って診断されているが,いずれの分類でも判定困難な領域があることは周知の事実であろう[1,2]。すなわち「鑑別困難」,「判定困難」と呼ばれるカテゴリーである。また濾胞性腫瘍の良悪性は浸潤像の有無によって規定されているので,細胞診では「濾胞癌」の診断は難しく,「濾胞性腫瘍」のカテゴリーの中に止めざるをえないのが現状だ。これら細胞診における問題は,これまで長い間議論されてきたが,本質的な解決にはいたっていない。多分,形態診断における限界を示唆していると思われる。
癌における遺伝子検査は,それぞれの癌に特有な遺伝子の異常を検出することにより,その癌の組織型や進展度(予後)の診断,治療方針の決定のために行う。近年,遺伝子検査は著しく進歩しており,とくに白血病や悪性リンパ腫などの造血器腫瘍,軟部肉腫や一部の固形癌の診断には不可欠なものとなっている。甲状腺癌においては家族性髄様癌のみならず,濾胞上皮細胞由来の悪性腫瘍でも遺伝子変異の研究がこれまで活発に行われてきた。すでに甲状腺結節の遺伝子検査も一部の施設では始まっているが,本邦ではまだまだ一般化しているとはいい難い。
本稿では,甲状腺癌における遺伝子異常の基礎知識を記載し,これらの遺伝子異常が腫瘍診断にどこまで有用かについて述べていくことにする。
組織診断や細胞診断などの形態診断には常に限界がつきまとう。甲状腺癌においても以前よりいくつかの問題が指摘されてきた。遺伝子診断によって形態診断における問題点が補えるかどうかが問題となってくるといえよう。
甲状腺癌の90%以上を占める乳頭癌,濾胞癌では,それぞれ組織学的診断基準が異なる。すなわち,乳頭癌は核所見(核の溝,核内細胞質封入体,すりガラス状核)に診断が規定されている。乳頭癌の組織,細胞診断上の問題の本質は,核所見の量的ないしは質的な客観的基準は出されていないことである。つまり,腫瘍細胞の核が乳頭癌核の所見に類似するが一部(少数)の場合,核形態が乳頭癌核として典型的とはいえない場合などに,それを乳頭癌とするか腺腫とするかが悩ましい。著者のところに寄せられるコンサルテーションでも,しばしば問題となるところである。このような境界的部分を悪性と評価すると必然的に過剰診断の可能性が生じ,被包性濾胞型乳頭癌の頻度が多くなるのは自明の理といえる。米国における濾胞型乳頭癌の頻度が日本のものよりも明らかに高いのはこのためかもしれない。実際,日本と米国の病理医で同じ検体で診断したところ,米国の病理医の中に飛び抜けて乳頭癌の診断が多かったことが報告されている。
一方,このような中途半端な所見からは癌という言葉を使わずに中間的な概念を使用しようというのがWDT-UMP(well differentiated tumor with uncertain malignant potential),FT-UMP(follicular tumor with uncertain malignant potential)であり[3],また近年において被包性濾胞型乳頭癌の過剰診断を防ぐ実利的な観点から提唱されたのがNIFTP(non-invasive follicular thyroid neoplasm with papillary-like nuclear feature)である[4]。しかしながら,これらの中間的概念や実利的概念を導入したとしても,前述の問題が完全に解決できたとはいえない。一方,濾胞腺腫か濾胞癌の鑑別診断は浸潤像の有無により,おのずと細胞診による術前診断に困難をもたらしている。
図1に乳頭癌,濾胞癌,濾胞腺腫とそれらの診断における中間的な概念を記載した。これらの概念は新しいWHO分類(甲状腺腫瘍)で採用となり,日常的に使用されることになるものである。

濾胞性甲状腺腫瘍の相関図
図2に甲状腺濾胞上皮細胞の増殖シグナル経路をあげた。これらの増殖シグナル経路に関係したタンパクをコードする遺伝子が甲状腺腫瘍の発生に重要である。紙面の都合上,それらの遺伝子の詳細については他にゆずることにし,ここでは遺伝子変異と組織型との関連についてのみ記載することにする。

甲状腺の増殖シグナル経路
甲状腺濾胞上皮細胞由来の分化癌における遺伝子変異で最も注目されてきたのはMARK(mitogen-activated protein kinase)系にあるタンパクをコードする遺伝子である。また,MARK系以外ではPI3K/AKT/mTOR系も甲状腺分化癌の増殖に関わっているようだが,その関与はMARK系に比較して乏しい。
MARK系では,BRAF変異,RAS変異,RET再構成が重要である。とくにBRAF変異とRET再構成は乳頭癌の発生に関連し,RAS変異は濾胞腺腫,濾胞癌,濾胞型乳頭癌,NIFTPの発生に重要な遺伝子変異である(図3,4)[5]。さらに,充実型乳頭癌はRET/PTC3,篩状型乳頭癌にはAPC変異など特別な遺伝子変異があることが知られている。特殊なものとして,濾胞腺腫,濾胞癌におけるPAX8/PPARγ再構成をあげることができる。一方,甲状腺低分化癌や未分化癌などの予後不良な癌の発生には,前述のBRAF変異やRAS変異などに加えて,p53変異,CTNNBI変異,TERT変異などが報告されている。
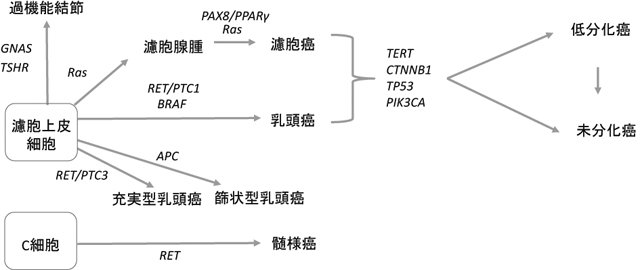
甲状腺腫瘍の遺伝子異常(文献[5]を改変)

甲状腺腫瘍の遺伝子分類
甲状腺腫瘍を遺伝子変異から再分類すると図5のようになる。以下にそれぞれの組織型と遺伝子変異について記していくことにする。

遺伝子異常からの甲状腺腫瘍分類
通常型乳頭癌ではBRAF変異が圧倒的に重要である。BRAF変異は甲状腺以外の臓器から発生する腫瘍でも報告されている。中でも悪性黒色腫で多くの研究がなされてきた。甲状腺腫瘍では乳頭癌のみで認められる遺伝子変異で,その陽性頻度は50%から90%である。BRAF変異の90%以上はcodon 600のV(バリン)がE(グルタミン酸)に変わる点突然変異(V600E)である。この変異によってMAPK経路が活性化され,異常な細胞増殖が惹起される。このBRAF変異の頻度は若年者よりも高齢者で高く,また高細胞亜型など臨床的悪性度が高いものでその頻度が高いことが報告されてきた。面白いことにBRAF変異の頻度を年代別に検索すると,同じ施設においても近年になるに従い増加しているのがわかる。その理由は実際のところよくわかっていない。
RET遺伝子は受容体型のチロシンキナーゼをコードし,MAPK経路ではBRAFの上流に位置している。RET変異には突然変異と再構成の2種類があるが,突然変異は家族性甲状腺髄様癌で知られ,一方,再構成は乳頭癌の遺伝子変異として報告されてきた。RET再構成(RET/PTC)はRET遺伝子の断片が他の遺伝子に転座するもので,パートナー遺伝子の種類により15種以上が報告されている。中でもH4遺伝子に転座するRET/PTC1とELE1遺伝子に転座するRET/PTC3が重要である。乳頭癌におけるRET再構成の頻度は20から40%とされている。不思議なことに,乳頭癌におけるこの遺伝子異常の頻度は年代とともに減少している[6]。しかしながら,この遺伝子の異常は乳頭癌特異的で,鑑別診断に有用な遺伝子異常であることには変わりがない。面白いことに,RET再構成は低分化癌や未分化癌ではほとんど検出できないので,RET再構成を持つ乳頭癌は低分化癌や未分化癌にトランスフォームしないと思われる。
2)濾胞型乳頭癌濾胞型乳頭癌は乳頭状構造を持たない乳頭癌で,被膜を持たない浸潤型と被膜に囲まれた非浸潤型に分けることができる。本腫瘍の浸潤型は細胞像,臨床像が通常の乳頭癌と同様であるが,被包性(被浸潤性)濾胞型乳頭癌ではしばしば診断が問題となる。濾胞型乳頭癌では,前述のBRAF変異の他にRAS変異が報告されている。これは濾胞型乳頭癌と診断される腫瘍の一部が濾胞性腫瘍の遺伝子異常を有していることを示唆している。さらに,被包性濾胞型乳頭癌やNIFTPなどもRAS遺伝子変異が高率に認められる。
3)充実型乳頭癌本腫瘍は主として若年者に発生する腫瘍で,通常型に比較してやや増殖が速いが,予後的にはあまり変わりない。本腫瘍の存在はチェルノブイリ原発事故後の調査で注目された。遺伝子異常としてはRET遺伝子断片がELE1遺伝子に転座するRET/PTC3の頻度が高いことが報告されており,この点で通常型乳頭癌とは明らかに区別できる。実際,われわれの研究においてもRET/PTC3が高率に検出され,RET/PTC3は本腫瘍の特徴であるとみなされた。一方,BRAF変異やRAS変異は本亜型からは検出されていない。
4)篩状型乳頭癌本腫瘍は家族性大腸ポリポージスに伴って出現する甲状腺腫瘍として報告されたが,その後,散発性(非家族性)例の発生も報告された。本腫瘍の特徴はやや若年者(20~30歳)に発生し,通常型と異なり転移することは稀である。また,ほとんど例外なく女性に発生する。本腫瘍の遺伝子異常はAPC遺伝子の突然変異で,この遺伝子の異常によりβ-Cateninが細胞質に貯留し,それが核内に移行して腫瘍が発生するといわれている。甲状腺腫瘍の中でAPC遺伝子の異常が報告されているのは本腫瘍のみである。
5)濾胞腺腫,濾胞癌濾胞腺腫,濾胞癌ではBRAF変異はなく,最も重要な遺伝子異常はRAS変異(点突然変異)である。RAS遺伝子にはHRAS,KRAS,NRASがあり,突然変異のホットスポットはCodon12,13とCodon61である。消化器や呼吸器の癌ではKRAS変異が重要であるが,甲状腺ではNRAS変異(Codon61)の頻度が高い。濾胞性腫瘍におけるRAS変異の頻度は,10~60%と報告により大きな差がみられるが,総じて良性の濾胞腺腫に比較して濾胞癌の方が高率である。これらのことから,NRAS変異は頻度が低いものの乳頭癌と濾胞癌の鑑別には有用であると思われるが,濾胞腺腫か濾胞癌かの良悪性鑑別診断にはあまり有用とはいえない。RAS変異以外の遺伝子変異としてPPARγ/PAX8がある。PPARγ(Peroxisome Proliferator-Activated Receptor γ)は主に脂肪細胞に発現され,甲状腺での発現は通常はみられない。しかしながら,染色体転座により,甲状腺転写因子の一つであるPAX8の5ʼ端側とPPARγ遺伝子の3ʼ側が結合した融合蛋白が生じることが知られている。当初,PPARγ/PAX8は濾胞癌の遺伝子マーカーと考えられたが,近年は濾胞腺腫や被包性濾胞型乳頭癌でも報告されている。濾胞癌におけるPPARγ/PAX8の頻度は,欧米からの報告では約40%とされてきた。しかしながら,日本人の濾胞癌を対象としたわれわれの検討では,PPARγ/PAX8の陽性率は極めて低値(3%)であった。この違いが何によるものかは現在も不明であるが,日本の濾胞癌の遺伝子変異マーカーとするには頻度が低すぎるようだ。また,PPARγ/PAX8は低分化癌や未分化癌ではほとんど検出されない。
甲状腺腫瘍を遺伝子異常から分類するとBRAF腫瘍,RET/PTC腫瘍の系とRAS腫瘍,PPARγ/PAX8腫瘍の2系統に大別できる。このような遺伝子変異からの分類に,従来の組織型を加味すると図4のようになる。BRAF腫瘍の高分化型は乳頭癌のみであり,またこの変異は低分化癌や未分化癌でも認められる。一方,RET/PTC腫瘍には高分化な乳頭癌のみで,低分化癌や未分化癌で検出されることはほとんどない。RAS腫瘍は大部分が濾胞腺腫や濾胞癌が入り,さらに濾胞型乳頭癌やNIFTPなどでも認められる。低分化癌や未分化癌でもRAS変異を示すことがある。PPARγ/PAX8腫瘍には濾胞腺腫,濾胞癌のみで,乳頭癌でみられることはなく,低分化癌や未分化癌でも極めて稀である。
幸いなことに,アルコール固定は,フォルマリン固定よりも核酸の保存が良好であるので,細胞検体は遺伝子検査に向いている。また,採取された検体では,目的とする腫瘍細胞以外の細胞も同時に採取されるが,現在は遺伝子検査の感度がかなり高くなっている。ちなみに,現在用いられているAllele Specific PCR法では,1,000個中1個の腫瘍細胞があれば検出可能だとされている。
細胞診材料での遺伝子検査の過程を図に示したが,従来の形態細胞診で,良性,悪性と診断されたものは良いが,鑑別困難の部分については,遺伝子検査が有用になる。すなわち,細胞診で鑑別困難と診断されたもので,遺伝子異常が証明されれば腫瘍として扱い,遺伝子異常の種類によって乳頭癌,濾胞性腫瘍と診断されることになる(図6)。

細胞診の形態診断に分子診断を併用
遺伝子検査はコストの面がクリアーすることができれば,診断面では有用な情報を得ることができる。さらに,低分化癌や未分化癌の治療は遺伝子情報に加えて種々の分子情報を得る必要がある(図7)。とくに現在は幾つもの分子標的治療薬が開発されているが,この選択には標的分子の発現評価が必要になる。

分子病理診断