2017 年 66 巻 3 号 p. 242-247
2017 年 66 巻 3 号 p. 242-247
Affinity column mediated immune assay(ACMIA)法を原理とするフレックスカートリッジタクロリムスTACR試薬は,低濃度域の再現性が問題視されていた。今回,我々は,低濃度域の精密性が改良されたフレックスカートリッジタクロリムスTAC試薬と従来法について性能を比較検討した。同時再現性および日差再現性は,それぞれ変動係数(CV)3.1~6.2%および2.8~5.7%であり,実効感度はTAC 1.1 ng/mL,TACR 2.6 ng/mLと低濃度域における再現性が大幅に改善された。希釈直線性においては,28.2 ng/mLまで原点を通る良好な直線性を示した。従来法との相関は回帰式y = 1.06x − 0.1,n = 79,相関係数r = 0.959,p < 0.0001と良好な結果が得られた。今回注視すべき点は,EDTA全血を対象としているがEDTAによる影響が添付文書に追加されたことである。この影響は,採血量が1/2量に相当する3.0 mg/mLで42.3%減少し,濃度依存的に影響が観察された。本試薬は,低濃度域における精確性の向上により,近年,低濃度域におけるtacrolimus濃度のモニタリングにも対応し,日常検査においてさらに有用な試薬であると考えられた。しかし,EDTA濃度に影響を受けることから,規定量の採血量を厳守することは重要となる。
Tacrolimusは,1984年に放線菌Streptomyces tsukubaensisの代謝産物として本邦で発見された免疫抑制剤である1),2)。T細胞内の蛋白(KF506 binding protein)と形成された複合体が,カルシニューリンと結合してnuclear factor of activated T cells(NFAT)の脱リン酸化を抑制する。その結果,NFATの核内移行が阻害されてインターロイキン2(IL-2)などのサイトカインの産生を抑制し,免疫抑制効果を発揮する3)。1993年に肝移植の拒絶反応抑制剤として保険適応が認められ,2000年以降では重症筋無力症,関節リウマチ,ループス腎炎などの自己免疫性疾患に対して保険適応が拡大された。カルシニューリン阻害による免疫抑制作用を共有するciclosporinと比較して,免疫抑制作用は約100倍と強力である。吸収性に関しては,胆汁や粘膜障害の影響を受けることが無く,経口投与でも血中濃度が安定しやすいという利点がある4)。他方,有効治療域は狭く,過剰な免疫抑制による易感染,腎障害,高カリウム血症,末梢神経障害,中枢毒性などの重篤な副作用があり,厳密な血中濃度モニタリングの実施が推奨されている5)。
一般的に,血中トラフ値は5.0~20.0 ng/mLが推奨されているが,臓器移植後の維持期においては5.0 ng/mL程度に設定する場合が多い。さらに,mammalian target of rapamycin(mTOR)阻害剤であるEverolimusとの併用療法により,tacrolimusによる腎機能障害の予防を目的として目標トラフ濃度を5.0 ng/mL以下に設定するレジメンが散見されており6),低濃度域の精確さが要求されている。
Tacrolimusは血液中で大部分が赤血球中に移行することから,従来法では除蛋白の前処理が必要であった。他方,affinity column mediated immune assay(ACMIA)法を原理とするフレックスカートリッジタクロリムスTACR試薬(SIEMENS)は,前処理不要の全自動型測定法として開発された。しかし,CV値20%と設定された実効感度において,CLIA法の0.5 ng/mLに比べACMIA法では2.0 ng/mLであり,低濃度域の再現性が問題視されていた7)。
フレックスカートリッジタクロリムス(TAC)試薬は,フレックスカートリッジタクロリムス(TACR)試薬に比し,1)抗体の変更により特異性の向上,2)前処理試薬の変更により抽出効率の向上,3)磁性粒子試薬の変更により溶解後の安定性の向上について改良された。今回,我々は低濃度域における精密性についてTACR試薬と比較検討した。さらに,EDTA自体の影響が添付文書に追加記載されたことより,TAC試薬におけるEDTAの影響について解析した。
北里大学病院でtacrolimus検査を実施した患者の残検体を用いて,解析を行なった。なお,本研究で取り扱う試料に関しては,患者の個人情報が特定されないよう全ての検体に関して連結不可能匿名化して使用した。
2. 測定機器および試薬測定試薬はフレックスカートリッジタクロリムスTAC試薬(SIEMENS)を,測定装置は臨床化学自動分析装置Dimension RxL Max(SIEMENS)を使用した。また,対照試薬としてフレックスカートリッジタクロリムスTACR試薬(SIEMENS)を用いた。
3. 測定原理EDTA加全血と検体とし,構成試薬である前処理液で溶血され,溶血検体中のタクロリムスはβ-ガラクトシダーゼ標識抗タクロリムスマウスモノクローナル抗体(Ab-β-gal)と反応させる。未反応のAb-β-galは,タクロリムス結合二酸化クロム磁性粒子と結合し,磁性分離により除去される。別キュベットへ分取されたタクロリムス結合βガラクトシダーゼはクロロフェノールレッド-β-d-ガラクトピラノシド(CRPG)と反応し,加水分解により577 nmで吸収される色素クロロフェノールレッド(CPR)を生成する。この時の吸光度を測定し,試料中のタクロリムス濃度を算出する。
4. 検討内容改良試薬の性能評価として,同時再現性,日差再現性,希釈直線性,実効感度,共存物質の影響,従来試薬との相関性,ヘマトクリット(Ht)およびEDTAの影響などに関して,検討を行なった。
5. 一定のTacrolimus濃度におけるHt系列の作製Tacrolimus濃度27.3 ng/mLのB型全血検体を遠心(3,000 rpm, 5 min)後,Tacrolimusが投与されていないB型全血検体の血漿および血球をtacrolimus濃度が一定(Ht値10~60%)になるよう調整した。各試料において,Ht値は多項目自動血球分析装置XN-2000(Sysmex)により,tacrolimus濃度はTAC試薬を用いて3重測定した。
6. 一定のTacrolimus濃度におけるEDTA-2Na系列の作製Tacrolimus濃度10.0 ng/mLのプール全血とEDTA-2Na(SIGMA)を精製水で溶解した溶液を,EDTA終濃度が1.5,3.0,4.5,6.0,7.5,9.0 mg/mLになるように調整した。各試料において,tacrolimus濃度はTAC試薬およびTACR試薬を用いて3重測定した。
7. 統計学的解析統計学的解析はone-way ANOVAにて実施した。なお,有意差が認められた場合は,Scheffe法を適応しp < 0.05を有意とした。
同時再現性はRap/Tac/CsA Control(MORE DIAGNOSTICS, INC)のLevel 1,2,3を用い,TAC試薬とTACR試薬について連続20回測定を行なった。変動係数(coefficient variation; CV)は,それぞれTAC 3.1~6.2%,TACR 2.9~11.1%を示した。また,日差再現性はRap/Tac/CsA ControlのLevel 1,2,3を用い,TACR試薬とTAC試薬について連続5日間測定した。CVは,それぞれTAC 3.2~5.7%,TACR 4.0~10.2%であった(Table 1)。
| TAC | TACR | |||||||
|---|---|---|---|---|---|---|---|---|
| Mean (ng/mL) |
Within-run CV (%) |
Mean (ng/mL) |
Between-day CV (%) |
Mean (ng/mL) |
Within-run CV (%) |
Mean (ng/mL) |
Between-day CV (%) |
|
| MoreQC1 | 3.4 | 6.2 | 3.8 | 5.7 | 3.4 | 11.1 | 3.2 | 10.2 |
| MoreQC2 | 10.7 | 4.2 | 10.4 | 2.8 | 10.4 | 4.3 | 9.9 | 5.6 |
| MoreQC3 | 17.4 | 3.1 | 16.8 | 3.2 | 17.3 | 2.9 | 17.0 | 4.0 |
2濃度(高濃度,低濃度)の患者全血検体を0 ng/mLのキャリブレータを用いて10段階希釈し測定した結果,いずれも原点を通る良好な直線性を示した(Figure 1)。
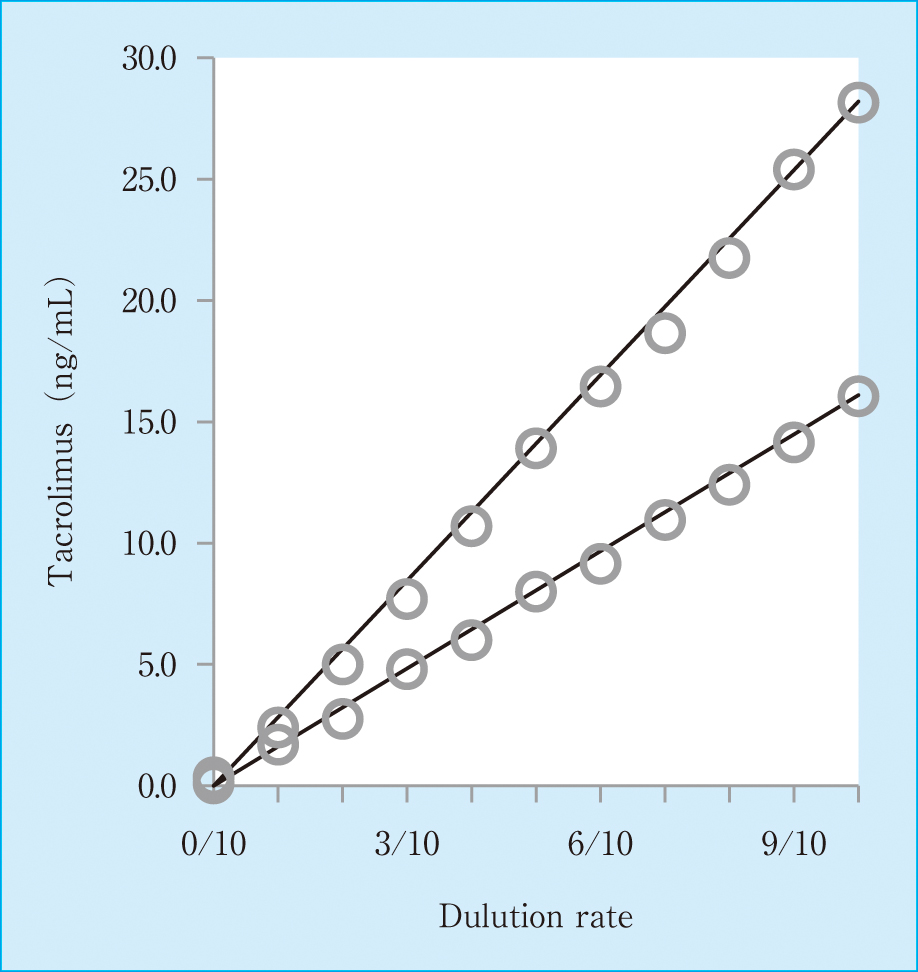
Dilution linearity
10検体の低濃度試料を10回測定し,得られたprecision profileから再現性がCV(%)=20におけるtacrolimus濃度を実効感度とした結果,TACR試薬の2.6 ng/mLと比べTAC試薬では1.1 ng/mLを示した(Figure 2)。
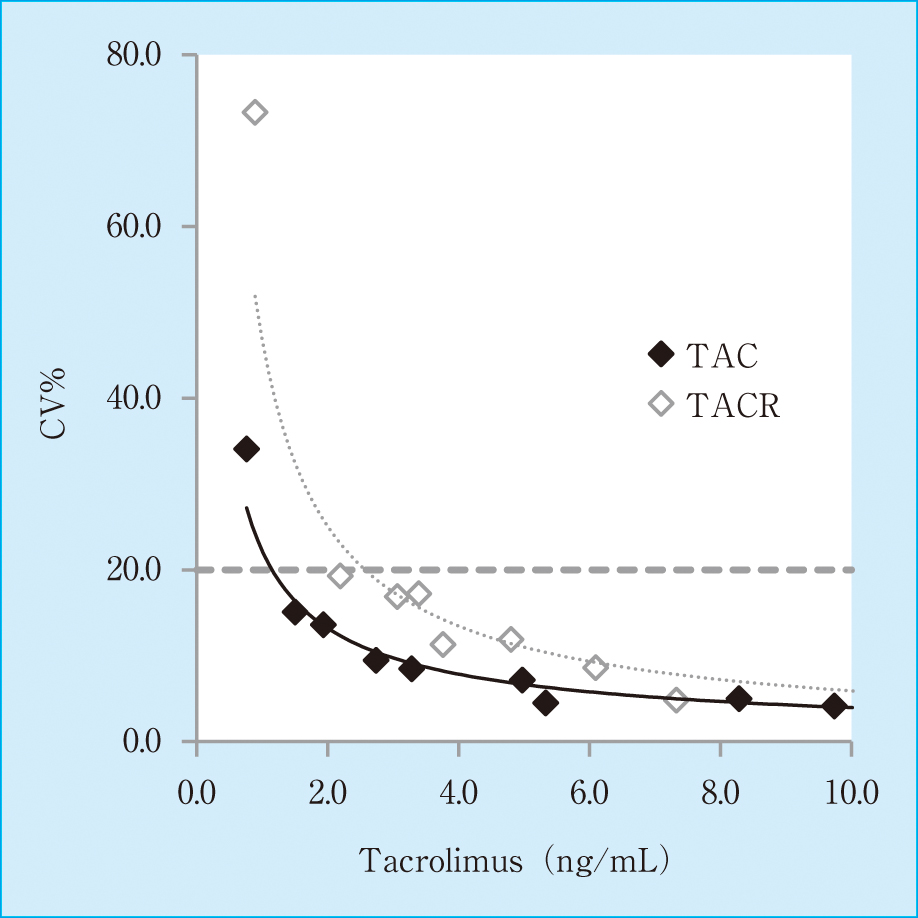
The limit of quantitation with between TAC and TACR assay
プール全血と干渉チェック・Aプラス(Sysmex)および干渉チェック・RFプラス(Sysmex)を用いて共存物質の影響を検討した。ビリルビンC は20.9 mg/dL,ビリルビンFは19.5 mg/dL,RFは500 IU/mLまでの条件において,影響は認められなかった。乳びに関しては,1,160ホルマジン濁度において11%の低下を示した。なお,測定値が共存物質の0濃度±10%を有意とした(Figure 3)。
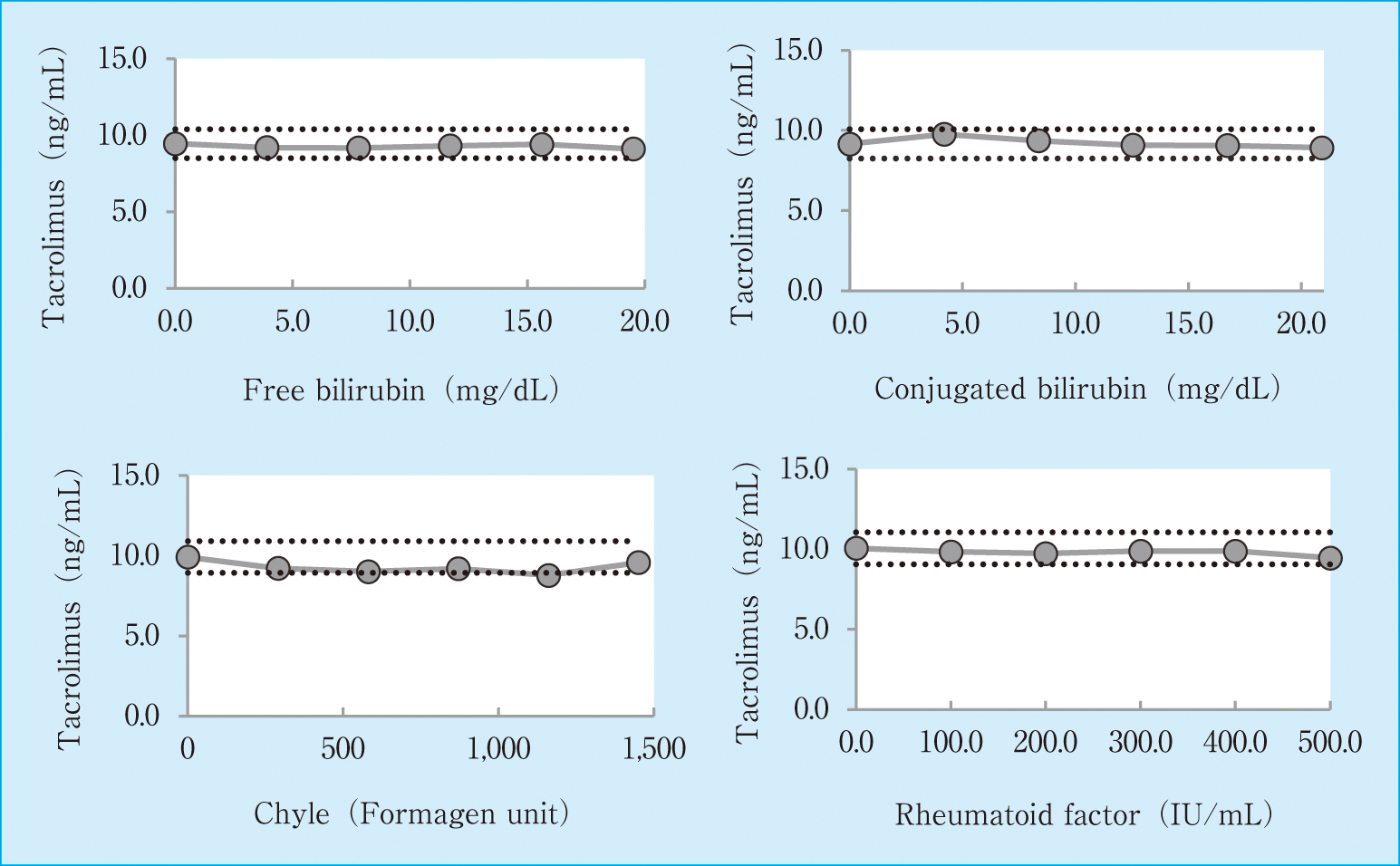
Effect of interfering substances on the measurement of TAC
Ht値に関しては,8.8~54.7%までtacrolimus濃度に有意な差は認められなかった(Figure 4)。

Influence of Ht on the measurement of tacrolimus in whole blood
One-way ANOVA, Scheffe-test *p < 0.05, **p < 0.01
当院でタクロリムス検査用として使用するベノジェクトII真空採血管(Terumo, 5 mL)は,EDTA-2Naが1.5 mg/mL含有されている。採血量が1/2量となるEDTA-2Na 3.0 mg/dL含有採血管におけるtacrolimus濃度に関しては,TAC試薬では42.3%の顕著な低下を示しEDTA-2Na濃度依存性に低下傾向を呈した。他方,TACR試薬においては,同様な傾向を示したが,EDTA-2Na濃度9.0 mg/dLにおいては14.5%の低下を認めた(Figure 5)。

Influence of EDTA on the measurement of tacrolimus in whole blood
One-way ANOVA, Scheffe-test *p < 0.05, **p < 0.01
患者全血検体79例を対象として,TAC試薬とTACR試薬との相関性についてPassing-Bablok法を用いて解析した。評価試薬(Y軸)および対照試薬(X軸)の相関性に関しては,回帰式y = 1.06x − 0.1,相関係数r = 0.959,p < 0.0001を示した(Figure 6)。

The correlations between the Dimension TAC assay and the Dimension TACR assay
今回,我々はTACR試薬の改良試薬であるTAC試薬について,低濃度域における精密性に関してTACR試薬との比較,ならびに共存物質,Ht値およびEDTA濃度の影響について検討した。
同時および日差再現性に関しては,TAC試薬はTACR試薬に比べ中~高濃度域では大きな差異は認められなかったが,低濃度域における再現性が大幅に改善された。実効感度については,TAC試薬は1.1 ng/mLでありTACR試薬の2.6 ng/mLに比べ高感度を示した。近年,外来治療および周術期患者において,副作用の予防目的とした低濃度域での血中濃度管理の重要性が高まっており7),本試薬の有用性は非常に高いと考えられた。
希釈直線性においては,28.2 ng/mLまで原点を通る良好な直線性を示した。なお,TAC試薬では初検値が20.0 ng/mL以上を示した場合は,非特異反応の自動チェックとしてディスプレーサを含まない前処理液を使用することで,自動再検によりデータの乖離がないことを確認する機能が追加になった。よって,本機能によりtacrolimusの偽高値を検出し易くなった。
共存物質に関しては,ビリルビンC,ビリルビンF,RFなどの影響はみられなかったが,乳びでは若干の負誤差が認められた。トリオレイン,レシチン,遊離脂肪酸,ウシアルブミンなどが反応系を阻害していることが推測できるが,機序は不明である。TACR試薬では,乳びの影響については報告されておらず,今回の変更成分の何らかが影響していると考えられた。
Ht値の影響に関しては,Ht値が10%低下した場合はmicroparticle enzyme immunoassay(MEIA)法ではtacrolimus濃度が約1.0 ng/mL高値を示すことが報告8)されている。しかし,TAC試薬はTACR試薬9)と同様に,Ht値はtacrolimus濃度に影響しないことが明らかとなった。
今回,EDTA濃度が3.0 mg/mL以上を示した場合はtacrolimusの血中濃度に影響することが添付文書に追加記載されたことより,EDTA濃度の影響について検討を行なった。EDTA-2Na 3.0 mg/dLの添加採血管では,規定採血量である1.5 mg/mL EDTA-2Na添加採血管に比べTACR試薬は4%の低下であったが,TAC試薬は40%以上の低下を認めた。このことからTACで変更された成分による影響が考えられた。成分の詳細は不明であるが,何れにせよ規定採血量を下回った場合は偽低値を示し,tacrolimusの投与量に影響を及ぼす危険性が生じる。したがって,検査者は本特性を十分理解して規定量の採取に細心の注意を払うことが必要である。
CLIA法,ECLIA法,EMIT法などの前処理が必要な試薬に関しては,測定者の熟練度により測定結果にバラツキが生じる可能性が大きい。他方,ACMIA法を測定原理とするTAC試薬では,前処理が自動的に行なわれるため測定者の熟練度に影響されず,測定時間も15分であり結果の迅速報告に貢献できる。さらに,低濃度域における再現性も向上を示している。
以上より,TAC試薬はtacrolimusの血中濃度モニタリングにおいて,臨床的有用性が非常に高いと考えられた。
TAC試薬は,低濃度域における精確性の向上により,近年の低濃度域におけるtacrolimus濃度の管理にも十分対応が可能である。なお,EDTA濃度に影響を受けることから,規定採血量を厳守することが重要である。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。