2021 年 70 巻 4 号 p. 778-784
2021 年 70 巻 4 号 p. 778-784
前立腺小細胞癌は形態学的および免疫組織学的に特徴的な所見を有する神経内分泌腫瘍である。症例は76歳男性で,前立腺がん診断時にはPSA値が高値を示したが,ホルモン療法後正常値となった。前立腺がん診断から約1年後に尿沈渣中に異型細胞を認めた。尿沈渣で検出した異型細胞は,N/C比大でクロマチンは増量しているが核異型をほとんど認めず鋳型状の細胞結合性を認める細胞であった。異型細胞は,Synaptophysin陽性で前立腺小細胞癌と診断された。前立腺小細胞癌は稀な症例であり特徴的な細胞学的所見を認識することが重要である。
Prostatic small cell carcinoma is a high-grade neuroendocrine tumor with characteristic morphological and immunohistochemical features. A 76-year-old male presenting with high serum PSA (prostate specific antigen) levels was diagnosed as having conventional prostatic adenocarcinoma. Normalization of serum PSA levels was achieved by hormonal therapy. However, atypical cells with hyperchromatic nuclei, inconspicuous nucleoli, scant cytoplasm and nuclear molding were detected in urinary sediment by conventional urinalysis about a year later. Atypical cells were positive for synaptophysin, which was indicative of prostatic small cell carcinoma. Small cell carcinoma of the prostate is rare and has a poor prognosis, so it is important to recognize its cytological characteristics.
尿沈渣中に出現する悪性細胞の組織型は,大部分は尿路上皮癌であり,小細胞癌は稀である。今回我々は尿沈渣中に小細胞癌を疑う異型細胞を認め,その後前立腺原発小細胞癌と裏付けることができた症例を経験した。尿沈渣中に認められた小細胞癌の細胞学的特徴を検討したので報告する。
患者:76歳 男性。
主訴:発熱。
既往歴:高血圧,慢性肝炎,逆流性食道炎,白内障
現病歴:尿沈渣で異型細胞を検出する約1年前に前立腺特異抗原(以下,PSA)34.0 ng/mLと異常高値を認め当院泌尿器科へ紹介受診.前立腺生検を施行し前立腺癌の診断(病理診断結果:GS3+4,adenocarcinoma + carcinoma with neuroendocrine)が得られホルモン治療と化学療法を施行中(以降PSA正常化)。今回近医泌尿器科を受診し,発熱とCT検査にて前立腺腫瘤の増大傾向を認め,血液検査にてPSA 0.1 ng/mLと正常範囲内であったが神経特異エノラーゼ(以下,NSE)20.5 ng/mLと異常高値を認めたため前立腺小細胞癌増悪の疑いで当院泌尿器科へ緊急入院となった。
検査所見:血液および尿検査の結果をTable 1に示す。LDH 235 U/Lの軽度上昇とCRP 4.66 mg/dLの炎症反応を認めた。尿沈渣中には多数の白血球を背景に,リンパ球大でN/C比の非常に大きな類円形核を有した小型細胞を孤立散在性あるいは小集塊状に認めたことから異型細胞(小細胞癌疑い)と報告した。この際,患者カルテから前立腺癌の既往があることを確認した。また同日提出された尿細胞診でも,小細胞癌疑いの結果が得られた。尿沈渣の免疫細胞化学染色結果と前立腺組織生検時に実施された病理診断結果と同様の染色態度が得られたことと画像検査にて精嚢腺への浸潤を認めていることから,前立腺小細胞癌細胞が精嚢腺から尿道経由で尿中へ出現したと考えられた。
| 生化学検査 | 腫瘍マーカー | ||||
|---|---|---|---|---|---|
| CRP | 4.66 | 0–0.14 mg/dL | PSA | 0.1 | 0–4.0 ng/mL |
| TP | 6.8 | 6.6–8.1 g/dL | NSE | 20.5 | 0–16.3 ng/mL |
| ALB | 3.2 | 4.1–5.1 g/dL | ProGRP | 32.6 | 0–80.9 pg/mL |
| AST | 14 | 13–30 U/L | |||
| ALT | 12 | 10–30 U/L | |||
| LD | 235 | 124–222 U/L | |||
| CRE | 0.65 | 0.65–1.07 mg/dL | |||
| UN | 14.1 | 8–20 mg/dL | |||
| T-BIL | 0.2 | 0.4–1.2 mg/dL | |||
| Na | 142 | 138–145 mmol/L | |||
| K | 4.6 | 3.6–4.8 mmol/L | |||
| Cl | 102 | 101–108 mmol/L | |||
| 尿定性検査 | 尿沈渣検査 | ||||
| 蛋白 | (1+) | (−) | 赤血球 | 5–9 | 1未満/HPF |
| 糖 | (−) | (−) | 白血球 | 50–99 | 1未満/HPF |
| 潜血 | (1+) | (−) | 扁平上皮細胞 | 1未満 | 1未満/HPF |
| 白血球反応 | (2+) | (−) | 尿路上皮細胞 | 1未満 | 1未満/HPF |
| 亜硝酸塩 | (+) | (−) | 尿細管上皮細胞 | 1未満 | 1未満/HPF |
| 細菌 | 2+ | (−) | |||
| 細胞質内封入体細胞 | + | (−) | |||
| 異型細胞 | + 小細胞癌疑い | ||||
泌尿器外来受診時に異型細胞(小細胞癌疑い)として報告した細胞は,多数の白血球(好中球)を背景に,白血球と同等~やや大きな細胞でN/C比が非常に大きく孤立散在性のものや2,3個の細胞が結合性を有しているもの,またシート状に配列して10数個の細胞が小集塊状に散在してみられた(Figure 1, 2)。個々の細胞は尿路上皮癌に見られるような核形不整や細胞質の脆弱性および脂肪顆粒の出現(Figure 3)はなく,クロマチンは尿路上皮癌が濃染顆粒状に対し本例では微細顆粒状~細網状であった。無染色での色調は灰白色調であり細胞質辺縁はスムーズでN/C比の非常に大きな細胞として存在した(Figure 4)。小集塊状に出現していた細胞は,白血球と比べ同等からやや大きな細胞で核形不整は認められず,細胞質に関してもほとんど確認できなかった。同時に施行したMay-Giemsa染色から鋳型状の細胞結合性の所見が確認されたため悪性リンパ腫を否定し細胞鑑別において非常に有用となった(Figure 5)。また本例では異型細胞検出時尿路感染症を併発し,多数の白血球と共に小型異型細胞は出現したが,前述の所見を総合的に踏まえ的確にとらえることができた(Figure 2)。



別症例

小細胞癌ではN/C比大(緊満感)が顕著であり,白血球(生細胞)にはコブ状の突起を有することが多い。
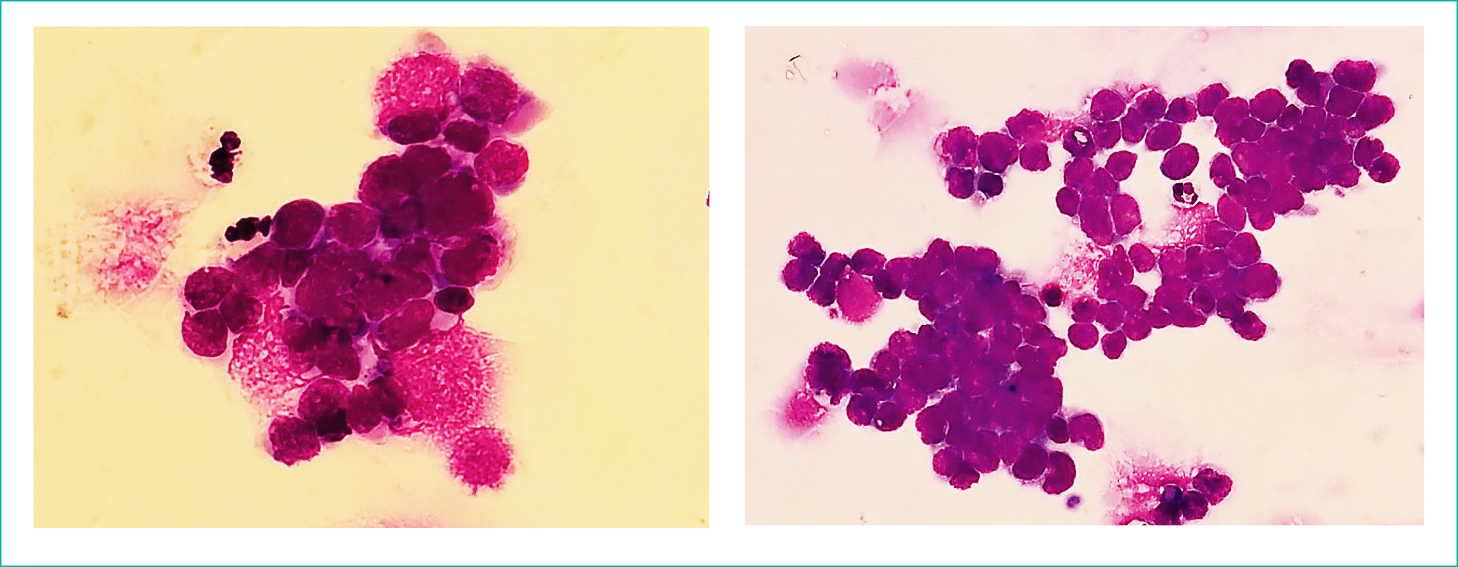
N/C比大の異型細胞が結合性を有し木目込状の配列または集塊状に散見。
N/C比とクロマチンの増量したリンパ球大の小型の異型細胞が結合性を有し,木目込状の配列,または集塊状に散見し小細胞癌を疑う細胞所見が得られた(Figure 6)。

白血球を背景にN/C比およびクロマチンの増量した 白血球大の異型細胞が結合性を有し木目込状の配列または集塊状に散見。
尿沈渣を10% 中性緩衝ホルマリンで固定後,パラフィン浸透させセルブロック標本を作製し,免疫細胞化学染色を行った。結果は,Synaptophysin陽性,ChromograninA陰性,AE1/AE3陰性(Figure 7)であり,いずれの染色結果も初診時の前立腺組織の免疫組織化学染色所見と一致しており,細胞形態も同様であることから前立腺由来の小細胞癌と診断された。

尿沈渣異型細胞検出時の所見で,3検査ともに前立腺癌の診断。MRI画像検査にて右精嚢への浸潤,CT画像検査にて両側腸骨動脈周囲リンパ節転移を認めるも骨転移を疑う骨硬化性変化は認めなかった(Figure 8, 9)。膀胱鏡ならびに画像検査にて明らかな膀胱浸潤を認めないものの,MRI画像検査で精嚢腺への浸潤があることから尿路との交通より尿沈渣中に異型細胞が出現したと考えられた。

矢印が腫瘍部位

尿沈渣で異型細胞を検出する約1年前にPSA 34.0 ng/mLと異常高値を認め他院より紹介受診。3週間後に施行した経直腸的前立腺針生検で前立腺癌の診断(GS3+4,adenocarcinoma + carcinoma with neuroendocrine)。MRI検査では前立腺に複数の結節性病変を認め,一部は被膜外に突出し右精嚢浸潤と尖部右側で直腸浸潤疑いとなりホルモン治療開始(リューブリン・ビカルタミド)し以降PSAは低下(正常化)した。5か月後に直腸診にてHardmass触知,肛門鏡にて腫瘤を確認,血清腫瘍マーカー検査にてPSA 0.1 ng/mLであったがNSE 79.9 ng/mLと異常高値を認め前立腺癌の増悪と診断され小細胞癌に対する化学療法の方針となった.(CBDCA・VP-16 4コース)以降血清腫瘍マーカーの上昇なし。4か月後にCT検査で病変の縮小を確認するも,約1か月後に尿閉を認め自己導尿となった.この頃他院にて発熱を認め当院紹介受診し急性前立腺炎,前立腺小細胞癌増悪の疑いで緊急入院となり尿沈渣検査にて異型細胞を認めた。遠隔臓器や骨に転移巣を認めないものの精嚢,直腸,リンパ節に転移が認められたため,化学療法の継続と放射線治療を開始し緊急入院から約3か月で自宅退院となった。現在も通院中である。
小細胞癌細胞と鑑別が最も必要な細胞として白血球を考え,好中球とは偽足状の突起(生細胞)の有無や核の形状とN/C比,リンパ球とは細胞径と結合性の有無,Sternheimer染色後のクロマチンの濃染性で鑑別を行った(Figure 4)。また尿沈渣に3%酢酸を滴下し白血球の核を明瞭化して無染色標本で異型細胞との鑑別を行った。さらに尿中に出現するN/C比の大きな細胞の鑑別に尿路上皮癌(上皮内癌:CIS)や悪性リンパ腫を考え,尿路上皮癌とはクロマチン顆粒の大きさ(細顆粒状:小細胞癌細胞,粗顆粒状:尿路上皮癌)や核形不整の強弱,細胞質の有無,悪性リンパ腫とは細胞結合性の有無を指標として鑑別を行った。前立腺癌は2015年には男性がんの罹患数が第1位となり近年重要視されている癌の1つである1)。前立腺癌の組織型の多くは腺癌であり,小細胞癌は前立腺悪性腫瘍の1%以下で稀と報告されている2)。また小細胞癌の予後はきわめて不良である3)。本例では遠隔臓器や骨に転移巣を認めないものの精嚢,直腸,リンパ節に転移が認められている。また他組織型との併存が多く,特に腺癌との合併は約半数の症例でみられるとされ,初発時点から小細胞癌と腺癌の同時発生と考えられるものと,腺癌が先行して存在しその治療中に小細胞癌が異時発生したと思われる場合の二種に分類されている4)。本例では,前立腺癌診断時すでに腺癌に小細胞癌を併存しており,同時発生か腺癌が先行しその後小細胞癌が新たに発生したものかは不明であるが,臨床経過より腺癌治療中に小細胞癌の病勢悪化が強くなったと考えられる。また本例のように尿路との交通を認める浸潤や転移を伴う症例では,尿沈渣や尿細胞診などの尿中の細胞学的検索が診断に有用な場合が多い。前立腺癌の血清腫瘍マーカーとしてPSAがよく用いられるが,PSAが高値になる程前立腺癌の検出率は上昇し進行癌の確率も上昇するとされる。また前立腺癌ではPSAの変動が有用とされるが,本例のように組織型が小細胞癌で病勢が強くなった場合には,むしろPSAは陰性化し有用性は低くなると考えられる。つまりPSAは前立腺癌の有用なマーカーであるが,組織型によっては上昇しないことを認識しておく必要性がある5)。代わりに小細胞癌の腫瘍マーカーであるNSEやProGRP(ガストリン放出ペプチド前駆体)が有用であり腫瘍の大きさや病勢を反映するとされ,本例ではNSEの上昇は臨床経過とよく相関したがProGRPは経過中陰性であった(Figure 10)6)。

尿沈渣中に小細胞癌が出現することは予後不良を意味するが,異型細胞の早期検出によってより早く病態を確認できれば化学療法による予後改善が期待できる。検体数の多い尿沈渣検査から短時間の鏡検で異型細胞を検出し組織型までを推定することは難しい作業であるが,日頃から各細胞の無染色およびSternheimer染色の色調や形態学的特徴を十分に理解し鏡検にあたることが重要であり,臨床に有用な情報を提供することに繋がると考える。
本論文の要旨は第70回日本医学検査学会(2021年5月,福岡市)で発表した。
本症例は,当院倫理委員会の承認を得て報告を行った。
倫理委員会承認審査番号:臨研241号
承認日:2020年10月26日
本論文に関連し,開示すべきCOI 状態にある企業等はありません。