〈目的〉「ゲノム診療用病理組織検体取扱い規程」において推奨されているホルマリン固定時間を超過した検体は,核酸品質の低下が懸念されている。今回,臨床現場で固定時間が超過する検体を想定し,良好な核酸品質保持のための固定条件を検討した。また,病理組織診断に与える影響についても検討した。〈方法〉未固定の肺,甲状腺,卵巣を用い,「1,3,7日間室温固定」「3,7日間冷蔵固定」「1日間室温固定後にALへ置換し2,6日間保存」「1日間室温固定後にALへ完全置換し2,6日間保存」「1日間室温固定後に2,6日間冷蔵保存」の11の条件で固定を行った。ΔCT値による核酸断片化の評価およびHE染色,IHCの染色性を評価した。〈結果〉「3,7日間室温固定」検体では,推奨QC値を下回る検体が認められたが,それ以外の条件においては,「1日間室温固定」と同等のQC値であった。最もQC値が高い固定条件は,「3日間冷蔵固定」であった。HE染色およびIHCともに,すべての固定条件において,染色結果に問題はなかった。〈考察〉金曜日や長期休暇前に提出された生検検体は,冷蔵固定もしくは一晩室温固定後のAL置換により,良好な核酸品質が保持できることが示された。臨床現場での業務効率を考慮すると,検体提出直後から冷蔵固定することが,最善の固定条件であると考えられる。
For specimens that exceed the formalin fixation time recommended in the “Regulations for Handling Pathological Tissue Specimens for Genome Medical Treatment”, deterioration of nucleic acid quality is a concern. We examined the fixation conditions for maintaining good nucleic acid quality. We also examined the effect of the fixation conditions on histopathological diagnosis. We used sections of the unfixed lung, thyroid gland, and ovary as specimens. They were fixed under the following 11 conditions: “Fixed at RT for 1, 3, and 7 days”, “Refrigerated immediately after fixing and stored for 3 to 7 days”, “Fixative partially replaced with alcohol after fixing at RT for 1 day and stored at RT for 2 to 6 days”, “Fixative completely replaced with alcohol after fixing at RT for 1 day and stored at RT for 2 to 6 days”, and “Refrigerated after fixing at RT for 1 day and stored for 2 to 6 days”. Nucleic acid fragmentation was evaluated in terms of ΔCT value, and results of HE staining and IHC were also evaluated. Specimens that were “fixed at RT for 3 and 7 days” were found to have QC values below the recommended values. Under conditions other than “fixed at RT for 3 to 7 days”, the QC value was equivalent to that under “fixed at room temperature for 1 day”. For both HE staining and IHC, there was no problem with the staining results under all the set fixation conditions. It was considered that good nucleic acid quality could be maintained except for “fixed at RT for 3 to 7 days”. It was also shown that these fixation conditions do not adversely affect the histopathological diagnosis.
近年,病理組織検体を用いた遺伝子検査は急増している。現在では次世代シークエンサー(next generation sequencer;以下NGS)を用いた遺伝子パネル検査が保険承認され1),近い将来,さらなる分子病理診断の臨床導入が見込まれている2)。
分子病理診断を高い精度で行うためには,検査の成否を左右する検体の核酸品質管理は極めて重要である。特に治療の選択を目的として行われる遺伝子検査においては,低品質な検体が原因で誤った結果がもたらされた場合,患者の治療機会の損失につながる。遺伝子パネル検査においては複数遺伝子を対象とするため,その結果の質を保証するためには,現行の単一遺伝子検査以上に,使用する検体に対してより厳格な核酸の品質管理が求められる。
核酸品質の評価には,ΔCt(Threshold Cycle)値やDIN(DNA Integrity Number)値などの指標が用いられ3),いずれも核酸の断片化の程度を評価している。低品質な検体では核酸の断片化が顕著であり,遺伝子パネル検査が成功しないとの報告もある3)。
この分子病理診断には,組織診断を目的として作製されるホルマリン固定パラフィン包埋(formalin fixed paraffin embedded;以下FFPE)検体が最もよく用いられる。FFPE検体の品質管理に影響を与える重要な因子の一つとして,ホルマリン固定時間が挙げられる。「ゲノム診療用病理組織検体取扱い規程」において,ホルマリン固定時間は6–48時間が推奨されている3)。推奨ホルマリン固定時間を超過すると,核酸の断片化が顕著となり,低品質な遺伝子検体の原因となる可能性がある。
このホルマリン固定時間において臨床の現場で特に問題となるのは,金曜日に採取された生検検体(以下,Friday biopsy)や長期休暇前に提出された生検検体である。当院では,Friday biopsyや長期休暇前に提出された全ての生検検体を翌日に処理することは困難であり,推奨ホルマリン固定時間を超過しているのが現状である。しかし,将来のさらなる分子病理診断の臨床導入を見据え,全ての病理組織検体に対し,核酸品質を低下させない取り組みが重要であり,ホルマリン固定条件や業務体制を見直していく必要がある。過去には,推奨ホルマリン固定時間を超過する場合は,1日間室温ホルマリン固定後の組織検体を80%エタノールに置換することにより,過剰な固定作用を抑え,核酸品質が保持できるとの報告がある4)が,様々な固定条件で詳細に検討した研究は少ない。現状の運用では長時間ホルマリン固定されている検体に対し,良好な核酸品質が保持できる固定条件方法を提案できれば,NGSを用いた遺伝子検査の精度向上に寄与する可能性がある。
今回我々は,Friday biopsyや長期休暇前に提出された生検検体を想定し,様々な条件で固定した検体に対し,ΔCt値を用いて核酸断片化の程度を比較し,良好な核酸品質を保持できるホルマリン固定条件を検討した。また,それらの固定条件が,形態学所見や免疫組織化学染色(immunohistochemistry;以下,IHC)による従来の病理診断に与える影響についても検討した。
当院にて,術中迅速病理検査のために摘出された未固定の肺,甲状腺,卵巣の一部を用い,腫瘍細胞が含まれるように,肺は2 × 2 × 2 mm程度に,甲状腺と卵巣は5 × 5 × 5 mm程度にトリミングして検討に使用した。それぞれの検体に対し,「2.設定した固定条件」に示す条件で固定後,FFPEブロックを作製した。ホルマリンは,10%中性緩衝ホルマリンを使用した。その後,ΔCT値を用いた核酸品質の評価およびhematoxylin-eosin(以下,HE)染色とIHC標本の染色性評価を行った。使用した検体は,その後の病理組織診断により,肺は腺癌,甲状腺は腺腫様甲状腺腫,卵巣は漿液性癌と診断された。
2. 設定した固定条件設定した固定条件をFigure 1に示した。「① 1日間室温固定」,「② 3日間室温固定」,「③ 1日間室温固定後に99%エタノールへ置換後に2日間室温保存」,「④ 1日間室温固定後に99%エタノールへ完全置換(99%エタノールを2時間毎に3回交換し,完全にエタノールへ置換)後に2日間室温保存」,「⑤ 1日間室温固定後に2日間冷蔵固定」,「⑥ 固定直後から冷蔵し3日間固定」,「⑦ 7日間室温固定」,「⑧ 1日間室温固定後に99%エタノールへ置換後に6日間室温保存」,「⑨ 1日間室温固定後に99%エタノールへ完全置換後6日間室温保存」,「⑩ 1日間室温固定後に6日間冷蔵固定」,「⑪ 固定直後から冷蔵し7日間固定」の11の条件で固定を行った。冷虚血時間の影響による核酸品質低下を回避するため,検体摘出後1時間以内となるように固定を開始した。「① 1日間室温固定」は,固定開始から約24時間後に自動包埋機に入れて処理を開始した。固定後2日目に99%エタノールに置換した「③,④,⑧,⑨」および,冷蔵に移動した「⑤,⑩」の検体は,固定開始後約24時間後にそれぞれ処理を行った。今回冷蔵保存に使用した冷蔵庫は,温度管理システムWireless watcher(CHINO社)により24時間温度管理されており,検討期間中,保存した冷蔵庫の温度異常(温度分布幅【3.6~4.8℃】の逸脱)は認められなかった。

10% NBF fixation was started under each condition within 1 hour, after the tissue was removed. ① was assumed a biopsy sample collected from Monday to Thursday. ②, ③, ④, ⑤, ⑥ were assumed a biopsy sample collected on Friday. ⑦, ⑧, ⑨, ⑩, ⑪ were assumed a biopsy sample collected before a long vacation.
99% ethanol (completely move): Specimens were completely replaced with ethanol from formalin by exchanging 99% ethanol 3 times every 2 hours.
NBF: Neutral buffered formalin
RT: Room temperature
3日間それぞれの条件で組織を固定(②~⑥)した検体はFriday biopsyを,7日間それぞれの条件で組織を固定(⑦~⑪)した検体は長期休暇前に提出された生検検体を想定して設定した。
3. ΔCT値を用いた核酸品質の評価方法 1) Deoxyribonucleic acid(以下,DNA)の抽出対象のFFPEブロックから各々10 μmの厚さの切片を作製し,コバス® DNAプレパレーションキット(FFPE)を用いて,添付文書5)に従ってDNAを抽出した。
2) ΔCT値の測定TaqMan® RNaseP Detection Reagent Kit(Thermo Fisher社)およびTaqMan® MGB遺伝子発現Kit(Thermo Fisher社)を用いて,アプリケーションノート6)に従って増幅条件を設定し,リアルタイムPCRを行った。リアルタイムPCR装置は,コバス® z480(Roche Diagnostics社)を使用し,核酸増幅および検出を行った。
3) 品質検証値(以下quality control;QC値)の算出方法と評価まず,Short AssayとLong Assayを絶対定量した。また,Human Control DNAをリファレンスとし,それぞれのサンプル間でLong Assay/Short Assayの比を比較する相対定量を行った。計算式は,まず各検体について
【Ratio (Long/Short) = 2 − ([Ct_long] − [Ct_short])】
を計算した。その後,コントロールサンプルを基準の「1.0」とした各検体のNormalized ratio(= QC値)にするため,各検体のRatioをコントロールサンプルのRatio値で割算した。
【QC値=各検体のRatio ÷ コントロールサンプルのRatio】
Thermo Fisher社が推奨するQC値は0.2以上であるため,0.2以上を示す検体は,核酸品質が良好に保たれていると評価した。
4. 病理診断に与える影響の検討方法 1) HE染色対象のFFPEブロックから3~4 μmの切片を作製し,それぞれの検体につきHE染色を作製した。
2) IHC対象のFFPEブロックから3~4 μmの切片を作製し,ベンタナ ベンチマークULTRA(Roche Diagnostics社)を用いてIHCを行った。抗体は,肺検体(腺癌)に対してはThyroid transcription factor 1(以下:TTF-1,clone:8G7G3/1)とNapsin A(clone: TMU-AD02)を,甲状腺検体(腺腫様甲状腺腫)に対してはTTF-1(clone: 8G7G3/1)とThyroglobulin(ポリクローナル抗体)を,卵巣検体(漿液性癌)に対してはWilms tumor 1(以下:WT-1,clone:6F-H2)およびp53(clone: DO-7)用いて実施した。
3) HE染色およびIHCの染色性の評価日本病理学会認定の病理専門医と,日本臨床衛生検査技師会認定の認定病理検査技師が評価を行った。HE染色は,ヘマトキシリンとエオジンの染色性および全体のコントラストについて,IHCはそれぞれの抗体による染色部位および染色強度を評価し,「1日間室温固定」と「それ以外の固定条件」を比較した。
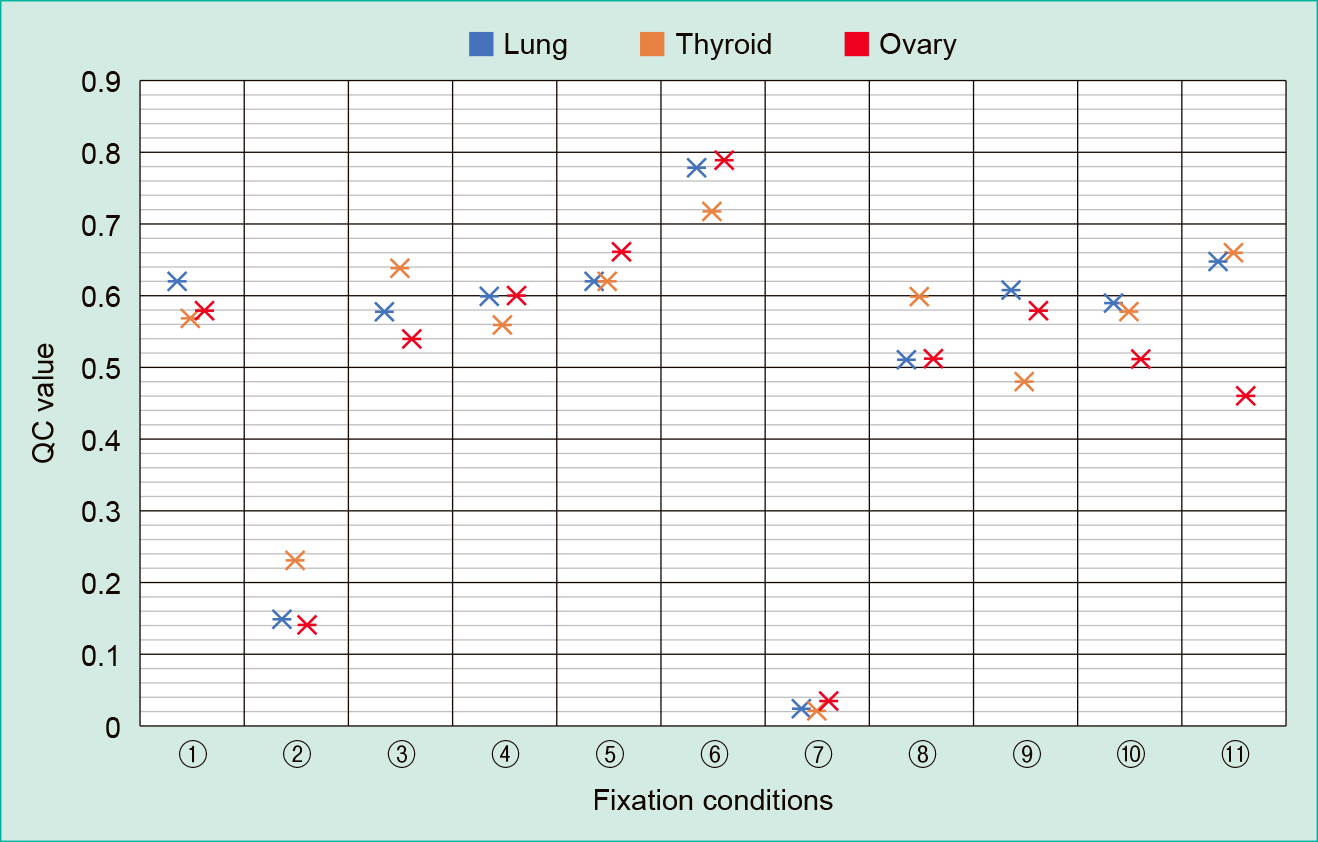
それぞれの固定条件におけるQC値の結果をTable 1に示した。「① 1日間室温固定」検体におけるQC値は,肺が0.62,甲状腺が0.57,卵巣が0.58であった。「② 3日間室温固定」検体におけるQC値は,肺が0.15,甲状腺が0.23,卵巣が0.14で,推奨値(0.2以上)を下回る検体が認められた。「⑦ 7日間室温固定」検体におけるQC値は,肺が0.025,甲状腺が0.021,卵巣が0.034で,全検体においてQC値が顕著に低下した。「② 3日間室温固定」と「⑦ 7日間室温固定」以外の固定条件においては,「① 1日間室温固定」の場合と変わらない良好な核酸品質が保持された。最もQC値が高かったのは,「⑥ 固定直後から冷蔵し3日間固定」(Figure 2)であり,QC値はそれぞれ,肺が0.78,甲状腺が0.72,卵巣が0.79であった。同一条件における組織別のQC値の比較においては,大きな違いは認められなかった。
| 10% NBF fixation conditions | QC value | |||
|---|---|---|---|---|
| Lung | Thyroid | Ovary | ||
| ① | 10% NBF fixation at RT for 1 day | 0.62 | 0.57 | 0.58 |
| ② | 10% NBF fixation at RT for 3 days | 0.15 | 0.23 | 0.14 |
| ③ | 10% NBF fixation at RT for 1 day → 99% ethanol for 2 days | 0.58 | 0.64 | 0.54 |
| ④ | 10% NBF fixation at RT for 1 day → 99% ethanol (completely move) for 2 days | 0.60 | 0.56 | 0.60 |
| ⑤ | 10% NBF fixation at RT for 1 day → 4°C for 2 days | 0.62 | 0.62 | 0.66 |
| ⑥ | 10% NBF fixation at 4°C for 3 days | 0.78 | 0.72 | 0.79 |
| ⑦ | 10% NBF fixation at RT for 7 days | 0.025 | 0.021 | 0.034 |
| ⑧ | 10% NBF fixation at RT for 1 day → 99% ethanol for 6 days | 0.51 | 0.60 | 0.51 |
| ⑨ | 10% NBF fixation at RT for 1 day → 99% ethanol (completely move) for 6 days | 0.61 | 0.48 | 0.58 |
| ⑩ | 10% NBF fixation at RT for 1 day → 4°C for 6 days | 0.59 | 0.58 | 0.51 |
| ⑪ | 10% NBF fixation at 4°C for 7 days | 0.65 | 0.66 | 0.46 |
NBF: Neutral buffered formalin
QC: Quality control
RT: Room temperature
① 10% NBF fixation at RT for 1 day
② 10% NBF fixation at RT for 3 days
③ 10% NBF fixation at RT for 1 day → 99% ethanol for 2 days
④ 10% NBF fixation at RT for 1 day → 99% ethanol (completely move) for 2 days
⑤ 10% NBF fixation at RT for 1 day → 4°C for 2 days
⑥ 10% NBF fixation at 4°C for 3 days
⑦ 10% NBF fixation at RT for 7 days
⑧ 10% NBF fixation at RT for 1 day → 99% ethanol for 6 days
⑨ 10% NBF fixation at RT for 1 day → 99% ethanol (completely move) for 6 days
⑩ 10% NBF fixation at RT for 1 day → 4°C for 6 days
⑪ 10% NBF fixation at 4°C for 7 days
99% ethanol (completely move): Specimens were completely replaced with ethanol from formalin by exchanging 99% ethanol 3 times every 2 hours.
NBF: Neutral buffered formalin
QC: Quality control
RT: Room temperature
HE染色では,肺,甲状腺,卵巣検体いずれも,「設定した固定条件すべて」と「1日間室温固定」により作製されたHE染色を比較した結果,ヘマトキシリンおよびエオジンの染色性,全体のコントラストに違いは認められなかった。また,今回検討した抗体によるIHCの結果では,設定した固定条件すべてにおいて,肺,甲状腺,卵巣いずれの検体も,「1日間室温固定」の染色強度および染色部位の結果と比較して違いは認められなかった(Figure 3)。病理専門医により,全ての固定条件により作製されたHE染色およびIHCは,病理診断への悪影響はないとの見解を得た。

A), B) and C) show HE staining, TTF-1 and Napsin A protein expressions by immunohistochemical staining under fixed at RT conditions, respectively (③ 10% NBF fixation at RT for 1 day→99% ethanol for 2 days).
D), E) and F) show HE staining, TTF-1 and Napsin A protein expressions by immunohistochemical staining under fixed at 4°C conditions, respectively (⑥ 10% NBF fixation at 4°C for 3 days).
HE: Hematoxylin Eosin, TTF-1: Thyroid transcription factor-1
RT: Room temperature, NBF: Neutral buffered formalin
今回我々は,ホルマリン推奨固定時間を超過する可能性があるFriday biopsyや長期休暇前に提出された生検検体においても,良好な核酸品質を保持できる固定方法を検討するため,未固定の肺,甲状腺,卵巣3種類の組織検体を用いて様々な条件で固定を行い,ΔCt値を用いて核酸断片化の程度を比較した。
今回の検討結果では,肺,甲状腺,卵巣全ての検体において,「② 3日間室温固定」「⑦ 7日間室温固定」した検体は「① 1日間室温固定」した検体よりもQC値が低く,これまでの報告と同様に,固定時間の延長により核酸の断片化が進むことが確認された。また,「3日間室温固定」した肺や甲状腺検体,「⑦ 7日間室温固定」した全ての検体において,推奨QC値である0.2を下回った。特に「⑦ 7日間室温固定」した検体では,QC値低下が顕著であった。核酸が低品質な検体では,NGSを用いたパネル検査が不成功となる割合が高いことが報告されている3)。「② 3日間室温固定」「⑦ 7日間室温固定」した検体でNGSを用いたパネル検査を実施した場合,核酸品質劣化の影響により不成功になる可能性が考えられた。
ホルマリン固定時間超過による核酸の断片化を防止するため,今回我々は,1日間室温ホルマリン固定後の検体を99%エタノールに浸漬し,核酸の断片化が抑えられるかを検討した。また,一度の99%エタノールへの交換だけでは十分にホルマリンからエタノールへ置換されず核酸品質に影響を及ぼす可能性を考え,「99%エタノールを2時間毎に3回交換し,完全にエタノールへ置換」する方法も同時に検証した。これまでの研究で,核酸の保存性の観点からはアルコール固定がホルマリン固定よりも優れており,エタノール固定は品質良好な核酸を長期間保持できることが報告されている7)。今回,エタノールに置換した条件である「③ 1日間室温固定後に99%エタノールへ置換して2日間室温保存」,「④ 1日間室温固定後に99%エタノールへ完全置換して2日間室温保存」,「⑧ 1日間室温固定後に99%エタノールへ置換後に6日間室温保存」,「⑨ 1日間室温固定後に99%エタノールへ完全置換後6日間室温保存」では,全ての検体において「① 1日間室温固定」と変わらないQC値を示した。以上より,1日間室温固定後のエタノールへの置換は,その後の核酸の断片化が抑えられ,良好な核酸品質保持のための有用な方法であることが示された。また,エタノールへの置換後少なくとも6日間は,核酸品質の劣化が抑えられることが分かった。「1回のエタノール交換による置換」か「複数回のエタノール交換による置換」の間には,QC値に大きな違いはなく,今回の検討結果からは,「1回のエタノール交換による置換」で十分であると考えられた。しかし,今回の検討で対象とした組織は,一般的な生検検体を想定し,大きい組織でも5 mm × 5 mm × 5 mm程度であった。この組織検体がさらに大きい場合は,今回の検討結果のように適切にエタノール置換されず,核酸品質に影響を与える可能性は否定できない。組織検体の大きさによっては,エタノールへの浸漬時間や液交換頻度の決定にはさらなる検討が必要と考えられる。
さらに我々は,「固定直後」および「1日間室温ホルマリン固定後」に冷蔵保存し,核酸の断片化が抑えられるかについても同時に検討した。検体採取後,ホルマリン固定までに時間を要する場合は,組織検体を冷蔵保存することで核酸の断片化が抑えられると報告されている3)。また,過去の研究において,良好な核酸品質保持のための冷蔵ホルマリン固定の有用性についても報告されている8),9)。Berrinoら9)は,2 cm角程度にトリミングした乳がん手術検体を用いて24時間,室温固定と冷蔵固定後の核酸品質を比較したところ,冷蔵固定の方が良好な核酸品質が保持できたと報告した。しかし,固定時間が24時間を超える休日前の提出検体を想定し,数日間冷蔵固定して核酸品質を検討した研究は少ない。今回の検討結果では,冷蔵保存した条件である「⑤ 1日間室温固定後に2日間冷蔵固定」,「⑥ 固定直後から冷蔵し3日間固定」,「⑩ 1日間室温固定後に6日間冷蔵固定」,「⑪ 固定直後から冷蔵し7日間固定」では,全ての検体において「① 1日間室温固定」とほとんど変わらない良好なQC値を示した。以上より,「固定直後から冷蔵保存」および「1日間室温ホルマリン固定後の冷蔵保存」においても,核酸の断片化は抑えられ,良好な核酸品質保持のための有用な方法であることが示された。また,1日間室温固定後に冷蔵固定を行えば少なくとも6日間,固定直後から冷蔵固定を行えば少なくとも7日間は,核酸品質の劣化が抑えられることが分かった。特に最もQC値が高い傾向にあったのは,「⑥ 固定直後から冷蔵し3日間固定」であり,「① 1日間室温固定」や「⑤ 1日間室温固定後に2日間冷蔵固定」よりも核酸品質保持が良好であった(Figure 2)。Berrinoら9)は,冷蔵ホルマリン固定で良好なDNA品質が保持されるメカニズムとして,4℃下では,Deoxyribonuclease(以下,DNAse)活性をブロックすることによって,DNAの最初の酵素分解とDNA断片化につながるホルマリン依存性架橋の両方を減らすことができると仮説を立てている。今回の我々の検討結果は,この仮説の根拠となる可能性がある。さらにBussolatiら8)は,ホルマリン固定とRibonucleic acid(以下,RNA)の断片化について検討しており,RNAの断片化はホルマリンが浸透し組織検体が固定されるまでの間のRibonuclease(以下,RNAase)の活性化によって引き起こされるが,RNAaseは4℃下ではその活性が制限されると報告している。以上より,ホルマリンによる冷蔵固定は可能な限り固定直後から行うことにより,DNAおよびRNAの断片化を防ぐことが可能であり,良好な核酸品質保持のために重要と考えられる。しかし,手術材料などの大きな組織検体を固定直後から冷蔵した場合に,小さい検体同様,良好な核酸品質の保持に優れるかについての議論は,さらなる研究が望まれる。また,今回,我々はRNAについての検討は行っていない。NGS解析を視野にこの運用を実施する前には,この点についても十分に留意する必要がある。
次に,今回検討した固定条件により作製されたFFPEを用いて病理診断を行う場合,HE染色やIHCの染色性に与える影響について検証した。NGSを使用したパネル検査は,病理組織検体中の悪性細胞の遺伝子を検索する必要がある。そのため,パネル検査に用いる検体は,従来の病理診断が問題なくできることが不可欠である。つまり,FFPEの作製は,良好な核酸品質を保持できるだけでなく,形態診断に影響を及ぼさず,またIHCの染色性にも影響を与えない方法を採用する必要がある。今回の検討では,いずれの固定条件においても,HE染色による形態診断およびIHCの染色性に問題は検出されず,病理診断への悪影響を及ぼさないことが示された。前述したように,ホルマリン固定中に冷蔵保存した検体では,固定不良が原因によるHE染色やIHCによる染色性低下の問題が懸念された。過去の報告では,固定までの時間が遅くなると,抗体の種類によって蛋白発現が偽陰性になると報告されている10)。今回は生検検体を想定して,組織を小さくトリミングして使用したため,冷蔵保存による固定不良の影響を受けにくかった可能性もある。核酸品質だけでなく,病理診断への影響に関しても全ての病理組織検体に対し今回の固定条件を適用するためには,さらに大きい組織検体も対象とした詳細な検討が必要と考える。また,今回の検討に使用したIHCの抗体は,陽性部位が核に存在するもの,細胞質に存在するものをそれぞれ選択して行ったが,今回の検討のみでは,全ての抗体がホルマリン室温固定のみの場合と同様の染色性を示す根拠とはならない。一方で,病理診断に必要とされる全ての抗体に対して,今回設定した固定条件により作製されたIHC標本が,ホルマリン室温固定のみの場合と同様の染色性を示すかを検討することは現実的に困難と考えられる。コントロール切片を同時に染色したり,複数の抗体で総合的に判定したりするなど,IHCの結果解釈は今後の課題と言える。
今回検討した固定方法の中で,1日間室温固定後に「冷蔵へ移動して保存」および「エタノールへ置換して保存」する運用は,休日の勤務体制などの要因も影響するため,全ての施設において対応が可能とは言えない。24時間,臨床検査技師が日当直業務などに勤務している施設では,日当直者に検体の移動を依頼することも可能だが,特に微小検体をホルマリンからエタノールに移す作業は,病理組織検体を扱った経験のない技師では,検体紛失やコンタミネーションなどのリスクも存在する。一方で,「固定直後から冷蔵保存」する運用では,翌日に人の手を要さないため,勤務体制の影響を受けない。このように,臨床現場での業務効率を考慮すると,検体提出直後から冷蔵固定することが最善の固定方法であると考えられる。正確に検体の固定温度を管理するためには,温度管理システムが搭載された冷蔵庫の設置が望ましく,さらに,提出検体数や検体の大きさによっては大型もしくは複数の冷蔵庫が必要となる可能性がある。全ての病理組織検体に対して良好な核酸品質を保持するためには,固定方法の改善だけでなく,設備についても検討していく必要があると思われる。
金曜日や長期休暇前に提出された生検検体は,冷蔵固定もしくは1日間室温固定後のエタノール置換により,良好な核酸品質を保持できることが示された。また,これらの固定条件は,病理組織診断に悪影響を及ぼさないことが分かった。良好な核酸品質の保持に加えて臨床現場での業務効率を考慮すると,検体提出直後から冷蔵する固定条件が最善の固定条件であると考えられる。なお,コンパニオン診断を始め治療薬選択が必要な検体は,各施設において十分な検討の上,使用することが必要である。
本研究は,日本赤十字社愛知医療センター名古屋第二病院治験・臨床研究審査委員会の承認(整理番号:1457)を得て行った。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。