2022 年 71 巻 2 号 p. 335-341
2022 年 71 巻 2 号 p. 335-341
新型コロナウイルス感染症(COVID-19)検査として汎用される抗原定性検査は,簡便かつ安価に検査可能であることから広く用いられる一方,核酸増幅検査との不一致例も報告されるが頻度や症例に関する詳細な報告が少ない。検査法による診断性能の違いを明らかにするため,SARS-CoV-2抗原定性検査キット「クイックナビTM-COVID19 Ag」と核酸増幅検査の結果を後ろ向きに比較検討した。同時提出された2,721件を対象に,両者を比較したところ,全体一致率99.3%が得られた。抗原定性検査陰性,核酸増幅検査陽性となった症例を13例認めた。多くの症例でCt値が高い傾向を示しており,ウイルス量が少ないことで抗原定性検査の検出感度を下回り,核酸増幅検査との結果が一致しなかった可能性が考えられる。一方,抗原定性検査陽性,核酸増幅検査陰性となった症例を7例認めた。いずれも,COVID-19は否定され,抗原定性検査偽陽性の判断であったが,全症例で偽陽性の原因の特定に至らなかった。以上のことから,「クイックナビTM-COVID19 Ag」はSARS-CoV-2抗原定性検査として十分な性能を有していることが明らかとなった。一方でイムノクロマト法として偽陰性や偽陽性を避けることはできないため,利用者は検査法の特性について十分に留意したうえで使用することが求められる。
Rapid diagnostic tests by antigen detection for diagnosing COVID-19 are widely used because they can be conducted easily and inexpensively. In this study, we compared the diagnostic performance of the SARS-CoV-2 antigen qualitative test kit “Quick NaviTM-COVID19 Ag” compared with that of the nucleic acid amplification test. As a result, both tests showed a concordance rate of 99.3%. Thirty cases showed both negative antigen qualitative and positive nucleic acid amplification test results. In many of the 30 cases, the Ct value tends to be high, and the amount of virus may be lower than the minimum detection sensitivity of the antigen qualitative test, and thus the results of the nucleic acid amplification test may not match those of the antigen qualitative test. On the other hand, seven cases showed both positive antigen qualitative and negative nucleic acid amplification test results. In all these seven cases, COVID-19 was confirmed to be negative, but a false positive result of the antigen qualitative test was obtained, the cause of which was not identified. From the above, it was clarified that “Quick NaviTM-COVID19 Ag” has sufficient performance as a SARS-CoV-2 antigen qualitative test. However, since false negative and positive results, which depend on the performance limits of the immunochromatography method, cannot be avoided, we should use it with sufficient attention to the characteristics of the test method.
2019年12月に中華人民共和国湖北省武漢市で発生した新型コロナウイルス(SARS-CoV-2)による感染症(COVID-19)が世界的流行を引き起こしている。2022年1月現在,国内ワクチン接種3回目が実施されているものの,変異株の確認・流行やブレイクスルー感染が継続して散見されている。医療提供体制の維持のためには,医療機関の機能・種別に関わらず,広くSARS-CoV-2の検査体制を構築することが基軸となる。
一般診療およびCOVID-19診療に汎用される検査として,抗原定性検査,抗原定量検査,核酸増幅検査が知られている1)。この中で,抗原定性検査はイムノクロマト法が用いられる。イムノクロマト法は,簡便かつ安価に検査可能であることから広く用いられる一方,簡易法が故にSARS-CoV-2においても偽陽性例の報告2)も散見されるが,未だ頻度や症例に関する詳細な報告が少ない。
我々は,一般診療とCOVID-19診療を併行するなかで,抗原定性検査キット「クイックナビTM-COVID19 Ag」と核酸増幅検査を併用した過去1年分の実地臨床データを後方視的に比較し,若干の知見を得たので報告する。
2020年9月1日から2021年8月31日に,COVID-19診療もしくは一般診療目的に採取された鼻咽頭ぬぐい液を用いたSARS-CoV-2に対するイムノクロマト法による抗原定性検査4,845件,核酸増幅検査9,905件(鼻咽頭ぬぐい液,院内3,742件,外注6,163件)のうち,同時提出された2,721件を対象とし,両者の比較を実施した。また,抗原定性検査と核酸増幅検査と不一致例に関して,年齢,性別および関連する臨床情報について調査を行った。なお,期間中の核酸増幅検査は試薬需給面等を考慮し複数種類使い分けたが,それによる診療科や患者等での測定系の偏りはない。
検査データおよび診療情報の使用にあたっては,包括同意を得ており,個人情報はすべて連結不可能匿名化を行った。なお,本検討は筆頭著者の所属先である竹田綜合病院 臨床倫理委員会の承認を得ている(研究倫理審査受付番号2021-032K,承認日2021年10月8日)。
2. 方法 1) 抗原定性検査クイックナビTM-COVID19 Ag(デンカ株式会社)を用い,添付文書に従い操作した。
2) 核酸増幅検査(院内)使用機器:GeneXpertシステムGX-XVIおよびGeneXpertシステムGX-IV(ベックマン・コールター株式会社),使用試薬:Xpert Xpress SARS-CoV-2「セフィエド」(ベックマン・コールター株式会社),もしくは,使用機器:TRCReady®-80(東ソー株式会社),使用試薬:2019新型コロナウイルスRNA検出試薬TRCReady SARS CoV-2(東ソー株式会社)を使用した。測定操作はメーカーの添付文書に従い実施した。
3) 核酸増幅検査(外注)外注委託先(株式会社江東微生物研究所)において採用されているリアルタイムRT-PCRシステムとした。使用機器:Thermal Cycler Dice® Real Time System III(タカラバイオ株式会社),使用試薬:Takara SARS-CoV-2ダイレクトPCR検出キット(タカラバイオ株式会社)を採用していた。測定操作はメーカーの添付文書に従い実施されていた。
全2,721件のうち,抗原定性検査と核酸増幅検査の判定結果内訳をTable 1に示す。なお,2件は,抗原定性検査において,判定ライン不鮮明等の理由により判定保留とし,集計から除外した(症例情報は後述する)。陽性一致が49件,陰性一致が2,650件,全体一致率99.3%が得られた。
| 核酸増幅検査 | 合計 | |||
|---|---|---|---|---|
| 陽性 | 陰性 | |||
| 抗原定性検査「クイックナビTM-COVID19 Ag」 | 陽性 | 49 | 7 | 56 |
| 陰性 | 13 | 2,650 | 2,663 | |
| 合計 | 62 | 2,657 | 2,719※ | |
※抗原定性検査が判定保留となった2例は除外
次に,抗原定性検査と核酸増幅検査の不一致例の臨床情報をTable 2,3に示す。抗原定性検査陰性,核酸増幅検査陽性となった症例は全13件であった(Table 2)。一方,抗原定性検査陽性,核酸増幅検査陰性となった症例は全7件であった(Table 3)。このうち症例20の反応プレート写真をFigure 1に示す。再現性の確認目的で検体抽出液を3日間冷蔵保管した後,同一ロットの別プレートで再試験を実施したが,検査当日と反応性に大きな変化は認めず,陽性ラインを認めた。
| 症例 | 年齢 | 性別 | 受診方法 | 主訴 | 受診時所見 | 既往症 | 発症からの経過日数 | Threshold Cycle (Ct値) |
診断名 |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 88 | 女 | 救急搬送 | 胸部絞扼感,呼吸苦 | 36.5℃, SpO2 86% |
心不全,糖尿病, COVID-19既往 |
1日目 | 36 | COVID-19による器質化肺炎(感染既往扱い)(再検にて,核酸増幅検査陰性) |
| 2 | 63 | 女 | 発熱外来 | 吸気時左胸痛,咳嗽(±) | 36.5℃, SpO2 95% |
尿路感染症,腸閉塞 | 1日目 | 33 | COVID-19 |
| 3 | 52 | 男 | 発熱外来 | 息切れ | 38.5℃, SpO2 81% |
9日目 | 31.3 | COVID-19 | |
| 4 | 54 | 女 | 救急外来 | 倦怠感 | 37.2℃, SpO2 98% |
13日目 | 29 | COVID-19 | |
| 5 | 65 | 男 | 救急搬送 | 呼吸困難,発熱 | 37.6℃, SpO2 90% |
10日目 | 34 | COVID-19 | |
| 6 | 83 | 女 | 救急搬送 | 呼吸苦 | 37.5℃, SpO2 88% |
高血圧,脂質異常症 | > 10日目 | 22.0 | COVID-19 |
| 7 | 52 | 男 | 発熱外来 | 発熱,咳嗽(±) | 39.0℃, SpO2 92% |
高血圧,高尿酸血症, 潰瘍性大腸炎 |
7日目 | 23.2 | COVID-19 |
| 8 | 88 | 女 | 救急搬送 | 倒れていた | 37.3℃, SpO2 89% |
認知症 同居人が10日前COVID-19診断 |
COVID-19 | ||
| 9 | 76 | 男 | 発熱外来 | 発熱,腹部膨満感 | 38.2℃ | 鬱病,不眠症,高血圧, 頸椎症,前立腺癌 |
4日目 | 42.8 | 尿管結石・水腎症 核酸増幅検査偽陽性と判断(再検にて,核酸増幅検査陰性) |
| 10 | 74 | 女 | 発熱外来 | 倦怠感 | 38.1℃, SpO2 93% |
アテローム性脳梗塞,糖尿病,高血圧,脂質異常症 | 4日目 | COVID-19 | |
| 11 | 46 | 女 | 救急外来 | 咳嗽 | 36.9℃, SpO2 97% |
18日前COVID-19診断(退院後),副鼻腔炎,喘息 | 4日目 | 34.6 | COVID-19による遷延性咳嗽(感染既往扱い) |
| 12 | 54 | 男 | 発熱外来 | 呼吸苦,発熱 | 37.5℃, SpO2 76% |
4日目 | COVID-19 | ||
| 13 | 61 | 男 | 発熱外来 | 呼吸苦 | 36.9℃, SpO2 93% |
16日目 | 36.9 | COVID-19 |
| 症例 | 年齢 | 性別 | 受診方法 | 主訴 | 受診時所見 | 既往症 | 発症からの経過日数 | 診断名 |
|---|---|---|---|---|---|---|---|---|
| 14 | 80 | 男 | 救急搬送 | 体動困難,呼吸苦 | 38.3℃, SpO2 96%(10 L) |
間質性肺炎,胆石,高血圧,糖尿病,高尿酸血症,頻尿 | 2日目 | 間質性肺炎急性増悪 |
| 15 | 4 | 女 | 発熱外来 | 発熱,嘔吐 | 39.9℃ | なし | 1日目 | 咽頭炎 |
| 16 | 16 | 男 | 救急外来 | 4週間続く咳嗽 | 36.5℃,SpO2 98% | 咽頭痛(4週間前) | 4週間 | 遷延性咳嗽 |
| 17 | 69 | 男 | 一般外来 (紹介受診) |
体動時呼吸苦 | 36.5℃,SpO2 94% | 肺結節,肺気腫,前立腺癌,蜂アナフィラキシー | 2週間 | 気胸 |
| 18 | 67 | 女 | 救急搬送 | 右側腹部痛で 体動困難 |
39.4℃,SpO2 95% | リウマチ,SLE | 4日目 | 右肺膿瘍 |
| 19 | 3 | 男 | 発熱外来 | 発熱,咳嗽,便秘 | 37.6℃,SpO2 98% | 胃軸捻転 | 3日目 | 急性気管支炎 |
| 20 | 4 | 男 | 救急搬送 | 発熱,痙攣 | 39.3℃,SpO2 95% | 熱性けいれん既往 | 1日目 | 熱性痙攣単純型2回目,扁桃炎 |
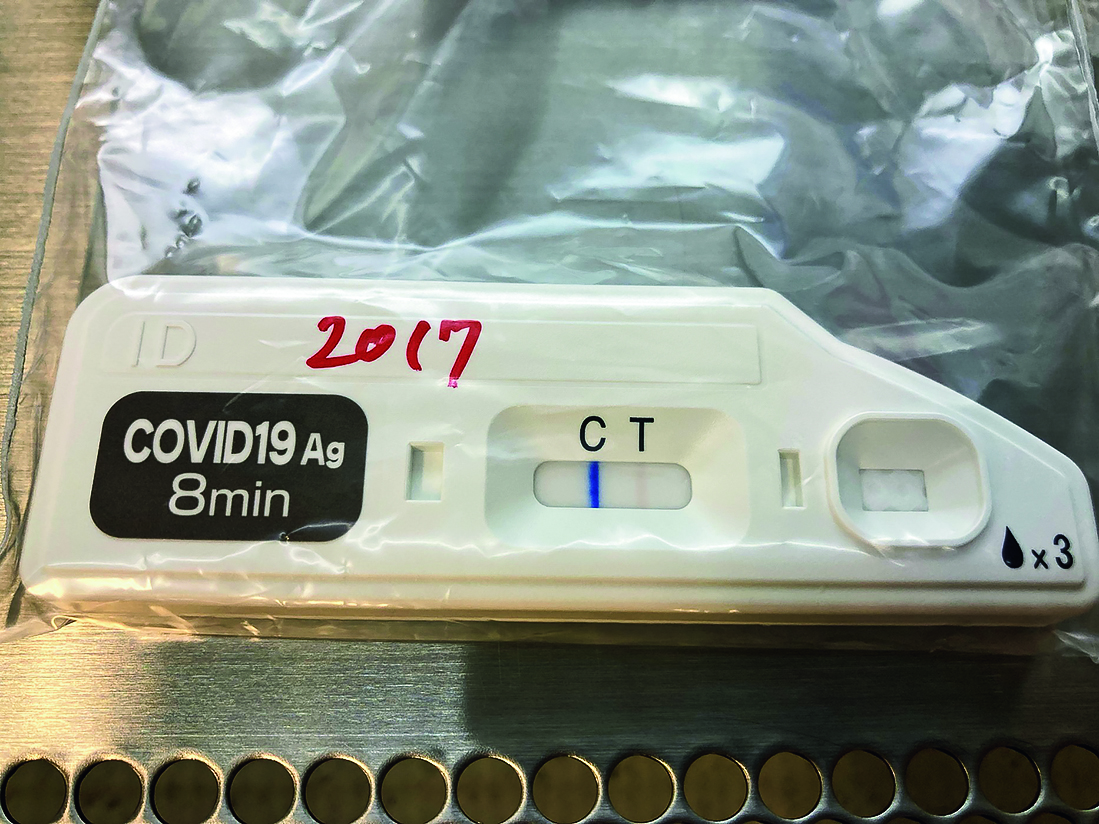
判定部に薄い陽性ラインを認める。
Table 4に抗原定性検査で判定保留とした2例を提示する。いずれも判定部におけるラインもしくは色調が不鮮明であるために判定保留とした。なお,症例22は症例19と同一患者であった。
| 症例 | 年齢 | 性別 | 受診方法 | 主訴 | 受診時所見 | 既往症 | 発症からの経過日数 | 診断名 |
|---|---|---|---|---|---|---|---|---|
| 21 | 94 | 女 | 救急搬送 | 呼吸困難にて紹介 | 36.9℃, SpO2 89%(2 L) |
右大腿骨転子部骨折,心不全, 慢性呼吸不全(HOT導入中) |
5日目 | 慢性呼吸不全 |
| 22 | 3 | 男 | 発熱外来 | 発熱,鼻汁,咳嗽 | 38.6℃ | 胃軸捻転 | 3日目 | 感冒 |
いずれも核酸増幅検査陰性となった。症例22は症例19と同一患者。
「クイックナビTM-COVID19 Ag」は,抗原定性検査として本邦でも比較的早期に利用可能となり広く流通し,COVID-19の診断および感染拡大防止に大きく寄与した。一方で,イムノクロマト法を原理とするため,当院でも核酸増幅検査との不一致症例を経験した。しかしながら,性能評価試験を除き,SARS-CoV-2抗原定性検査キットの使用経験に関する報告は少ない。本検討では,過去1年分の一般医療機関における実地臨床データとして,抗原定性検査と核酸増幅検査を後方視的に比較した。
今回用いた「クイックナビTM-COVID19 Ag」と核酸増幅検査との性能比較では,陽性一致率79.0%,陰性一致率99.7%,全体一致率99.3%が得られた。過去に報告がある「クイックナビTM-COVID19 Ag」に関する核酸増幅検査に対する性能比較では,陽性一致率37~91.7%1),3)と大きな開きがある。これは,地域の流行状況や対象患者における有症状率などの検査前確率の違いが結果に影響したとものと考えられ,それぞれの研究デザインの違いを反映したものであることが示唆される。カナダで実施された無症候労働者を対象とした大規模研究では,抗原定性検査と核酸増幅検査を比較したところ,抗原定性検査における偽陽性の頻度は0.05%であった4)。対して,本検討で得られた抗原定性検査の偽陽性率は0.26%と若干であるが高頻度であった。前述の通り,検査前確率の影響が示唆されるが,今後も症例数を重ね検証を行う予定である。一方,陰性一致率は既報1),3)とほぼ同等の結果であった。
抗原定性検査陰性および核酸増幅検査陽性となった13件の患者うち,COVID-19と確定診断されたのは10例であった(症例1および11は感染既往,症例9は核酸増幅検査偽陽性との判断であった)。また,抗原定性検査陰性の場合に確定診断が可能な,発症2–9日目に該当しない症例も散見された(症例1,2,4,5,6,13)。このような場合に確定診断を行うには,医師の判断にて核酸増幅検査を行う必要性がある1)ことから,これら6症例における抗原定性検査と核酸増幅検査の不一致は臨床的に問題とならない。他方,分析技術面からの考察を行うと,抗原定性検査陰性,核酸増幅検査陽性となった多くの症例で,核酸増幅検査におけるCt値が比較的高い傾向であることが明らかとなった。本検討で用いたクイックナビTM-COVID19 AgとリアルタイムRT-PCRの定量値を比較した報告3),6)によると,Ct値が30を超えた場合の,抗原定性検査の検出感度は著しく低下することが明らかになっている。つまりは,ウイルス量が少ないことで抗原定性検査の測定対象である核蛋白量が検出感度を下回り,核酸増幅検査との結果が一致しない可能性があることを示唆している。一般に,SARS-CoV-2抗原定性検査キットにおいて,感度を十分に得るためには検体抽出液1 mL中のウイルス量は3~4Logコピー程度が必要とされる6)。それ未満では,ウイルスが少量存在しても,抗原量不足のため検出できない可能性が高いと考えられる。また,今回,抗原定性検査のキット間差についての検討は行っていないが,Ct値22.5以上ではキットによりバラツキがあることも報告5)されており,Ct値が30未満の2症例(症例6,7)については,イムノクロマト法としての抗原定性検査キットの検出感度付近であったことが示唆される。他方,症例8,10,12におけるTRC時間はぞれぞれ2.1,3.3,3.2であったが抗原定性検査についての関連性は,報告がないため詳細は不明であり,症例数を集めて解析を検討している。
抗原定性検査陽性および核酸増幅検査陰性となった7件の患者うち,COVID-19と確定診断されたものはおらず,すべて抗原定性検査偽陽性との判断であった。このうち,症例15,16,17,20については,メーカーへ報告し,製品の異常有無について調査を依頼したが,特段異常を認めなかった。同様に,検査前,検査工程においても異常を認めなかったことから,患者由来の何らかの要因が偽陽性反応に関わった可能性が示唆された。症例20に関しては,メーカー立会いのもと3日間冷蔵保管した検体で再現性確認試験を実施したが,結果は検査当日と同じであった。
また,当院では判定ラインもしくはラインの色調が不鮮明であった場合に“判定保留”とすることで,ゴーストラインを誤って陽性と判定しないようルールを設け,このような場合は核酸増幅検査にて精査を行うような体制をとっている。本検討の対象期間中に,判定保留となった症例を2例認めた。のちに判明したことだが,症例22は症例19と同一患者であった。これらの検査は,14日間の間隔をおき,異なる受診契機で実施された抗原定性検査であった。偽陽性と判定保留を繰り返したことからも,患者由来の何らかの要因によって,偽陽性ラインや不鮮明なゴーストラインの出現が繰り返されたと考えられる。一方で,症例21については十分な検証ができなかったことから今後の報告に期待する。
イムノクロマト法にて偽陽性を引き起こす原因として,交差反応,非特異反応,検体抽出液の高粘稠性,および不適切使用等が知られている5)。特に,SARS-CoV-2抗原定性検査に関しては,過去にライノウイルスとの交差反応についての報告2)があるが,その後の追加検討では本キットはライノウイルスとの交差反応を認めないことが明らかとなった7)。本検討においては,残念ながら偽陽性の原因特定に至った症例はなかった。この他にも,近医にて抗原定性検査で陽性のため当院紹介となったが,当院におけるのちの核酸増幅検査で陰性となった症例を2例経験している(紹介元で使用した抗原定性検査キットは不明,核酸増幅検査の単独実施のため本検討の対象外)。これらの事例対策として,当院COVID-19診療指針では,抗原定性検査陽性であっても核酸増幅検査を必ず実施することとなった。いずれにせよ,偽陽性症例は患者/家族・行政・関係職員に与える影響が大きく,場合によっては非COVID-19患者をSARS-CoV-2感染リスクにさらす8)ことも十分考えられる。このようなケースに遭遇した際は,丁寧な説明と十分な検証が必要であると考える。
更には,抗原定性検査と核酸増幅検査の不一致例における臨床情報を調査したところ,Table 2やTable 3のいずれの場合においても,多くの症例でCOVID-19様の症状を有するものや,初療において院内感染防止対策が急がれる救急搬送症例が多くを占めた。これは,抗原定性検査陽性かつ核酸増幅検査陽性の49例との比較を行っても明確な違いは認められなかった。このことから,患者背景や臨床情報,抗原定性検査の結果のみでの診療には限界があることを示唆している。一方,臨床化学検査や免疫学的検査などの血清分析においては,血液疾患における異常蛋白や自己免疫疾患における自己抗体などの存在による測定系への干渉が知られている。不一致に対して,患者側の要因を明らかとするため,年齢,性別および関連する臨床情報等を調査したが,一定の傾向を認めず,また,疾患等との明確な関連性を導くことはできなかった。補足だが,関連して実施された全ての臨床検査において,機器チェックや結果チェックなどから推測可能な検体由来のエラーの存在を積極的に示唆する情報は得られなかった。イムノクロマト法の正確性に影響を及ぼす要因分析に関して,未だ報告が限られるため,現場で遭遇する非特異反応に関して十分な原因究明に至れていない。今後,これらに関する知見の集積を期待する。
本結果の留意点として,本検討は実地臨床の中で実施された抗原定性検査と核酸増幅検査の直接比較を行った検討であるため,一般的に予期しうる全ての変動要因を含めた結果である。その点でキット添付文書等に記載される純粋な性能評価とは異なる。また,昨今,抗原定性検査キットが薬局でも取り扱いが可能になった9)が,鼻腔拭い液の自己採取を前提としている。検体種別・採取を含めた検査前工程が検査品質を左右することは言うまでもなく,本検討や過去の報告と異なる結果が得られる可能性も十分に考えられる。検討結果の比較および解釈には十分注意が必要である。また,研究の限界として,当院のサンプルであること,調査期間における疫学を反映しているため,他の地域,あるいは変異株の出現により,結果が変化することが示唆され,一般化できない可能性がある。
以上,総括すると,実地臨床において,抗原定性検査「クイックナビTM-COVID19 Ag」は,核酸増幅検査と99.3%の一致性を確認し,十分な性能を有していることが明らかとなった。当院のような,市中病院においては,限られたマンパワーの中で,一般診療とCOVID-19診療を両立させる必要がある。当院では,24時間体制で核酸増幅検査も実施しているが,迅速に結果が得られる抗原定性検査は診療効率を考慮すれば必要不可欠な検査となっている。製品開発から上市まで短期間であったことを考慮しても,「クイックナビTM-COVID19 Ag」は十分に満足のいく性能を有していると考えられる。しかしながら,イムノクロマト法が故の偽陰性や偽陽性症例を避けることはできないため,可能な限り核酸増幅検査等の高感度検査と臨床情報を踏まえた総合的判断を行うことが望ましいと考える。
イムノクロマト法によるSARS-CoV-2抗原定性検査「クイックナビTM-COVID19 Ag」は,核酸増幅検査と99.3%の一致性を認め,SARS-CoV-2検査として十分な性能を有していることが明らかとなった。一方でイムノクロマト法として偽陰性や偽陽性を避けることはできないため,利用者は検査法の特性について十分に留意したうえで使用することが求められる。
なお,本論文の内容は,第53回日本臨床検査医学会東北支部総会・第32回日本臨床化学会東北支部総会(2021年9月4日,ウェビナー開催)におけるシンポジウム「検査室におけるピットフォール・異常検査値の対応」で報告したものを,一部再構成したものである。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。
解析・集計に協力頂いた当院臨床検査科佐藤 修,富樫 亮太,櫻田 成実の諸氏,不一致例の解析にご協力頂いたデンカ株式会社の関係者に深謝する。