病理検査では,色調の精度管理は人の目による主観的な確認で行われている。これまでRed-Green-Blue(RGB)やΔCによるHematoxylin-Eosin染色(以下,H&E染色)の数値化の試みがなされてきた。H&E染色性の色合いなどはある程度観察者の「慣れ」もあり,各施設内での内部精度管理が重要である。本検討では,当院で毎朝行っているH&E染色の染色性チェック用コントロール標本を使用して,染色後の標本をデジタル化し,画像解析ソフトウェアHALO®を用いて色調を数値化した。H&E染色の目視評価は比較的均一であり,差異を認めなかった。数値化した結果は,エオジンに周期的変動を認めた。また,管理限界を ±2SDおよび ±3SDに設定したXbar管理図を作成したところ管理限界幅内に収まっていた。本検討のように,HALO®解析を用いて色調を数値化することで,染色性の差異を客観的に評価することが可能となった。染色性の変動を可視化することは内部精度管理の手段として客観性があり有用である。
The quality control of the color was carried out by the subjective confirmation of the person conducting the pathological examination; furthermore, a trial of the digitizing of the Hematoxylin-Eosin stain (H&E stain) by Red-Green-Blue (RGB) and ΔC has not been conducted to date. In this study, we used a control specimen for the stainability check of the H&E stain every morning. We digitized the specimen after the staining and further digitized the color for the optical density using the image analysis software HALO® and compared it. As a result of having digitized the specimen, unevenness was larger in the first year compared to that in the 5 year. Visual evaluation of H&E staining was relatively uniform and no differences were observed. The numerical results showed periodic fluctuations in eosin. In addition, when we set the limit control in the Xbar control chart with ±2SD and ±3SD, the results were within the control limits. We could successfully evaluate an irregularity in the stainability objectively by digitizing the color for the optical density using HALO® analysis. It is an objective means of internal quality control and a useful tool to visualize changes in the stainability.
Hematoxylin-Eosin染色(以下,H&E染色)は病理診断に欠かすことのできない病理組織化学染色の基本であり,どの病理施設でも日常的に行われている1)。その良し悪しが病理診断の精度を左右するといっても過言ではない。本邦において継続的なH&E染色の外部精度管理は,現在のところ行われていない。H&E染色の色合いは観察者の主観もあり,現状では大きな問題となっていないが,将来のAI(artificial intelligence)診断の導入に際しては問題となる可能性がある。また,施設内でも病理検査を行う臨床検査技師の技量の差や作業手順書の未整備がある場合,施設内での染色の色合いに差異が発生する可能性がある。将来的には施設間の外部精度管理の導入も期待されるが,現状では,施設ごとの内部精度管理が非常に重要である1)~3)。
検査部門での内部精度管理では通常,標準物質を用い,得られた数値からXbar-R管理図を作成し日差変動や日内変動を管理している4),5)。当院病理部での現状は,毎朝始業時にコントロール切片を染色し,目視により染色性を評価することで内部精度管理を行っている。ただし,目視評価での内部精度管理では,判定者の主観(色調の基準)に左右されるため染色結果を数値化し,客観的データによる品質評価の導入が望まれる6)。そのためにはコントロールとしての切片の管理が必須となる。H&E染色では,市販されたコントロール切片は存在しない。従って,自施設による作製及び管理が必要である。
今回,我々は目視で染色の評価を行う際に主観的と感じる色の濃淡や明暗など,色の明度と彩度の組み合わせである色調をIndica Labs社の画像解析ソフトウェアHALO®を用いて数値化することを試みた。HALO®で算出可能な代表的な項目として,各色素の面積当たりの陽性率や染色強度に比例する染色陽性ピクセルの平均光学密度(optical density;OD値)がある。H&E染色の内部精度管理標本をデジタル撮影後,HALO®で算出したOD値を用いて客観的に評価し,内部精度管理への応用が可能か検討したため報告する。
使用した臓器は,手術時に得られた胃と肝臓の正常組織の一部を切り出し,10%中性緩衝ホルマリン液で固定後,パラフィン浸透を行ったブロックを使用した。コントロール切片は,4 μm設定で15枚の連続切片を作製した。
2. 染色方法H&E染色は,ティシュー・テック®プリズマTM(サクラファインテックジャパン株式会社)を使用し,色素はヘマトキシリン3G試薬(以下,Hx,サクラファインテックジャパン株式会社),エオジン試薬(以下,Eo,サクラファインテックジャパン株式会社)を使用した。
H&E染色プロトコールは,脱パラフィン後,水洗(30秒)→Hx①(2分30秒)→Hx②(2分30秒)→水洗(15秒)→水洗(30秒)→色出しにpH 7.4リン酸緩衝液(20秒)→水洗(3分)→Eo①(30秒)→Eo②(30秒)→水洗(10秒)→脱水,透徹,封入を行った。HxとEoは2槽構成で色素交換のタイミングは1週間とした。なお,①が新しい色素,②は色素交換のタイミングで①を落第させ使用した。H&E染色は,作製されたそれぞれのコントロール切片を毎朝始業時に1枚染色した。
3. デジタル画像化浜松ホトニクス株式会社のNano zoomer 2.0RSを使用し,染色した標本をスキャン倍率20倍でデジタル画像化した。
4. 画像解析Indica Labs社の自動画像解析ソフトHALO®を使用した。HALO®は画像分類に適合する畳み込みニューラルネットワーク(convolutional neural network; CNN)というディープラーニングのアルゴリズムの一種を利用している。このアルゴリズムは,大規模データセットでトレーニングすることが可能で,特に病理診断において大量にあるばらつき(変動)を取り扱うことができるという特徴がある。また,組織切片全体にわたって細胞ごとに形態学的および多重化された発現データの取得を行い,画像内の任意の細胞をクリックすることで,その特定の細胞の分析データが得られる。これまでRGBによるH&E染色の数値化という試みはなされているが,標本のどの場所を選択するかによって数値のバラつきが大きく,染色性の評価に用いることが困難であったが,HALO®のソートおよびフィルタリング機能により,対応する細胞集団を視覚的に評価しながらHx,Eoそれぞれの単染色を行った標本をコントロールとして,H&E染色標本の色調を数値化することが可能であるため本検討に採用した。
解析モジュールは,Area Quantificationを用いた。解析に使用した基準の色設定は,色素の試薬を新調した週初めの標本内からHxとEoをそれぞれ抽出し,臓器ごとに解析用アルゴリズムを作成した。解析は,HALO®内にデジタル画像を取り込み,各臓器の解析したい範囲を囲み(アノテーション)臓器ごとのアルゴリズムを用い解析した。
5. 画像解析結果の評価方法画像解析結果は,H&E染色画像からHxとEoそれぞれの単染色画像を自動で描出し,各色素の面積当たりの陽性率とOD値を算出した。陽性率は,染色された色の基準となるカラーベクトルの各ピクセルの成分強度を弱陽性(weak,黄色),中等度陽性(moderate,橙色),強陽性(strong,赤色)と区分けし算出した。OD値は,ある物質がどれだけ光を吸収するかどうかを表す値である。HALO®で算出可能なOD値は,撮影装置から得られるRGB 3色に分かれた色強度から算出される。HALO®で算出されるOD値の計算式は,「ODchannel = log10whiteValue − log10Channel」である。白は一般的に255であらわされることが多いため,OD値からRGBの色強度を算出するには「色強度 = 10−(平均光学密度) × 255」で換算可能である。
6. 統計学的解析Microsoft Excel® 2019を使用した。算出された数値に対して,標準偏差(standard deviation; SD)と変動係数(coefficient of variation; CV)を求め,平均値から ±3SDおよび ±2SDを算出した。また,JMP®を用いてXbar管理図を作成した。
結果をFigure 1に示す。胃および肝臓のH&E染色性は均一で目視評価において差異はみられなかった。

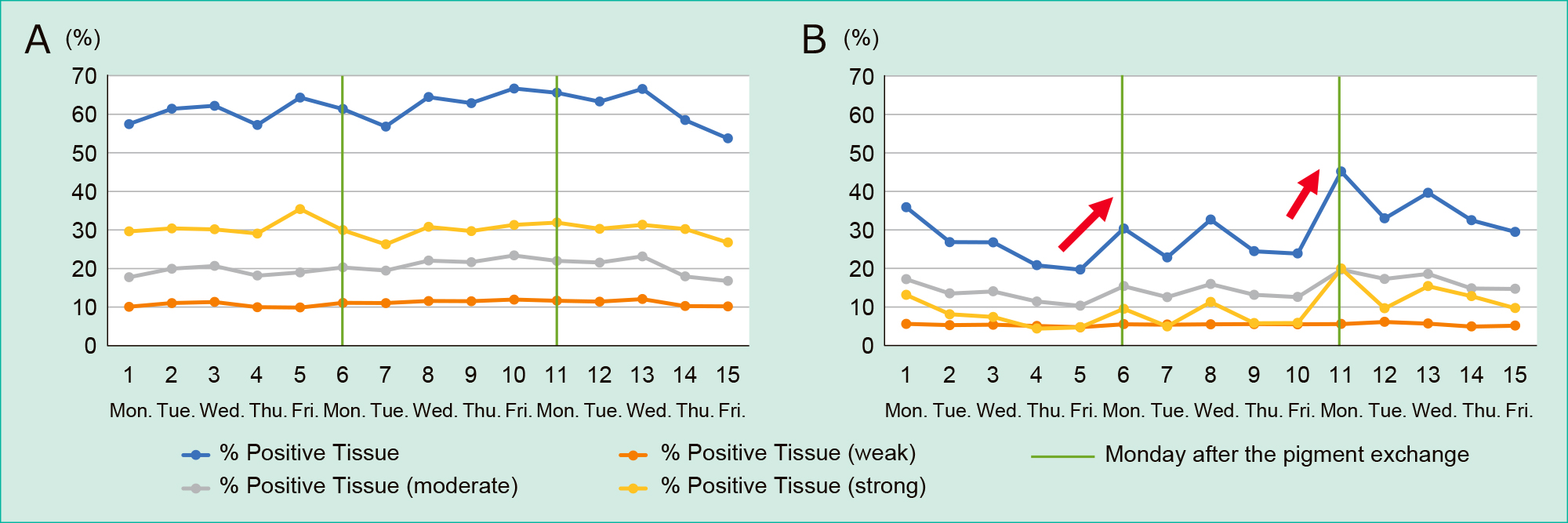
胃と肝臓の各色素の総陽性率の推移をFigure 2に,その平均値・SD・CVをTable 1に示した。グラフの縦軸は陽性率(%),横軸は染色日,色素交換後の月曜日を緑色の縦線で示した。染色強度別の陽性率のグラフは,弱陽性を赤色,中等度陽性を灰色,強陽性を黄色,全体を青色の折れ線グラフで示した。

A, B: Hx, C, D: Eo, A, C: stomach, B, D: liver
| Sample | Hx | Eo | |
|---|---|---|---|
| Stomach | Average | 42.98 | 58.59 |
| SD | 2.48 | 2.81 | |
| CV | 5.78 | 4.79 | |
| Liver | Average | 61.50 | 29.60 |
| SD | 3.94 | 7.12 | |
| CV | 6.41 | 24.05 | |
Figure 2では,HxはEoに比較して折れ線グラフの波がおだやかで,色素交換のタイミングで陽性率が低下していた。胃では,色素交換の翌日に陽性率が上昇する傾向が窺えた。逆にEoでは,色素交換のタイミングで陽性率が上昇する傾向が窺えた。
3. 胃および肝臓の各色素の染色強度別陽性率の推移各色素の染色強度別陽性率の推移を胃(Figure 3)と肝臓(Figure 4)についてそれぞれグラフ化した。いずれにおいても,弱陽性,中等度陽性の折れ線はおだやかで比較的均一であることがわかった。強陽性の折れ線(黄色)の変動は,染色枚数の増加する週末にかけて下降し色素交換後のタイミングで上昇していた。

A: Hx positive rate, B: Eo positive rate
A: Hx positive rate, B: Eo positive rate
胃および肝臓のHxとEoそれぞれのOD値を色強度に変換し,管理限界幅 ± 2SDおよび ± 3SDでXbar管理図を作成した(Figure 5,6)。胃および肝臓のHxとEoいずれも ±2SDおよび ±3SDの管理限界幅内に収まっていた。胃Hxの色強度のSDは3.6,CVは4.2%,胃EoのSDは4.9,CVは14.3%であった。肝臓Hxの色強度のSDは2.4,CVは2.4%,肝臓EoのSDは3.9,CVは7.5%であった。また,同じ色素であっても臓器ごとに色強度の領域が異なっていた。色強度がHx,Eoともに実質臓器である肝臓は,胃に比べて高い領域で推移しており,管腔臓器である胃では,肝臓に比べて低い領域で推移していた。このことから,色強度には臓器特性があることがわかった。

A: stomach, B: liver, Red line: 2SD UCL and LCL, Blue line: 3SD UCL and LCL

A: stomach, B: liver, Red line: 2SD UCL and LCL, Blue line: 3SD UCL and LCL
当院は,内部精度管理用のコントロール標本の対象臓器に,胃・肝臓・腎臓・心筋を採用している。毎朝始業時にコントロール標本を染色し,H&E染色性の確認を目視評価で行っている。目視で行う内部精度管理の判定基準は以下の通りである。基本として,核が青くEoが被っていない,細胞質が赤くHxが被っていないこと。胃は,①胃底腺の主細胞,壁細胞,副細胞の分別が良好,②血管と膠原線維の分別が良好,③神経叢と固有筋層あるいは粘膜下層の分別が良好,肝臓は,①核が青くEoが被っていない,②細胞質が赤く,Hxが被っていない,腎臓は,①近位と遠位尿細管の分別が良好,②糸球体がはっきりとみえる,心臓は①横紋がはっきりとみえる,としている。なお,前日染色したコントロール標本と比較してHxとEoの染色性は同一か確認している。
近年,病理組織標本のデジタル化が進んでおり,それに伴い数値化によるH&E染色標本の精度管理への試みが学会などで発表されている3),6)。我々の施設においてもその必要性が認められ,日常のH&E染色性確認に使用しているコントロール標本を用いて後ろ向きに自動画像解析ソフトHALO®を用いてH&E染色の染色性を数値化し,比較検討した。
本検討のH&E染色標本は,目視的に病理診断に支障をきたすような問題は認めない。HALO®解析では,Figure 2–4に示すようにHxの陽性率はバラつきが少なく管理内変動を認めた。Eoの陽性率は周期的変動を認め,色素交換後のタイミングで上昇していた。また,その周期的変動をよく反映しているのはHALO®解析で強陽性と判定された領域であることも興味深い結果である。Figure 5,6で示すXbar管理図より,本H&E染色標本は内部精度管理標本として適切な標本であり,よく管理された状態であるといえる。今回,Figure 5,6に一般的な ±3SDの管理限界幅(青線)と,より平均値の変動を狭めた ±2SDの管理限界幅(赤線)の2種類を併記した。±2SDにおいても外れ値を認めず,病理診断に適した安定した染色性を維持するためには,±2SDによる管理を行うことが望ましいと考える。Xbar管理図で外れ値を認めた場合は,切片厚による影響や染色液の劣化などの偶発的な要因が考えられる。本検討のSD値とCV値はいずれもHxよりEoの方が値が大きく,染色性のバラつきも大きいことがわかった。
Chlipalaら7)の報告では,切片厚の増減がH&E染色性に多大な影響を与えるとされている。しかし,本検討では試薬が安定しているとの仮定において,目視評価で差異を認めないためコントロール切片厚はほぼ一定であったことが窺える。日々の染色枚数の多少にも左右されるが,本検討でみられたEoの周期的変動は,Eoの強陽性の領域であったことから,Eo溶液の劣化やEo溶液中に含まれるアルコールが希釈された等の原因が考えられる。
このように画像データを数値化することで,目視では見えてこなかった染色の潜在的な差異を明確にすることができ,H&E染色の安定性評価および染色の安定性を維持するために役立つ可能性がある。
今回,画像解析を用いたH&E染色数値化の精度管理への応用を試みた。HALO®の解析により,SD値やCV値の算出,Xbar管理図の作成等,病理組織標本にも生化学検査のような統計学的解析を行うことができ,内部精度管理への応用が可能であった。また,同じ色素であっても色強度に臓器特性を認めることがわかり,複数の特徴の異なる臓器をコントロールとして用いることは,染色性の評価をより正確にするものと考える。
今後の課題として,画像解析を用いた継続的な内部精度管理の可能性と管理方法の確立に向け研究を行っていきたい。
本論文は,当院の医療倫理委員会の承認を得ている(承認番号B19017)。
なお,本論文の要旨は第60回日本臨床細胞学会秋期大会にて発表した。
本論文に関連し,開示すべきCOI 状態にある企業等はありません。
本研究に協力いただいた,当院病理部のスタッフ,助言いただいた天理大学医療学部臨床検査学科の西川武技師,筑波大学医学部附属病院の古屋周一郎技師,京都大学医学部附属病院の白波瀬浩幸技師,サクラファインテックジャパン株式会社の篠田宏技師,本田恭子技師,他関係者各位に感謝申し上げます。