2015 Volume 14 Issue 2 Pages A17-A20
2015 Volume 14 Issue 2 Pages A17-A20
水素原子の波動方程式を解く過程で得られる量子数に対応して,無数の原子軌道が導出される.これらのうち,いくつかのs軌道をガラスブロック内に実3次元で彫刻し,どのような節面が描かれるかを調べた.
前回は,水素原子の1s軌道における「確率の雲」の物理的意味を解説した [1].前回記したように,1s軌道というのは,水素原子の中の電子の最も安定な軌道,つまり,エネルギーが最も低い軌道である.水素原子のなかの電子は,より高いエネルギーの軌道への配置が無数にとれる.水素原子のシュレーディンガーの波動方程式を解くと,これら無数の軌道の数式を求めることができる.
今回は,これらの軌道を求める手続きの概略を記し,その過程で自然に求まる量子数に基づき,s, p, d, f,…などの軌道名が規定されるしくみを調べる.さらに,いくつかのs軌道を可視化する際の問題点とその解決方法について考察を加える.
本節には,今後必要となる最小限の数式を示した.煩わしいと思われる方は読み飛ばして,必要と思われるときに参照していただきたい.
水素原子の原子軌道を求める手続きの概略をFigure 1に示した.シュレーディンガーの波動方程式
(1) において,原子核は原点 (0, 0, 0) にあり,質量m,電荷 − eの電子が
(x, y, z) に位置している.
| (9) |
| (10) |
| (11) |

A procedure to solve the Schrödinger equation of the hydrogen atom
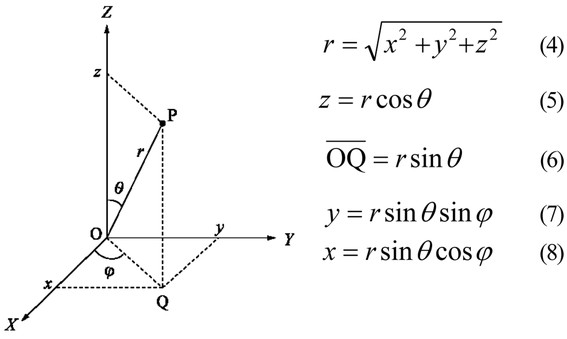
Relationship between spherical coordinates (r, θ, φ) and Cartesian coordinates (x, y, z)
原子軌道
原子軌道の名称と量子数の関係をTable 1に示す.1s, 2s,
2p,…などの名称における最初の数字は主量子数 n を表す.s, p,…などの英字は,方位量子数
Table 1. を見ると,s軌道では方位量子数 lと磁気量子数 mの値がいずれも0なので,次式となる.
| (12) |
上式においてθ の関数,および,φ の関数の項はたまたま定数となり,変数θ ,または,φ を含まない.したがって,s軌道の数式はどれも r だけの関数となる.
1s軌道はrだけの関数なので,その等値曲面は球殻状となることを,前回述べた [1].その他のs軌道も r だけの関数なので,等値曲面はすべて球殻状である.2s 軌道の関数値は,Figure 3下図に赤線で示すように,r = 2 au
のところで関数値が0となる.r の値がこれより小さいと正,大きいと負の値をとる.つまり,r =
2 auの球殻が節面となっている.この関数の最小値は,r = 4 auのところにあり,その値は −0.027 au−3/2 である.同じ絶対値を持つ
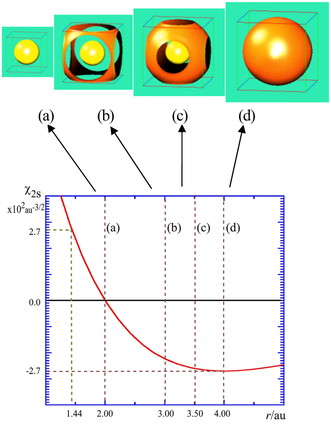
Isosurface representation of a hydrogen 2s orbital in a (a) 4 x 4 x 4 au3, (b) 6 x 6 x 6 au3, (c) 7 x 7 x 7 au3, or (d) 8 x 8 x 8 au3 cube (top) and function value of 2s orbital vs. distance from the nucleus r(bottom)
Figure 4 は,1s, 2s, 3s軌道における電子の存在確率を,ガラスブロック内にレーザーで彫刻したものである.この方法では,節面が暗部として明瞭に観察できるだけでなく,空間全体にわたる電子の存在確率の変化の様子が,点の密度として反映されている,さらに,各軌道の広がりの比較(大きさの比較)も可能であるという特徴がある [3,4].
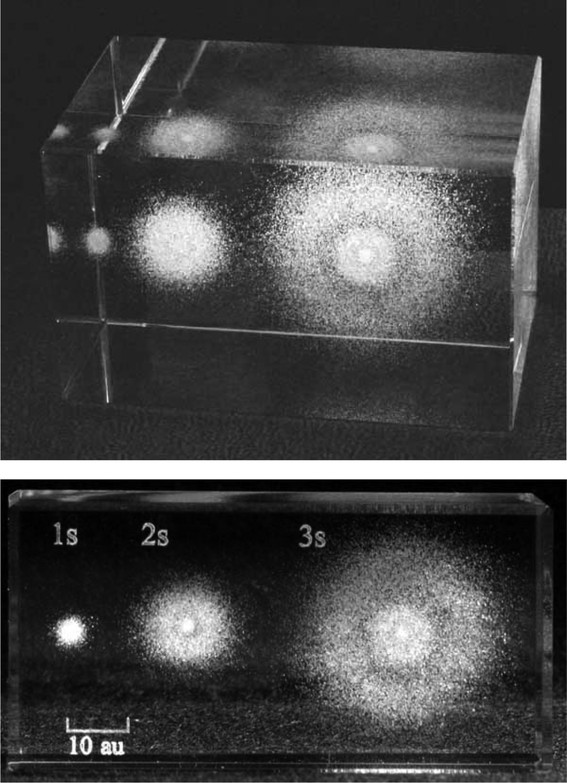
Probability density distribution in the 3-dimensional representation of hydrogen 1s, 2s, and 3s orbitals in a 5 x 5 x 8 cm3(top) or a 4 x 4 x 8 cm3 glass block (bottom) [4]
当初は,各軌道データの1/4や1/8をカットして,節面を見やすくすることも試みた.しかし,彫刻点の数を調整することにより,カットせずとも,節面が明瞭に観察できる彫刻条件が見出せることが明らかとなった.
ガラス彫刻の特徴は,節面を持つ原子軌道の場合に顕著に現れることを,s軌道について取りまとめた.原子軌道 (2) における